Аминокислоты, пептиды и белки - Дэвени Т., Гергей Я. 1976
Газохроматографический анализ производных аминокислот. Состояние проблемы. Возможности и ограничения метода
Свойства производных аминокислот
Получение производных аминокислот путем защиты функциональных групп
При блокировании одной или нескольких функциональных групп молекула аминокислоты перестает быть цвиттерионом. Даже простая этерификация карбоксильных групп приводит к образованию заметно летучих эфиров [26]. Эфиры аминокислот в свободном состоянии впервые были выделены Байером и др. [5]. Однако эти соединения наряду с их высокой летучестью обладают рядом неблагоприятных свойств. Как правило, на обычных набивных колонках они дают большие “хвосты”, поэтому для их разделения необходимы специальным образом приготовленные колонки, содержащие неактивный или инактивированный материал носителя. Более того, у свободных эфиров аминокислот имеется склонность к поликонденсации и образованию дикетопиперазинов, особенно при высоких температурах. В связи с этим при газохроматографическом разделении хлоргидратов н-бутиловых эфиров аминокислот в газ-носитель добавляли аммиак [78]. Хлоргидраты метиловых эфиров оказались не подходящими для анализа из-за термического разложения [65]; значительно лучшие результаты получали с соответствующими ацетатами. Точными количественными исследованиями с термостабильным внутренним стандартом было показано при этом, что никаких дикетопиперазинов не образуется. Сам факт обнаружения дикетопиперазинов, дипептидов сильно полярного характера, на колонках 2%-ного неопентилгликосукцината на флуоропаке 80 [121] вызывает недоумение. Однако возможность их образования в ходе процессов превращения или разделения всегда необходимо иметь в виду.
Одновременная защита NH2-и СООН-групп приводит не только к более высокой термической устойчивости, но также придает и другие свойства пептиду, выгодные для ГХ. Исключая из рассмотрения здесь другие возможные функциональные группы в молекуле аминокислоты, можно отметить, что эфиры N-защищенных аминокислот дают лишь небольшие “хвосты” и в соответствии с этим регистрируются в виде острых пиков. Аминогруппы защищали с помощью различных группировок, преимущественно ацильных остатков. Их влияние на удерживание соответствующих аминокислотных производных было исследовано достаточно детально. Вейганд и др. [121], например, обнаружили, что величины удерживаемых объемов при присоединении ацильных остатков возрастают в следующем порядке:
Н ≤ CF3CO < СН3СО ≤ НСО.
Таблица 14 Производные аминокислот для газовой хроматографии
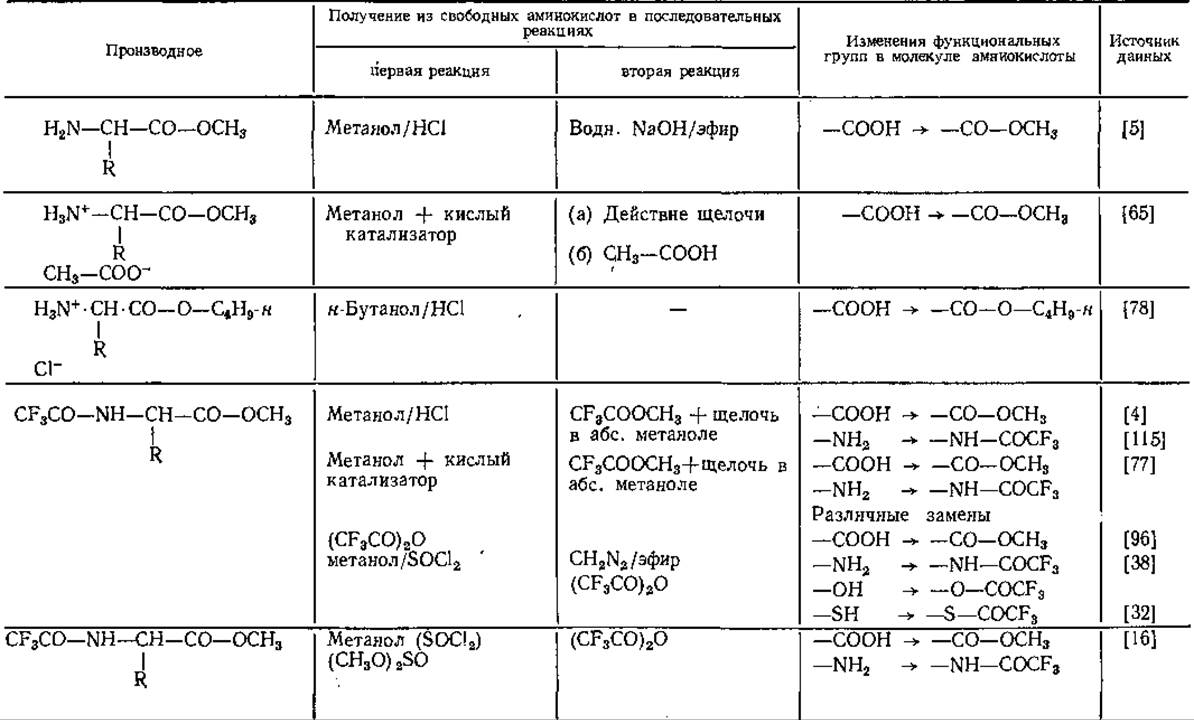

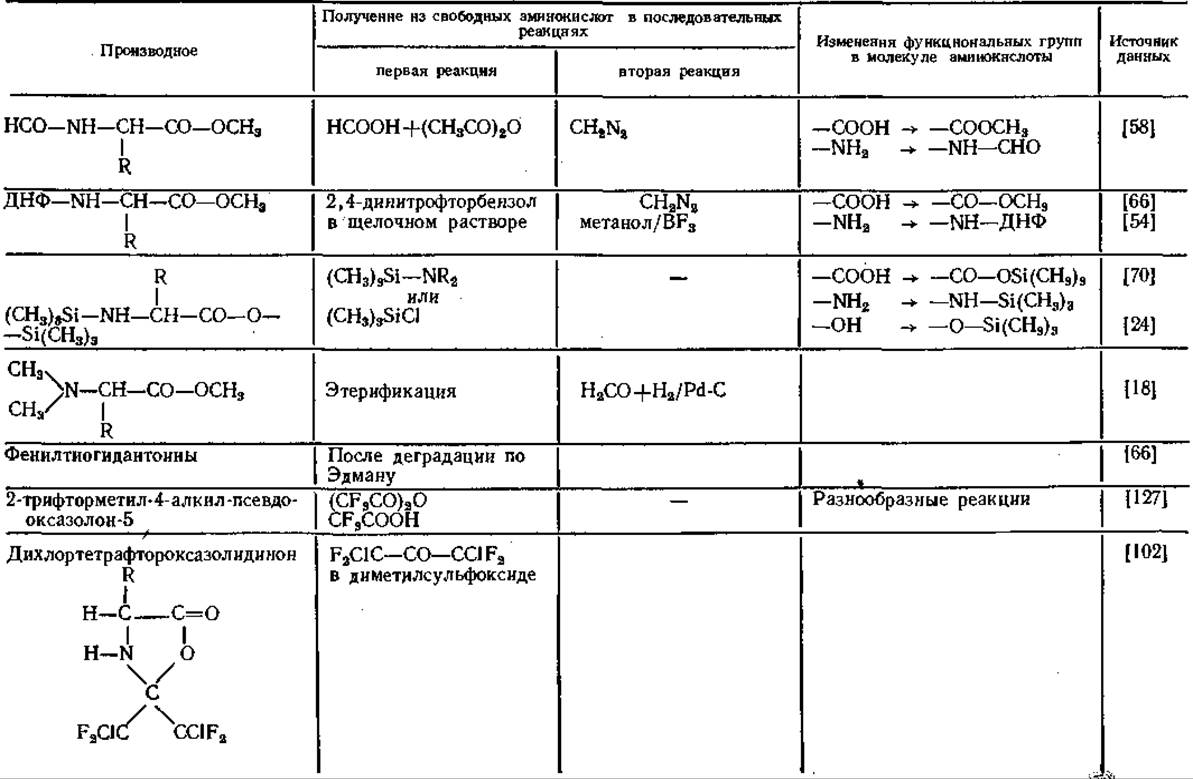
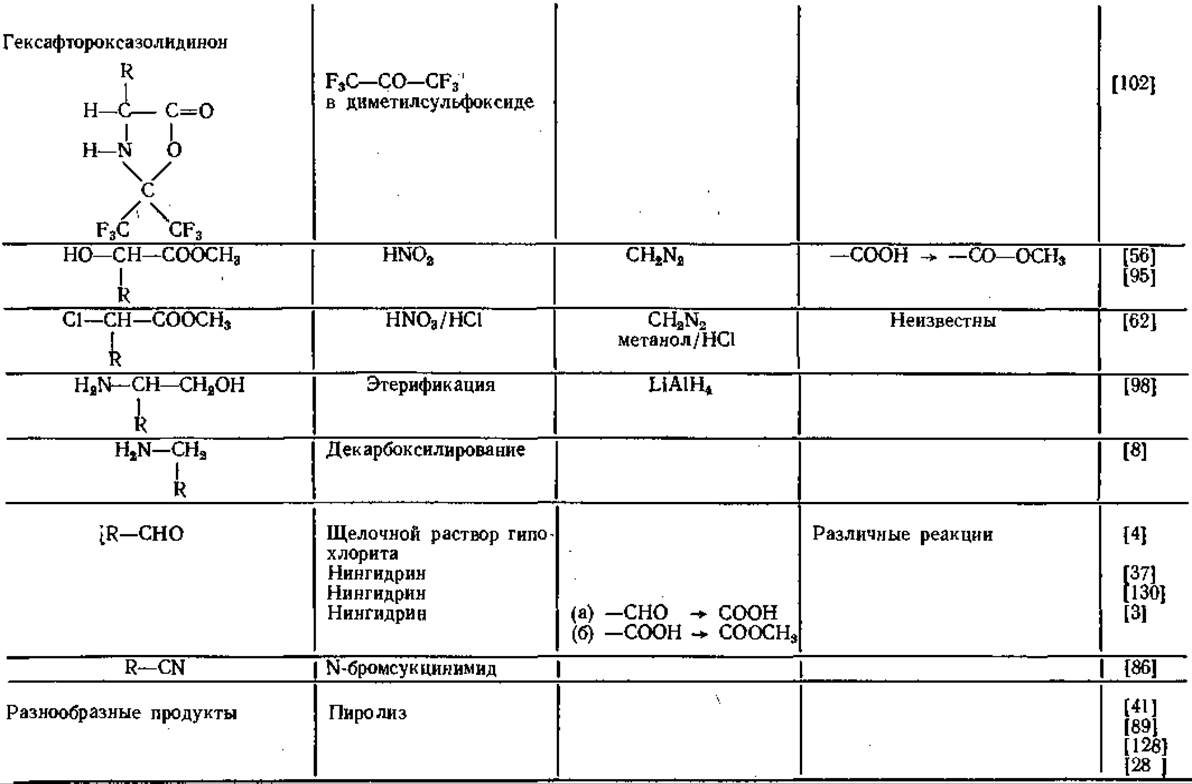
Аналогичные результаты получены и другими авторами [59, 79]. Гептафторбутирил- [91, 100] и пентафторпропионил-производные [91] удерживаются колонкой еще меньше, чем N-трифторацетил-производные. Благодаря исключительным свойствам трифтор ацетильных остатков (ТФА) соответствующие производные приобрели в последнее время большое значение в ГХ-анализе аминокислот.
ТФА-группу в химии пептидов стали использовать после появления работы Вейганда и Сендеса [103]. Относительно высокое давление паров ТФА-производных способствует их разделению и очистке путем возгонки в высоком вакууме [108] и дробной перегонки [109]; в некоторых случаях это явление было детально исследовано [113]. Применение этих производных для ГХ аминокислот и пептидов казалось вполне оправданным. Байер и Дести [4] по предложению Вейганда [99] первыми исследовали разделение метиловых эфиров N-ТФА-аминокислот. В последующей работе наряду с варьированием хроматографических условий использовали различные эфирные группировки (см. табл. 14). Последовательность стадий образования производных в большинстве случаев одинакова: аминокислоты сначала соответствующим методом этерифицируют, а затем трифторацетилируют.
Обратный порядок — ацилирование свободных аминокислот трифторуксусным ангидридом в безводной трифторуксусной кислоте [117] — не подходит, особенно для количественного получения этих соединений. В зависимости от взятого количества ангидрида и от условий реакции при этом образуются азлактоны [110, 127] и смешанные ангидриды [117, 125]; к тому же превращение Гис и Три протекает с невысокими выходами [16]. При ацилировании свободных аминокислот тиоэтиловым эфиром трифторуксусной кислоты в щелочном растворе получают самые различные выходы [14], причем диаминокислоты Лиз и Орн дают только ε-N-ТФА-производные, и, следовательно, их можно трифторацетилировать по а-положению с помощью других методов.
При трифторацетилировании эфиров аминокислот ацилирующий агент определяет тип образующегося производного. Обработка метиловым эфиром трифторуксусной кислоты в абсолютном метаноле С добавлением эквивалентного количества третичного основания [109] приводит к ацилированию только свободных аминогрупп [77, 115]:
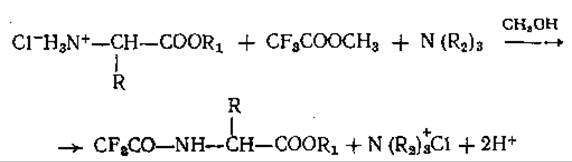
В зависимости от строения эфиров аминокислот скорости их ацилирования значительно различаются. Так, например, большие отличия в сигналах при анализе смеси эквимолярных количеств замещенных Гли, Лей и Иле с помощью пламенно-ионизационного детектора [77] можно было бы объяснить неполным ацилированием Иле из-за стерических трудностей, возникающих при его взаимодействии с ацилирующим агентом. Неполное ацилирование может быть одной из причин появления нескольких пиков для одной аминокислоты.
Вместе с тем при ацилировании трифторуксусным ангидридом с добавлением подходящего растворителя или без него реакция протекает не только быстрее и полнее, но при этом непосредственно ацилируются хлоргидраты эфиров [16, 19, 27, 32, 60, 88]. По аналогии с производивши свободных аминокислот [126] таким образом можно получить соответствующие N, О-бис-ТФА-производные аминокислот Сер, Тре, Тир и Опр. Соответственно реакция с хлор- гидратом Цис приводит к N, S-бис-ТФА-производному. Степень ацилирования эфиров полифункциональных аминокислот сильно зависит от условий реакции и времени инкубации с трифторуксусным ангидридом [19, 53, 60]. При кратковременном ацилировании было обнаружено образование только N-ТФА-производных оксиаминокислот [53], для которых характерны большие величины удерживаемых объемов.
Превращение основных аминокислот также имеет специфические особенности. Макисуми и Сароф [60] нашли, что Три ацилируется и по индольному азоту, однако для количественного образования этого продукта необходимо относительно длительное ацилирование [53] — в противном случае на хроматограмме появляются два пика. ТФА-группа при индольном азоте довольно устойчива к метанолизу [60]. При трифторацетилировании ихлоргидрата эфира Apr можно обнаружить только N.N-бис-ТФА-производные эфира Apr; в препаративных опытах не найдено образования соответствующего три-N-ТФА-производного [118]. Сообщение о гомогенности вышеописанных ТФА-производных противоречит данным, опубликованным ранее [16]; по-видимому, это можно объяснить различными условиями реакции [60]. Крукшенк и Шиэн [16] обнаружили также частичное расщепление гуанидиновой группы, в результате которого образуется эфир бис-ТФА-Орн и другие неидентифицированные продукты. Ситуация с превращением эфира Гис пока не ясна: на газовой хроматограмме получен асимметричный пик с относительно большим объемом удерживания; если учесть значительный разброс количественных данных, этот результат может указывать на разложение вещества в ходе процесса. С другой стороны, после продолжительной инкубации с трифторуксусным ангидридом наблюдали острый пик, удерживаемый объем которого составлял V16 соответствующей величины вышеупомянутого N-ТФА-Гис [60]. Остается неясным, является ли этот продукт Nim, Na -бис- ТФА-соединением. Литературные данные об условиях ацилирования (касающиеся ацилирующего агента), о собственно ацилировании и о получаемых продуктах не однозначны, поэтому очень трудно выявить превосходство какой-либо из предлагаемых методик.
Для проведения ГХ-анализа одинаково важны как химическая, так и термическая устойчивость рассмотренных выше производных. Химическая устойчивость прежде всего определяет условия обработки, хранения и дозировки образцов. Как уже упоминалось, в результате слишком длительного анализа одного и того же образца могут образовываться несколько продуктов и, следовательно, получаться неоднозначные данные. Если ТФА-производные эфиров простых моноаминомонокарбоновых кислот — устойчивые вещества, которые могут храниться неограниченное время, то этого нельзя сказать о производных аминокислот сложной структуры, содержащих несколько ацильных групп. Большинство таких соединений крайне чувствительны к гидролизу и частично разлагаются в присутствии следов воды [531. У оксиаминокислот Сер и Тре это может привести к полной потере защитных групп, так как кислота, образующаяся при гидролизе О-ТФА-группы, по типу кислотноосновного катализа может способствовать N—О-ацильной миграции и таким образом вызвать полную потерю N-ТФА-групп [126]. Рекомендуется эти соединения хранить и даже вносить в прибор в присутствии избытка трифторуксусного ангидрида, к которому могут добавляться другие растворители.
Что касается термической устойчивости этого класса соединений, то ситуация здесь такая же: производные простых аминокислот термостабильны и не разлагаются в ходе ГХ-анализа, а N-ТФА- производные Сер и и Тре, имеющие свободные оксигруппы, обнаруживают тенденцию к ß-элиминированию воды при возгонке в высоком вакууме [126]. Эта тенденция еще более усиливается при О-ацилировании. Фиг. 71 показывает, что такое ß-элиминирование имеет место в ходе испарения перед ГХ-анализом [53]. Видно, что “-бутиловый эфир бис-ТФА-Тре дает два сигнала, первый из которых возрастает с увеличением температуры испарения. Совершенно аналогичные результаты были получены с метиловым эфиром N-ТФА-Цис: при очень высоких температурах в системе можно было обнаружить только метиловый эфир N-ТФА-аминоакриловой кислоты [105]. Возникающие трудности можно обойти, вводя образец на колонку при относительно низкой температуре с последующим программированием температуры 153]. Однако некоторые данные говорят о том, что необходимо более критически оценивать ситуацию — они были получены при исследовании большого числа разделяющих фаз для ГХ н-амиловых эфиров ТФА-аминокислот 1191. Авторы обнаружили каталитическое влияние некоторых полиэфирных фаз на разложение О-ТФА-производных оксиаминокислот. Высота пика зависела от того, сколько времени вещество находилось на колонке. Иногда параллельно образовывалось N-ТФА-соединение со свободной ОН-группой, иногда же вообще не обнаруживали никакого пика. По-видимому, сначала отщепляется О-ТФА-остаток, а затем посредством N—О-ацильной миграции может происходить отщепление всех N-защитных групп и в результате — исчезновение пика [191.
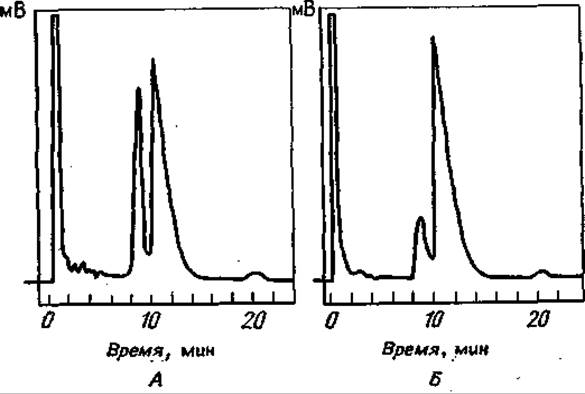
Фиг. 71. Термическое разложение w-бутиловых эфиров бис-ТФА-Тре при различных температурах испарения[53].
Разделение проводили на стальной колонке (длина 1 м, внутренний диаметр 0,4 см), содержащей 1% неопентилгликосукцината на газохроме А (60—80 меш); температура колонки 93°С; скорость потока N2 37 мл/мин; температура испарения 223°С (А) и 142°С (Б).
Количественные исследования воспроизводимости параметров ГХ метиловых эфиров ТФА-аминокислот показали, что происходит частичное разложение этих производных, причем обычно главную роль в этом процессе играет термическое ß-элиминирование [161. Имеется слишком мало данных, чтобы можно было судить о термостабильности производных основных аминокислот, к тому же, как правило, для них наблюдали относительно малые пики [16, 17].
Можно было бы ожидать, что подобные явления присущи всем ТФА-производным и совершенно не зависят от конкретной эфирной группы. Ряд авторов использовали для защиты карбоксильных групп эфиры высших спиртов. Как продемонстрировали Маки-суми и др. [59], удерживаемый объем образующихся производных с увеличением молекулярного веса, как и следовало ожидать, увеличивается. Для процесса получения производного пониженная летучесть является преимуществом, поскольку при испарении избытка растворителя в токе азота [19] или в вакууме при комнатной температуре [53] для метиловых эфиров ТФА-аминокислот, например, характерны заметные потери.
В ряде методик превращения аминокислот первый шаг состоит в этерификации свободных аминокислот [31], образование метиловых эфиров которых затруднено, тогда как этерификация N-защищенных аминокислот (N-формиламинокислот или ДНФ-соединений) идет довольно легко в метаноле /BF3 или диазометане. В литературе описано множество различных методов этерификации, однако количественные характеристики этой реакции у разных авторов не согласуются друг с другом. Кроме классической реакции в присутствии соляной кислоты и метанола [4, 5, 115], используют реакции, в которых в качестве катализаторов применяются кислые ионообменные смолы [65, 77]. Но лучшие результаты были получены при введении в метанольную смесь, где происходит превращение аминокислот, сухого газообразного НСl [60]. Хаген и Блэк [32] проводили реакцию в метаноле в присутствии SOCl2 по методу Буассона и др. [12], а Крукшенк и Шиэн [16], основываясь на данных Восса и Бланке [94], добавляли также (CH3О)2SО. Высшие эфиры обычно образуются гораздо труднее и только при условии, что выделяющаяся вода одновременно удаляется из смеси, где протекает реакция. Это может достигаться, например, в присутствий избытка этанола и с помощью азеотропной отгонки водно-этанольной смеси в ходе этерификации [129], причем в качестве кислоты в смесь вносят НВr [42].
Другой способ удаления воды рекомендован Зомзели и др. [131]. Основываясь на ранее описанной методике [57], авторы добавляли к кислому этанольному раствору кеталь, полученный из соответствующего спирта и ацетона (диалкоксипропан). Кеталь удаляет воду, используя ее на расщепление до спирта и ацетона. Однако, согласно некоторым данным [19], ни метод Джонсона и др. [42] с использованием НСl вместо НВr, ни последняя методика [131] не годятся для получения н-амиловых эфиров. Применение кислых ионообменных смол [77] также не привело к удовлетворительным результатам. Количественное образование н-амиловых эфиров идет лишь при более высокой температуре и при введении в смесь газообразного НСl [19]. Превращение аминокислот в высшие эфиры затруднено тем, что определенные аминокислоты, такие, как цистин, очень плохо растворимы в спиртах, насыщенных НСl. н-Бутиловые эфиры были приготовлены [53] переэтерификацией хлоргидратов метиловых эфиров аминокислот в смеси НСl — бутанол при высокой температуре, поскольку соли метиловых эфиров довольно хорошо растворяются в высших спиртах.
В отличие от эфиров ТФА-аминокислот ацетиламинокислоты, впервые изучавшиеся Янгсом [129] в виде н-бутиловых эфиров, менее летучи и, следовательно, имеют больший удерживаемый объем. По-видимому, полярные основные аминокислоты, такие, как Apr, а также Гис, Три и цистин, вряд ли можно подвергать газовой хроматографии. Их нет среди 35 аминокислот (в том числе 18 природных), разделенных с помощью ГХ в виде н-амиловых эфиров Джонсоном и др. [42]. Эти авторы разделяли также н-бутиловые, изобутиловые и изоамиловые эфиры, приготовленные аналогично ТФА-производным. Эти эфиры получали в виде бромгидратов, а затем прямо ацетилировали уксусным ангидридом. Известно, что при этом из оксиаминокислот образуются также N, О-диацетильные соединения, но пока нет никаких данных о том, как взаимодействует ангидрид с другими полифункциональными аминокислотами. По сравнению с соответствующими ТФА-производными О-ацетил-соединения гораздо меньше подвержены гидролизу и, по-видимому, обладают более высокой термоустойчивостью; правда, соответствующих количественных измерений еще не проводили. В литературе описано разделение н-пропиловых эфиров ацетиламинокислот [29], но подробные методики не были опубликованы.
Те же ограничения, что и для эфиров ацетиламинокислот, относятся к метиловым эфирам N-формиламинокислот, полученным и разделенным на газовом хроматографе Лоссе и др. [58]. Эти соединения тоже очень слабо летучи и имеют относительно большие удерживаемые объемы. Их можно приготовить обработкой свободной аминокислоты смесью муравьиной кислоты и уксусного ангидрида с последующей этерификацией диазометаном (см. ниже). Из полифункциональных аминокислот исследовали поведение при ГХ лишь Глу и Асп. Диметиловый эфир N-формил-Глу при нагревании превращается в метиловый эфир пирролидон-карбоновой кислоты, и в таком виде его обнаруживают в газовом хроматографе. Несмотря на то что формильные производные простых аминокислот образуются с высокими выходами, эти соединения до сих пор еще не использовали для аминокислотного анализа:
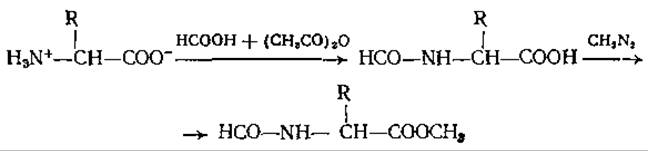
ГХ-анализ метиловых эфиров ДНФ-аминокислот представляет интерес с двух точек зрения [66]. Во-первых, ДНФ-аминокислоты получают в ходе деградации пептида по Сэнгеру [76] и их быстрое и чувствительное детектирование в газовом хроматографе идеальным образом могло бы дополнить этот важный аналитический метод определения последовательности аминокислот. Во-вторых, как показано в работах Лендоуна и Липски [54], эти соединения с крайне высокой чувствительностью можно определять с помощью электронозахватного детектора. Большим преимуществом ГХ-анализа ДНФ-производных является то, что другие сопутствующие вещества с такими же хроматографическими свойствами не регистрируются, и поэтому в результате получается довольно простая аналитическая картина. Реакция образования ДНФ-аминокислот при действии на свободные аминокислоты 2,4-ДНФБ в слабощелочном водном растворе протекает количественно, так же как и последующая этерификация диазометаном или BF3 в метаноле:
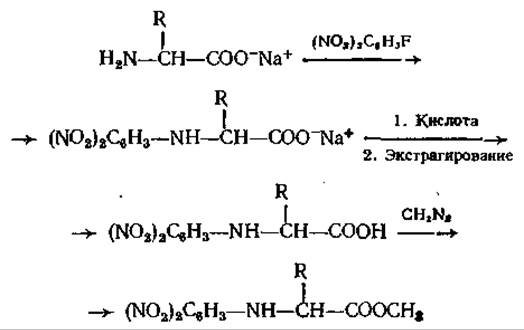
Все эти свойства чрезвычайно выгодны для ГХ, но недостатками ДНФ-производных являются высокая полярность и относительно низкое давление паров. К настоящему времени достаточно изучена хроматография только ДНФ-производных простых аминокислот. Из-за процессов разложения при необходимых высоких температурах метод оказался непригодным для Сер, Тре, Три и Гис. Есть сообщение [54] о том, что обнаружены метиловые эфиры бис-ДНФ-Лиз и бис-ДНФ-Орн, но данные о соответствующем эфире Apr отсутствуют. Как показано при исследовании пептидов неизвестного строения [40], метод применим для количественного анализа простых аминокислот.
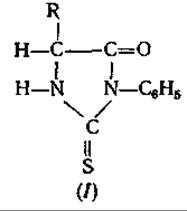
Пожалуй, следует упомянуть и о ГХ-анализе фенилтиогидантоинов (І) аминокислот [66]. К этим соединениям, образующимся, как известно, при деградации по Эдману [22], относится все то, что говорилось о метиловых эфирах ДНФ-аминокислот; их разделение с помощью ГХ представляет интерес только р связи с деградацией пептидов.
Реакция солей аминокислот с триметилхлорсиланом [70] или реакция свободных аминокислот с триметилсилилдиалкиламинами. [9] приводит к образованию триметилсилиловых эфиров N-триметилсилиламинокислот [70], что означает получение в одну стадию производных аминокислот, пригодных для газовой хроматографии:
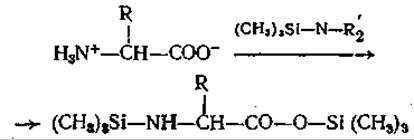
Эти соединения чрезвычайно легко гидролизуются, и тем не менее их образование может быть количественным [71]. Однако в экспериментах на газовом хроматографе было показано, что данные производные не подходят для количественного аминокислотного анализа [73]. Высокая чувствительность этих соединений к воде, наличие OH-, SH-, NH2- и СООН-групп способствуют, как и в случае О-ТФА-производных [131], их частичному разложению в ходе разделения на колонке. Эти эффекты можно предотвратить только предварительным добавлением больших количеств триметилсилилдиэтиламина. Однако возникающие в связи с этим осложнения и остающаяся неопределенность указывают на то, что эти соединения не стоит, пожалуй, использовать для ГХ.
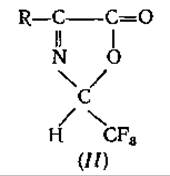
2-трифторметил-4-алкилпсевдооксазолон-5 (II), исследованный Вейгандом и др. [127], также оказался непригодным для определения аминокислот, несмотря на его исключительно благоприятные свойства для ГХ. Дело в том, что из-за побочных реакций образование производных протекает неколичественно [84] и, кроме того, некоторые аминокислоты не доступны для реагента или не подвергаются его воздействию непосредственно [127]:
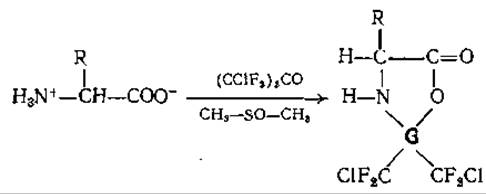
Как было впервые показано Симмонсом и Вилли [82] для Ала и впоследствии Вейгандом и др. [127] для большого числа других аминокислот, в результате реакции свободных аминокислот, суспендированных в абсолютном диметилсульфоксиде, с симметричным дихлортетрафторацетоном при комнатной температуре образуется тризамещенный 2,2-(бис-хлор-дифторметил)-оксазолидинон-5 (дихлортетрафтороксазолидинон):
Эти соединения прекрасно разделяются в газовом хроматографе. Еще более подходящим и летучим является 4-замещенный 2,2-(бис-трифторметил)-оксазолидинон-5(гексафтороксазолидинон), полученный пропусканием через суспензию аминокислоты в диметилсульфоксиде или тетрагидрофуране газообразного гексафторацетона при низкой температуре [102]:
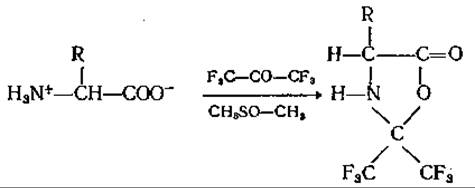
Образование подобных соединений из простых аминокислот протекает с высокими выходами. Что касается полифункциональных аминокислот, пока нет достаточно убедительных данных об их качественной и количественной хроматографии. С помощью указанных производных можно быстро и количественно разделить даже такие стереоизомеры аминокислот, как Иле и алло-Иле; они могут применяться также для различных количественных определений [116]. Следует упомянуть, что гексафтороксазолидиноны даже более летучи, чем соответствующие метиловые эфиры ТФА-аминокислот.