Аминокислоты, пептиды и белки - Дэвени Т., Гергей Я. 1976
Газохроматографический анализ производных аминокислот. Состояние проблемы. Возможности и ограничения метода
Газовая хроматография пептидов
Метод Бимана и др.
На основании работ Янгса [129] по ГХ эфиров N-ацетиламинокислот следовало ожидать, что разделение соответствующих производных пептидов возможно лишь в исключительных случаях. Исследования в этом направлении были проведены Эвансом [25]. Биман и др. [6] изучали полиаминоспирты, образующиеся из эфиров N-ацетилпептидов при восстановлении LiAlH4; их получение ранее было описано Каррером и Николаусом [50]:
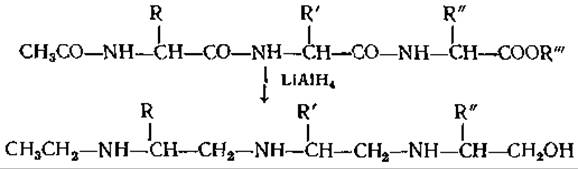
Эти соединения настолько летучи, что даже три- и тетрапептиды можно подвергать ГХ. Летучесть существенно снижается, если в исходной молекуле присутствуют оксигруппы или они образуются при восстановлении. Поскольку из-за больших удерживаемых объемов и образования “хвостов” разделение оказалось неудовлетворительным, было предложено [7] элиминировать оксигруппы путем замещения их на хлор и последующего восстановления:
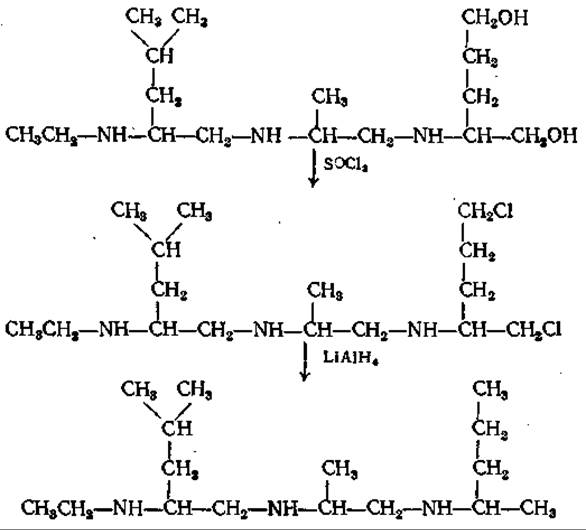
Получающиеся в результате этих реакций полиамины имели при разделении в газовом хроматографе заметно меньшие удерживаемые объемы и давали более острые пики. С помощью масс-спектрометрии все изучаемые пептиды можно было идентифицировать в виде как полиаминоспиртов, так и полиаминов. Определенные аминокислоты в ходе двукратного восстановления теряют некоторые структурные особенности, а образующиеся из них продукты дают при масс-спектрометрии пики с одинаковым числом единиц массы и, следовательно, становятся неразличимьми. К ним относятся Ала и Сер, Вал и Глу, Про и Опр, а также а-аминомасляная кислота, Тре и Асп. В таких случаях их можно различить на масс-спектре, если восстановление вести в присутствии LiAlD4, когда восстанавливаемые группы метятся одним или несколькими атомами дейтерия [7]. Проиллюстрируем это на примере трех последних аминокислот: при двукратном восстановлении боковая цепь а-аминомасляной кислоты (І) остается неизменной, в Тре (ІІ) включается один атом дейтерия и в Асп (III) — три:
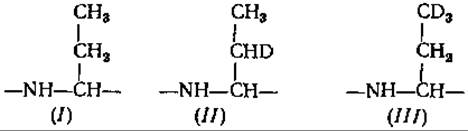
Благодаря отличиям в массах соответствующих фрагментов можно различить все три аминокислоты. К сожалению, этот довольно изящный метод имеет недостатки, из-за чего область его применения ограничена. Наиболее серьезный недостаток состоит в том, что побочные продукты, которые могут образоваться при неполном восстановлении, невозможно выделить. Когда имеют дело со смесью пептидов неизвестного состава, трудно отличить истинное производное от побочного продукта, так как последний также может детектироваться в газовом хроматографе. Еще одна побочная реакция в результате разрывов пептидных связей при восстановлении может привести к появлению новых соединений (свободных аминов и альдегидов), которые еще более усложняют картину. Известно, что при восстановлении третичного амида с помощью LiАlН4 происходит расщепление амидной связи и образуются альдегиды и амины [104]. Подобные реакции расщепления уже наблюдали для пролиновых пептидов [74]. Они встречаются также в ходе восстановления пептидов другими гидридами металлов [63]. Мы вынуждены признать, что этот метод может применяться только для не слишком сложных смесей нескольких простых аминокислот. Но даже при таком ограничении его важным преимуществом является то, что для анализа требуется очень небольшое количество вещества (несколько миллиграммов).