Аминокислоты, пептиды и белки - Дэвени Т., Гергей Я. 1976
Анализ белков с помощью низковольтного электрофореза
Электрофорез на ацетат-целлюлозной мембране
Принцип метода. Белки, нанесенные на смоченную буферным раствором ацетат-целлюлозную мембрану, мигрируют в электрическом поле в соответствии с общим зарядом их молекул.
Область применения этого метода та же, что и электрофореза на бумаге.
ПРИБОРЫ
1. Камера для электрофореза. На фиг. 6 схематически представлена камера, которую предложил Кон [15] специально для электрофореза на ацетат-целлюлозной мембране.
2. Источник тока: см. стр. 46.
МЕТОДИКА
1. Приготовление буферного раствора: см. стр. 47.
2. Заполнение электрофоретической камеры буферным раствором. Буферный раствор наливают в камеру до уровня 2 см в высоту.
3. Увлажнение мембраны. Держа мембрану двумя пинцетами, медленно и постепенно погружают ее в буферный раствор. Скорость погружения не должна превышать скорости смачивания мембраны. При слишком быстром погружении могут образоваться пузырьки воздуха, мешающие электрофоретическому разделению. После смачивания мембраны избыток буферного раствора удаляют фильтровальной бумагой.
4. Закрепление мембраны в приборе. Оба конца влажной мембраны кладут на нижнюю часть специального держателя в камере.
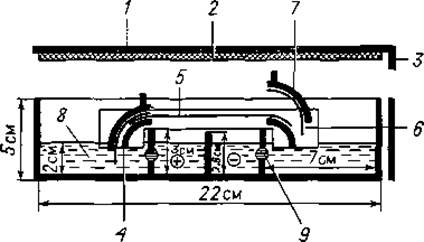
Фиг. 6. Схема камеры Кона [15].
1 — крышка; 2 — слой пенопласта на внутренней стороне крышки; 3 — край крышки; 4 — рамка для растягивания ацетат-целлюлозной мембраны; 5 — ацетат-целлюлозная мембрана; 6 — фитиль из фильтровальной бумаги; 7 — зажим для фильтровальной бумаги; 8 — буферный раствор; 9 — отверстие, соединяющее отсеки с буферным раствором.
Затем между верхней частью держателя и мембраной с обеих сторон помещают полоски фильтровальной бумаги. Опуская верхнюю часть зажима на нижнюю, растягивают и фиксируют мембрану, одновременно прижимая к ней полоски фильтровальной бумаги, которые опускаются в буферный раствор и выполняют роль проводников электрического тока (фиг. 6).
5. Нанесение исследуемого образца. Капиллярной пипеткой наносят 5 мкл сыворотки приблизительно в центр растянутой мембраны. Проще всего к центру мембраны приложить линейку и вести вдоль нее кончик пипетки, так чтобы сыворотка впитывалась в мембрану по прямой линии, не доходя 3 мм до краев мембраны. После нанесения камеру закрывают крышкой.
6. Электрофорез. Электрофорез продолжается 2 ч при комнатной температуре и градиенте напряжения 10—12 В/см.
7. Высушивание и окрашивание мембраны. После окончания электрофореза мембрану извлекают из камеры, пластмассовыми зажимами закрепляют на стеклянной палочке и высушивают сначала при комнатной температуре, а затем при 100°С в течение 5 мин. На последнем этапе белки на мембране фиксируются.
Окрашивать ацетат-целлюлозную мембрану можно так же, как бумажную электрофореграмму (см. стр. 54), либо используя пунцовый S (см. стр. 73).
ПРИМЕЧАНИЯ
1. Описанный микроэлектрофорез на ацетат-целлюлозной мембране позволяет анализировать от 5 до 1000 мкг белка, при этом разделение происходит лучше, чем при электрофорезе на бумаге. Значительными достоинствами этого метода являются быстрота фракционирования и весьма малое количество необходимого для исследования материала.
2. В продаже имеются листы ацетат-целлюлозной мембраны размером 54 х 57 см. Их можно использовать для электрофореза в крупногабаритных приборах.
В макроварианте вырезают полоски мембраны шириной 4 см и увеличивают объем наносимой сыворотки до 0,05—0,06 мл. В этом случае электрофорез продолжается 4—5 ч при напряжении 200 В или 1,5—2 ч при напряжении 400 В. Ионную силу буферного раствора Михаэлиса при этом уменьшают, разбавляя его дистиллированной водой в соотношении 3 :2. В остальном макрометод ничем не отличается от микрометода.
3. Электрофорез на ацетат-целлюлозной мембране можно проводить практически в любой камере для горизонтального электрофореза, в которой размещаются полоски длиной свыше 8—10 см. Контакт с буферным раствором может осуществляться непосредственно концами мембраны или полосками фильтровальной бумаги, выполняющими роль фитилей. Универсальную конструкцию имеет прибор для электрофореза фирмы Schandon (Англия) [15].
4. Широко распространены ацетат-целлюлозные мембраны следующих фирм: Oxoid, Охо Ltd. (Англия), Millipore Filter Corporation (США), Sartorius Membranfilter Gesellschaft (ФРГ).
ОКРАШИВАНИЕ АЦЕТАТ-ЦЕЛЛЮЛОЗНЫХ ЭЛЕКТРОФОРЕГРАММ
ОКРАШИВАНИЕ ПУНЦОВЫМ S
Окрашивающий раствор: 0,2%-ный раствор пунцового S в- 3%-ной трихлоруксусной кислоте.
Отмывающий раствор: 5%-ная уксусная кислота.
Методика. Мембраны на 5—10 мин погружают в окрашивающий раствор, затем ополаскивают в нескольких сменах отмывающего раствора, пока фон не станет совершенно белым. После этого полоски мембраны высушивают между слоями фильтровальной бумаги.
ОКРАШИВАНИЕ НИГРОЗИНОМ
Окрашивающий раствор: 0,002%-ный раствор нигрозина в 2%- ной уксусной кислоте.
Отмывающая среда: водопроводная вода.
Методика. Полоски мембраны, фиксированные нагреванием при 80—100°С или в 5%-ной трихлоруксусной кислоте, погружают в окрашивающий раствор на 1—2 ч. Затем их тщательно отмывают проточной водопроводной водой и высушивают при комнатной температуре.
Примечание. Окрашивание нигрозином весьма удобно для1 определения очень малых количеств белка.
ЭЛЕКТРОФОРЕЗ В ЦЕЛЛОГЕЛЕ
Быстрое и четкое фракционирование можно получить на желатинизированной ацетат-целлюлозной мембране, имеющей фирменное название “целлогель” (Chemetron, Италия). Полоски целлогеля поставляются в пластмассовой упаковке в растворе метанола. После извлечения из упаковки их необходимо хранить вплоть до использования в 40—50%-ном растворе метанола. Для электрофореза в целлогеле применяют следующие буферные растворы. А. Буферный раствор с pH 9,0 и μ = 0,05 : 5,15 г диэтилбарбитурата натрия и 2,6 г натриевой соли ЭДТА растворяют в 1 л дистиллированной воды; Б. Буферный раствор с pH 8,6 и μ = 0,05 : 10,3 г диэтилбарбитурата натрия и 1,34 г диэтилбарбитуровой кислоты растворяют в 1 л дистиллированной воды.
Методика. Полоски целлогеля на 10 мин погружают в буферный раствор и затем избыток раствора удаляют фильтровальной бумагой. Полоски закрепляют в приборе и на опалесцирующую сторону целлогеля наносят 1,5—2,0 мкл сыворотки (другая сторона мембраны целлогеля не адсорбирует белки). При градиенте напряжения 12—15 В/см электрофорез продолжается 1—1,5 ч, после чего полоски извлекают из камеры и окрашивают амидовым черным.
Для приготовления окрашивающего раствора 0,5 г амидового черного растворяют в смеси 50 мл метанола, 40 мл дистиллированной воды и 10 мл уксусной кислоты. Дифференцирование проводят в растворе, состоящем из 500 мл метанола, 450 мл дистиллированной воды и 50 мл уксусной кислоты. Для количественного определения белковых фракций полоску целлогеля разрезают, элюируют каждую фракцию 80%-ным раствором уксусной кислоты или ацетоном и измеряют экстинкцию элюатов при 620 нм. Прозрачные полоски можно денситометрировать без элюирования. Для того чтобы сделать полоски целлогеля прозрачными, их погружают в раствор следующего состава: 50 мл дистиллированной воды, 37 мл метанола, 5 мл уксусной кислоты, 8 мл диацетонового спирта и 1—2 капли глицерина (вместо диацетонового спирта можно прибавить 5 мл молочной кислоты или 6 мл диацетина).