Аминокислоты, пептиды и белки - Дэвени Т., Гергей Я. 1976
Методы иммунохимического анализа
Анализ белков методами диффузии в геле
Иммуноэлектрофорез
Принцип метода. Иммуноэлектрофорез представляет собой комбинацию электрофоретического разделения белков с двойной диффузией и иммунопреципитацией в геле. Вслед за электрофоретическим разделением белков в агаровом геле навстречу полученным фракциям диффундирует специфическая иммунная сыворотка. Этот метод позволяет характеризовать белки не только по скорости миграции в электрическом поле, но и по антигенным свойствам.
Область применения. С помощью иммуноэлектрофореза производится идентификация компонентов белковых смесей, прежде всего сыворотки крови. Он весьма полезен при диагностике пара- протеинемий и иммунодефицитных диспротеинемий. Этим методом осуществляется контроль чистоты белковых препаратов (определение примесей), а также анализ белков из тканей и жидкостей организма.
Наибольшее распространение получили два варианта этого метода: 1) макрометод Грабара — Вильямса [8, 9] и 2) микрометод в модификации Шейдигера [21], популярность которого объясняется быстротой осуществления и возможностью анализа малых количеств материала.
МАКРОМЕТОД ИММУНОЭЛЕКТРОФОРЕЗА ПО ГРАБАРУ И ВИЛЬЯМСУ [8, 9]
ПРИБОРЫ
1. Источник тока. Необходим источник, дающий ток до 100 мА при стабилизированном напряжении 100—150 В.
2. Прибор для электрофореза. Прибор состоит из двух плексигласовых ванн размером 400 х 40 х 70 мм, в которые вмонтированы платиновые электроды длиной 400 мм и диаметром 0,5—0,8 мм. В торцовой части каждой ванны имеются выходные отверстия, соединенные резиновым шлангом. В ванны электрофоретического прибора заливают по 1 л буферного раствора. Во время электрофореза следует обеспечить постоянный поток буферного раствора через прибор. Для этого выше уровня ванн помещают бутыль емкостью 4—5 л, из которой буферный раствор поступает в ванны, вытекая затем через выходные отверстия в торцовой части.
МЕТОДИКА
1. Приготовление буферного раствора. Иммуноэлектрофорез- белков проводят обычно в буферном растворе Михаэлиса, имеющем pH 8,2 и ионную силу 0,05.
Буферный раствор Михаэлиса готовят следующим образом: 47,6 г диэтилбарбитурата натрия растворяют в 3000 мл дистиллированной воды, имеющей pH 7, и подкисляют сначала примерно до pH 8,4 65 мл 1 н. НС1, а затем осторожно до pH 8,2. После этого добавляют дистиллированную воду до конечного объема 4265 мл. Если необходимо получить буферный раствор меньшей ионной силы, производят дальнейшее разбавление.
2. Приготовление агаровой пластинки. 1,5%-ный агаровый гель готовят на указанном выше буферном растворе (очистка агара и приготовление геля описаны на стр. 127).
Обычно иммуноэлектрофорез проводят в слое агарового геля на стеклянных пластинках размером 180 х 130 мм, которые следует перед опытом тщательно вымыть, обезжирить, высушить и расположить строго горизонтально; любое отклонение пластинки от горизонтального уровня приводит к неравномерности толщины агарового геля. Рекомендуется применять следующий прием; стеклянную кювету соответствующего размера заполняют 5%-ным расплавленным агаром; после его затвердения образуется горизонтальная поверхность, на которую и помещают стеклянную пластинку. Для того чтобы положение пластинки всегда было строго горизонтальным, после затвердения агара кювету не следует сдвигать с места.
На оба края стеклянной пластинки накладывают полоски смоченной буферным раствором фильтровальной бумаги шириной 40 мм так, чтобы они на 30 мм выступали за край стекла.
Затем на поверхность стекла на расстоянии 31 мм одна от другой параллельно кладут стеклянные палочки или трубки диаметром 5 мм, на месте которых после затвердения агара образуются канавки для внесения антисывороток.
Расплавив 250—300 мл агара, его наливают на подготовленную стеклянную пластинку с полосками фильтровальной бумаги таким образом, чтобы образовался слой геля толщиной 3—4 мм. Следует наносить агар аккуратно, избегая появления пузырьков воздуха. После затвердения агара двумя пинцетами удаляют стеклянные палочки и по обе стороны каждой канавки на расстоянии 8 мм от нее вырезают лунки для внесения исследуемых образцов. Лунки размером З x 15 мм вырезают при помощи скальпеля, лезвия или специального инструмента из стекла или металла. Вырезанные столбики агарового геля осторожно извлекают из лунок, поддев снизу или отсасывая их иглой большого диаметра (фиг. 26).
Затем агаровый гель обрезают по контуру стеклянной пластинки и полосок фильтровальной бумаги так, чтобы покрытые гелем полоски можно было отогнуть книзу под прямым углом к плоскости пластинки.
Готовую агаровую пластинку закрепляют в приборе для электрофореза и покрытые гелем фитили фильтровальной бумаги погружают в буферный раствор, заполняющий ванны.
При помощи расплавленного агара восстанавливают целостность геля в местах его случайных повреждений, чтобы обеспечить одинаковую электропроводность всех участков.
3. Внесение исследуемого образца. Раствор, содержащий примерно 15 мг исследуемого белка (например, при исследовании сывороточных белков — 0,2 мл сыворотки крови), подогревают до 40°С и смешивают с 0,8 мл З%-ного расплавленного агара, приготовленного на дистиллированной воде и охлажденного до 40°С. Полученную смесь вносят в лунку для исследуемого образца на агаровой пластинке. Оставшийся свободный объем лунки заполняют 1,5%-ным агаровым гелем в буферном растворе. При заполнении лунки следует избегать образования пузырьков воздуха.
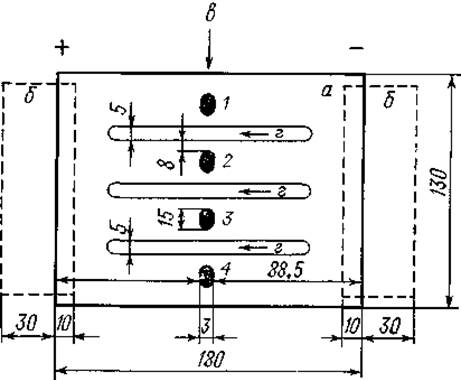
Фиг. 26. Приготовление агаровой пластинки для иммуноэлектрофореза (макрометод).
а — слой агарового геля; б — полоски фильтровальной бумаги; в — лунки для исследуемых образцов (1, 2, 3, 4); г — канавки для иммунной сыворотки. (Размеры даны в мм.)
4. Электрофорез. При напряжении 120 В электрофоретическое разделение белков сыворотки крови продолжается 4—5 ч. Оптимальный градиент напряжения 3—6 В/см. В этих условиях можно проводить электрофорез без специального охлаждения и в то же время не опасаться высыхания геля. При увеличении силы тока происходит падение напряжения, поэтому необходимо несколько раз во время сеанса электрофореза проверять напряжение в цепи.
5. Внесение антител. Во избежание неудачных опытов предварительно следует определить то оптимальное разведение иммунной сыворотки, при котором наблюдается наиболее четкая реакция преципитации с исследуемым антигеном (в данном случае с белками сыворотки крови).
По окончании электрофореза фитили из фильтровальной бумаги удаляют, а канавки в агаровом геле заполняют иммунной сывороткой, соответствующим образом разведенной физиологическим раствором. (Для заполнения канавки требуется около 1 мл сыворотки.)
После этого агаровую пластинку помещают во влажную камеру и оставляют до образования полос преципитации, которые появляются в геле через 2—5 дней.
6. Регистрация результатов иммуноэлектрофореза. Полосы преципитации можно зарегистрировать фотопечатью непосредственно с нативных препаратов (см. стр. 135) либо фотографированием после соответствующего окрашивания (см. стр. 135).
ПРИМЕЧАНИЯ
1. После каждого сеанса электрофореза рекомендуется менять полюса электродов.
2. Буферный раствор Михаэлиса очень удобен для иммуно- электрофоретического анализа белков сыворотки крови. Однако можно использовать и другие буферные растворы. В этих случаях, разумеется, следует готовить агаровый гель на том же буферном растворе, в котором проводится электрофорез.
МИКРОИММУНОЭЛЕКТРОФОРЕЗ ПО ШЕЙДИГЕРУ [21]
Приборы. 1. Источник тока (см. стр. 46).
2. Прибор для элекрофореза. Прибор состоит из двух плексигласовых ванн размером 250 х 100 х 35 мм, разделенных перегородкой на два отсека. В наружный отсек каждой ванны вмонтирован платиновый проволочный электрод диаметром 0,5—0,8 мм. Проводниками тока между отсеками служат полоски фильтровальной бумаги, смоченные в буферном растворе и погруженные в него по обе стороны от перегородки.
Между двумя буферными ваннами располагается камера для закрепления агаровых пластинок, также изготовленная из плексигласа. По ее верхнему краю с двух сторон внутри есть выступ шириной 2 мм, на который укладывают предметные стекла с агаровым гелем. Расстояние между краями выступа составляет 76 мм. Камера для агаровых пластинок закрывается плексигласовой крышкой, которая защищает агар от высыхания во время электрофореза. В каждый отсек ванны наливают по 150 мл буферного раствора, который рекомендуется менять перед каждым опытом.
3. Приспособление для вырезания лунок и канавок в агаровом геле. При постановке микроиммуноэлектрофореза по Шейдигеру лунки для внесения исследуемых образцов и канавку для антисыворотки вырезают в агаровом геле с помощью специального приспособления. На фиг. 27,А представлена схема размещения лунок и канавки. Для вырезания канавки (а) в приспособлении (фиг. 27,Б) на расстоянии 1 мм друг от друга укреплены два стальных лезвия, имеющих размер 5 х 45 х 0,08 мм. Для вырезания лунок (б) на расстоянии 3 мм по обе стороны от внешней поверхности лезвий в приспособлении укреплены два отрезка иглы для подкожных инъекций, также имеющих высоту 5 мм. Эти отрезки игл закреплены не точно по центру штампа, а сдвинуты от него на 5 мм. Предметное стекло, покрытое слоем агарового геля, помещают под штамп приспособления, нажимают закрепленную на пружине рукоятку и, погрузив лезвия с иглами в гель, отмечают контуры канавки и лунок. Отсосав через отрезок иглы соответствующего размера кусочки агарового геля из лунок, в них вносят исследуемые образцы. После этого проводят электрофорез и, только закончив его, удаляют гель из канавки для внесения антисыворотки.

Фиг. 27. А. Схема расположения луиок для внесения исследуемых образцов (б) и канавки, из которой диффундирует иммунная сыворотка (а). Б. Приспособление для вырезания лунок и канавки.
МЕТОДИКА
1. Приготовление буферного раствора. Микроиммуноэлектрофорез обычно проводят в буферном растворе Михаэлиса, имеющем pH 8,2 и ионную силу 0,1 μ.
Основной раствор: 194,2 г уксуснокислого натрия и 294,2 г веронала растворяют в 10 л дистиллированной воды.
При разведении основного раствора дистиллированной водой (8 : 9,6) и подведении 0,1 н. НСІ pH до 8,2 получается буферный раствор с ионной силой 0,15 μ. Чтобы получить буферный раствор с ионной силой 0,1 μ, его следует развести дистиллированной водой в 1,5 раза.
2. Подготовка предметных стекол. Стекла, на которые наносят слой агарового геля, должны быть тщательно вымыты и обезжирены. Их следует мыть серной кислотой, содержащей бихромат калия, затем отмыть от кислоты проточной водопроводной и дистиллированной водой и хранить в этаноле. Перед использованием предметные стекла вытирают насухо, следя за тем, чтобы на поверхности не осталось никаких соринок.
3. Приготовление слоя агарового геля. Сухие предметные стекла помещают на горизонтальную поверхность (см. стр. 138) и с помощью пипетки с достаточно широким выходным отверстием наливают на поверхность каждого стекла 2 мл 1,5%-ного расплавленного агара, приготовленного на буферном растворе (об очистке агара и приготовлении геля см. на стр. 127). Необходимо добиться того, чтобы слой агарового геля был равномерным, покрывал всю поверхность стекла и не содержал пузырьков воздуха. Как только агар затвердеет, пластинки переносят во влажную камеру и хранят в холодильнике. Чаще всего агаровые пластинки готовят за 24 ч до постановки опыта.
Разметку лунок для образцов и канавки для антисыворотки следует делать непосредственно перед электрофорезом, как описано на стр. 141.
4. Внесение исследуемого образца. Раствор исследуемых белков, например сыворотку крови, вносят капиллярной пипеткой в лунку для исследуемых образцов, заполняя ее до края. Для электрофореза достаточно 0,001 мл раствора.
5. Электрофорез. После внесения исследуемых образцов агаровые пластинки помещают в камеру прибора для электрофореза. Контакт агарового геля с буферными ваннами прибора осуществляется с помощью полосок фильтровальной бумаги, смоченных буферным раствором. Бумажные фитили должны примерно на 15 мм покрывать гель на обоих концах агаровой пластинки.
Камеру с агаровыми пластинками закрывают крышкой и включают ток. Если напряжение, измеренное на краях агаровой пластинки, достигает 45 В, то электрофоретическое разделение белков закончится уже через 45—60 мин.
6. Внесение иммунной сыворотки. По окончании электрофореза ранее размеченную канавку освобождают от агарового геля и при помощи капиллярной пипетки или туберкулинового шприца заполняют специфической иммунной сывороткой (рекомендуется заранее определить ее оптимальное разведение). Для заполнения канавки требуется примерно 0,05 мл иммунной сыворотки. Диффузия происходит во влажной камере при комнатной температуре в течение 16—24 ч.
7. Регистрация результатов микроиммуноэлектрофореза. Полосы преципитации можно зарегистрировать фотопечатью прямо с нативного препарата (см. стр. 135) или фотографированием после окрашивания (см. стр. 135).
ПРИМЕЧАНИЯ
1. Хорошо себя зарекомендовал прибор для электрофореза в агаровом геле фирмы Labor Müszeripari Müvek, (Венгрия), тип Labor 59952. В центральной камере этого прибора можно одновременно проводить электрофорез на десяти агаровых пластинках. Прибор продается в комплекте с нивелируемым столиком (который позволяет приготовить равномерный слой агара), кюветами для окрашивания и вкладышами к ним, а также с приспособлением для штампования лунок и канавок в геле и микропипеткой. Прибор не сложен в обращении и с равным успехом может использоваться для электрофореза и иммуноэлектрофореза.
2. При отсутствии специального приспособления для штампования лунок и канавок в агаровом геле можно сделать простой самодельный штамп, укрепив в корковой пробке два лезвия бритвы и пару инъекционных игл (отпилив их острые концы) по размерам, данным на стр. 141.
3. Проще всего спилить острые концы инъекционных игл, вставив мандрен в иглу и обработав конец на вращающемся шлифовальном камне.
4. За процессом электрофоретического разделения сывороточных белков легко следить, окрасив сыворотку крови конго красным. Краситель связывается с альбумином и мигрирует вместе с ним. Следует отметить, что в результате окрашивания скорость миграции альбумина несколько увеличивается.
5. Если концентрация исследуемой смеси белков относительно мала (ниже 3%), рекомендуется увеличить объем лунки для внесения образца и залить в нее большее количество материала. Проще всего лунки большого размера можно сделать с помощью подходящих стеклянных трубок диаметром 2—4 мм.
6. Делая с помощью штампа на одной агаровой пластинке две лунки для внесения образца, мы получаем возможность одновременно анализировать два разных белка или две разных белковых смеси и сопоставлять их иммуноэлектрофоретические характеристики. Это имеет особое значение при анализе белков сыворотки крови, при котором в одну из лунок помещают исследуемую сыворотку, а в другую — нормальную сыворотку. В этих условиях легче оценить иммуноэлектрофоретические особенности исследуемой сыворотки. Такой подход весьма целесообразен в том случае, когда необходимо определить, содержит ли исследуемая смесь определенный белок. (Например, содержит ли исследуемый тканевой экстракт белки сыворотки крови или какие компоненты сыворотки содержатся в исследуемом препарате белков, выделенном из мочи.)
7. Иммуноэлектрофоретическая характеристика белков сыворотки. Иммуноэлектрофорез применяется для анализа белков сыворотки крови чаще других методов. Его популярность объясняется тем, что, исследуя очень небольшое количество сыворотки, можно охарактеризовать 15—20 белковых фракций вместо 5, доступных для анализа при зональном электрофорезе. Число выявляемых при иммуноэлектрофорезе отдельных белковых фракций зависит от качества используемой антисыворотки.

Фиг. 28. Иммуноэлектрофорез сыворотки крови человека.
Источником антител служила кроличья антисыворотка к сывороточным белкам человека производства фирмы Behringwerke AG (ФРГ).
В верхней части фиг. 28 представлена иммуноэлектрофореграмма сыворотки крови человека. С помощью схемы, приведенной ниже, можно ориентироваться в иммуноэлектрофореграммах любой сыворотки человека; на схеме показано относительное расположение белковых фракций, входящих в ее состав.
8. Идентификация отдельных белковых фракций.
а) В одну из лунок вносят в качестве контроля раствор белка известного состава и подвергают его электрофорезу. Если, например, требуется определить присутствие в исследуемой белковой смеси альбумина, то в качестве контроля используют раствор чистого альбумина.
б) Для идентификации используются специфические иммунные сыворотки. Например, присутствие в исследуемой белковой смеси альбумина можно определить также с помощью специфической антиальбуминовой иммунной сыворотки. Если смесь белков содержит альбумин, то на иммуноэлектрофореграмме должна появиться одна полоса преципитации, соответствующая этому белку.
в) Идентификацию фракций можно проводить также с помощью специфического окрашивания. Например, если требуется определить в смеси белков липопротеиды, полученную иммуноэлектрофореграмму окрашивают красителями, специфически выявляющими липиды. В этом случае должны окраситься только те полосы преципитации, которые содержат липопротеиды.
9. Методы специфического окрашивания полос преципитации. Ранее описанные методы окрашивания белков и липопротеидов вполне пригодны для окрашивания полос преципитации при иммуноэлектрофорезе. Ниже приведено несколько методов специфического окрашивания, которые позволяют идентифицировать определенные белковые фракции.
а) Окрашивание гликопротеидов [22]. Растворы: Е 1%-ная йодная кислота в 50%-ном этаноле; II. Смесь 50 мл 0,01 М n-фенилендиамина, 50 мл 0,01 M a-нафтола и 10 мл 10%-ной перекиси водорода.
Методика. Высушенную агаровую пластинку на 15 мин погружают в раствор I, затем 15 мин отмывают дистиллированной водой и окрашивают раствором II до появления легкого фиолетового оттенка. После этого препарат 10 мин промывают проточной водопроводной водой и высушивают при 37°С.
б) Окрашивание церулоплазмина. Растворы: I. 200 мг ализарина голубого растворяют в 100 мл уксусной кислоты при 55°С и разбавляют 70%-ной уксусной кислотой в 10 раз; II. 70%-ная уксусная кислота.
Методика. Высушенную агаровую пластинку 20 мин окрашивают в растворе I, а затем 30 мин отмывают в растворе II.
е) Окрашивание гаптоглобина. 2,0 г бензидина1 растворяют в 20 мл уксусной кислоты при нагревании. После охлаждения конечный объем раствора доводят дистиллированной водой до 100 мл, добавляют 0,5—1,0 г активированного угля, встряхивают, оставляют на 15 мин и затем фильтруют в склянку из темного стекла. Непосредственно перед окрашиванием к раствору бензидина добавляют несколько капель перекиси водорода.
После 15 мин окрашивания агаровую пластинку отмывают дистиллированной водой.
10. Форма полос преципитации позволяет судить о гомогенности или гетерогенности исследуемых белков. Гомогенные белки дают симметричные полосы преципитации правильной формы (например, среди сывороточных белков такую полосу преципитации дает альбумин). Гетерогенная популяция молекул обычно дает вытянутую асимметричную полосу преципитации. Это характерно для иммуноглобулинов нормальной сыворотки человека (IgG, IgM, IgA).
Иммуноглобулины разных классов имеют много общих антигенных детерминант, но различаются по электрофоретической подвижности, поэтому они образуют при иммуноэлектрофорезе вытянутую асимметричную полосу преципитации. Особое значение этому явлению придается при диагностике так называемых моноклональных иммуноглобулинопатий. При этих заболеваниях (например, множественном миеломатозе или макроглобулинемии Вальденштрёма) клон злокачественно пролиферирующих плазматических клеток обычно продуцирует гомогенный моноклональный иммуноглобулин. Патологическое увеличение популяции молекул этого иммуноглобулина приводит к тому, что при иммуноэлектрофорезе можно наблюдать характерную симметричную полосу преципитации. На фиг. 29, где представлены иммуноэлектрофореграммы сыворотки при миеломах IgA- и IgG-типа, можно заметить также, что при значительном увеличении концентрации отдельных белков при моноклональных иммуноглобулинопатиях происходит растворение полос преципитации в избытке антигена. Это явление может стать причиной неверного толкования иммуноэлектрофореграмм, поскольку растворение преципитата воспринимается как отсутствие данной белковой фракции, хотя на самом деле она присутствует в большом избытке. В этих случаях следует устранять избыток антигена 5—10-кратным разбавлением исследуемой сыворотки с высокой концентрацией белка. После этого на иммуноэлектрофореграмме должна появиться характерная для моноклональных иммуноглобулинопатий симметричная полоса преципитации, отличающаяся от полосы преципитации нормальных иммуноглобулинов (фиг. 29).
1 Бензидин канцерогенен, поэтому работа с ним требует соответствующих мер предосторожности.
11. В отдельных случаях, особенно при иммуноэлектрофоретическом анализе низкомолекулярных белков, удобно применять метод внесения антисыворотки, предложенный Бакхаузом в 1967 г. [2]. После нанесения слоя агарового геля на стеклянную пластинку его продольно разрезают на две равные половины и одну из них удаляют. Затем примерно в 5 мм от линии разреза в геле делают лунку для внесения образца, в которую наливают исследуемый материал, и обычным способом подвергают его электрофорезу. По окончании электрофореза смешивают расплавленный агар со специфической иммунной сывороткой и заливают им свободную половину стекла. Образование преципитатов происходит частично в оставшейся половине агарового геля и частично в геле, нанесенном на стекло после электрофореза. При обычной постановке иммуноэлектрофореза низкомолекулярные белки (например, белки Бенс-Джонса) благодаря быстрой диффузии могут мигрировать на значительное расстояние от лунки и, если они попадут в канавку для иммунной сыворотки, полосы преципитации не образуется. Метод Бакхауза позволяет избежать затруднений такого рода, так как в этом случае канавка для иммунной сыворотки просто отсутствует, а полосы преципитации низкомолекулярных белков появляются в слое агарового геля, нанесенном после электрофореза.
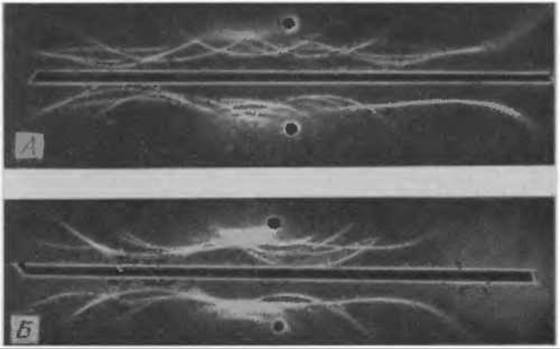
Фиг. 29. Иммуноэлектрофорез сыворотки крови при моноклональных иммуноглобулинопатиях.
А. IgG-миелома; Б. IgA-миелома. В верхних лунках — сыворотка больного; в иижних — нормальная сыворотка человека.
12. Метод иммуноэлектрофореза позволяет сравнивать между собой не только смеси белков (антигены) с помощью данной иммунной сыворотки, но также и иммунные сыворотки с помощью данного антигена. Для такого исследования в пластинке агарового геля вырезают две параллельные канавки, а между ними на расстоянии 3 мм от края каждой делают лунку для образца. В нее вносят раствор определенного белка и, проведя электрофорез, заполняют канавки сравниваемыми иммунными сыворотками. Полосы преципитации, которые появляются с обеих сторон от нанесенного образца, позволяют сопоставлять исследуемые иммунные сыворотки.
13. Приготовление иммунной сыворотки требуемого качества нередко встречает серьезные затруднения. Животные-продуценты существенно различаются по способности синтезировать антитела, причем наряду с межвидовыми имеются значительные индивидуальные различия в иммунореактивности животных-продуцентов в пределах одного вида. Поэтому рекомендуется одним антигеном одновременно иммунизировать несколько животных; тем самым повышается вероятность получения антисыворотки хорошего качества, дающей необходимое число полос преципитации.
14. Описанные выше методы иммуноэлектрофореза применимы только для качественного анализа.
15. Разрешающая способность иммуноэлектрофореза намного превышает возможности зонального электрофореза, но не следует забывать, что, подобно другим методам иммунодиффузии, иммуноэлектрофорез выявляет минимальное число реагирующих систем антиген—антитело.
16. Если электроэндоосмос в агаровом геле при электрофорезе является серьезной помехой иммуноэлектрофоретического анализа, рекомендуется заменить агаровый гель гелем агарозы.
17. Радиоиммуноэлектрофорез. Если антиген или антитело пометить радиоактивным изотопом, то с помощью иммуноэлектрофореза можно анализировать чрезвычайно малые количества материала. Известно, что антигенные свойства IgG не меняются, если молекула IgG как антитело входит в иммунный комплекс. Если мы располагаем соответствующей иммунной сывороткой анти-IgG, меченной радиоактивным изотопом, то с ее помощью мы можем выявлять IgG в иммунных комплексах (например, в преципитатах). Радиоиммуноэлектрофорез состоит из следующих стадий:
а) Сначала исследуемый антиген (например, сывороточный альбумин человека) обычным путем подвергают электрофорезу. Затем заполняют канавку для антисыворотки соответствующей иммунной сывороткой (например, кроличьей антисывороткой к сывороточному альбумину человека) и оставляют для диффузии и образования полос преципитации.
б) Как только образуются полосы преципитации, канавку для антисыворотки заполняют меченной 131I антисывороткой к y-глобулину кролика (например, полученной от морской свинки) и вновь оставляют для диффузии.
в) Меченная изотопом иммунная сыворотка реагирует с кроличьим y-глобулином, входящим в состав полос преципитации (иммунных комплексов). Преципитаты, содержащие изотоп, можно затем выявить с помощью радиоавтографии.
Радиоиммуноэлектрофорез можно осуществить также и с помощью антигенов, меченных радиоактивными изотопами. Методика постановки подобна только что описанной, но после иммуноэлектрофореза в канавку для антисыворотки заливают меченный изотопом антиген (в приведенном выше примере — сывороточный 131I-альбумин человека) и оставляют для диффузии.