Аминокислоты, пептиды и белки - Дэвени Т., Гергей Я. 1976
Некоторые методологические вопросы аналитического исследования белков
Изучение нативных белков
Ионообменная хроматография белков
Ионообменные смолы имеют ограниченное применение в хроматографическом анализе белков. При взаимодействии со смолами высокомолекулярные лабильные белки легко подвергаются денатурации и необратимо связываются сними. Более того, емкость смол по отношению к белкам сравнительно низка, а чистота разделенных фракций не вполне удовлетворительна. Поэтому ионообменные смолы используются в белковой химии в основном для очистки глобулярных белков, имеющих относительно низкий молекулярный вес.
В последние годы вместо ионообменных смол при работе с белками применяют производные углеводов, в которые соответствующими методами введены ионизированные группы. К таким производным углеводов относятся ионообменные целлюлозы и ионообменные полимеры декстрана (сефадекс). По сравнению с ионообменными смолами эти ионообменники имеют определенные преимущества. Их гидрофильный матрикс очень хорошо связывает воду; в результате они весьма интенсивно набухают в водной среде, что обеспечивает лучшие условия проницаемости для крупных белковых молекул по сравнению со смолами, имеющими гидрофобные сшивки. Новые ионообменники обладают более высокой емкостью по отношению к белкам и не вызывают их денатурации. Сорбированные на этих ионообменниках белки обычно элюируются в условиях, при которых они стабильны.
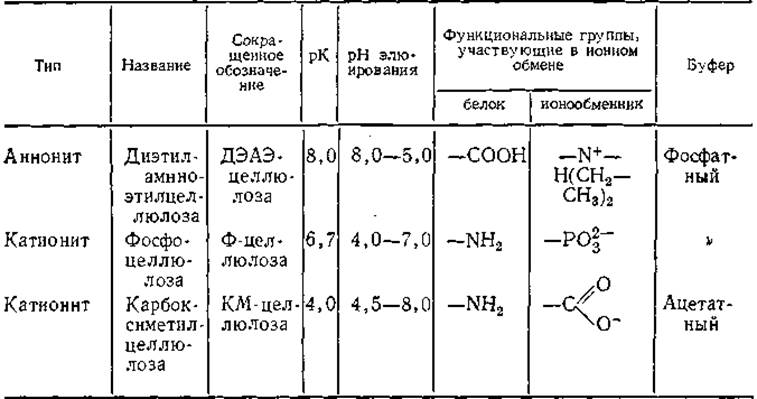
В табл. 1 приведены важнейшие свойства наиболее распространенных ионообменников.
Таблица 1 Наиболее употребительные ионообменные целлюлозы
У большей части белков в процессе хроматографии сразу происходит изменение величины Rf от 0 до 1. Это вызвано тем, что белки либо прочно сорбируются на ионообменнике, либо выходят с элюирующим буферным раствором, поскольку происходит одновременная взаимная нейтрализация многочисленных реакций взаимодействия между белком и ионообменником при данных pH и ионной силе раствора. Поэтому важно тщательно подбирать буферный раствор для ионообменной хроматографии белка. Ионообменную колонку обычно загружают при низкой ионной силе раствора. Для катионообменника оптимальная величина pH равна 4—5, для анионообменника 7—8. Элюирование с колонки катионообменника происходит при увеличении pH буферного раствора, а с колонки анионообменника — при уменьшении pH. В том и другом случае с изменением pH можно увеличивать ионную силу. Изменение pH и ионной силы элюирующего буферного раствора можно производить поэтапно (ступенчатое элюирование) или непрерывно (градиентное элюирование).
Следует отметить, что градиентное элюирование имеет определенные преимущества по сравнению со ступенчатым. При нем изменение среды происходит постепенно без резких скачков, которые во время ступенчатого элюирования могут стать причиной артефактов. Например, если слишком рано ввести новый буферный раствор, медленно мигрирующая часть белков из предыдущей ступени элюирования выйдет из колонки, имитируя новый пик.
Устройство приборов для хроматографии и осуществление самого эксперимента сравнительно просты. Выбрав подходящую систему ионного обмена и проведя рекомендованную обработку (регенерацию) ионообменника, при идентичных условиях элюирования (скорость потока, температура и т. д.) можно получать хорошо воспроизводимые хроматограммы. Благодаря этому фракционирование белков с помощью ионообменной хроматографии имеет широкое распространение.
Как и в предыдущих разделах, мы попытаемся кратко рассмотреть применение ионообменной хроматографии на примере изучения белков сыворотки. До сих пор наиболее популярным методом разделения сывороточных белков является хроматография на колонке анионообменной ДЭАЭ-целлюлозы по методу Собера и Петерсона [18]. Предложено несколько модификаций этого метода. Фракции сыворотки элюируются с колонки различными способами градиентного элюирования и выходят обычно в следующем порядке: IgG (как правило, имеет несколько пиков), ß-, а-глобулины и затем альбумин. Этот метод особенно эффективен для приготовления препаратов IgG высокой иммунохимической чистоты из нативной сыворотки. Его можно комбинировать с другими способами очистки, например с осаждением риванолом, Na2SО4 и т. п. Подобным образом в качестве одного из этапов препаративного выделения анионообменная хроматография может применяться для очистки других белков сыворотки. При изучении структуры белка ее можно использовать для выделения и очистки полипептидов после расщепления белка ферментами или какими-либо другими веществами.
Для решения тех же задач и в тех же областях исследования можно применять катионообменную хроматографию, в которой чаще всего используют фосфоцеллюлозу, карбоксиметилцеллюлозу и кар боксиметил-сефадекс.