Аминокислоты, пептиды и белки - Дэвени Т., Гергей Я. 1976
Хроматография белков
Хроматография белков на колонке с ДЭАЭ-целлюлозой
Хроматография белков сыворотки на колонке в ДЭАЭ-целлюлозой
а) Подготовка ДЭАЭ-целлюлозы. Необходимое количество ДЭАЭ-целлюлозы сначала с помощью декантации трижды отмывают дистиллированной водой, а затем последовательно следующими растворами: 0,5 М NaOH, дистиллированной водой, 0,3 М NaH2PО4, дистиллированной водой, 0,5 М NaOH, дистиллированной водой и 0,005 М Na2HPО4.
Отмывание ионообменника дистиллированной водой всегда проводят до тех пор, пока pH декантируемой воды не станет равным pH добавляемой. В последнем цикле отмывания ДЭАЭ-целлюлозу уравновешивают стартовым буферным раствором.
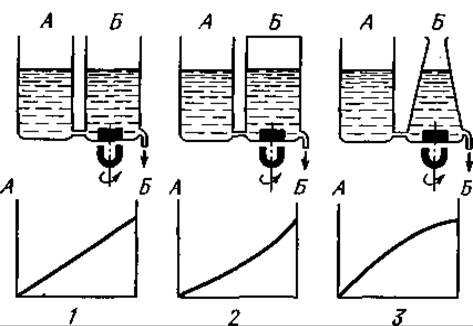
Фиг. 41. Градиентное элюирование при ионообменной хроматографии. Буферный раствор, заполняющий резервуар А, имеет большую ионную силу, чем раствор, находящийся в смесителе Б. Градиенты концентрации: 1 — линейный; 2 — “вогнутый”; 3 — “выпуклый”.
б) Заполнение колонки. Заполнение колонки и уплотнение ионообменника производят с помощью сжатого воздуха. Ионообменник суспендируют в стартовом буферном растворе, перемешивают до получения гомогенной суспензии и, заполняя колонку размером 1х60 см, оставляют для оседания. Затем целлюлозу уплотняют сжатым воздухом под давлением 0,5 атм. После этого проверяют полноту уравновешивания, т. е. определяют, равен ли pH элюата pH стартового буферного раствора. Если равенства нет, через колонку ионообменника пропускают дополнительно стартовый буферный раствор до тех пор, пока колонка не уравновесится.
в) Подготовка градиентного элюирования. Схематическое изображение используемых сосудов, а также типы градиентов представлены на фиг. 41. Объем смесителя, которым может быть любой круглый сосуд, равен 500 мл, объем резервуара для буферного раствора — 1000 мл. Резервуар ставят на 7,5 см выше смесителя. Смеситель заполняют 0,01 М фосфатным буферным раствором pH 8,4, в резервуар заливают 0,3 М буферный раствор pH 4,2. Стартовый 0,005 М фосфатный буферный раствор pH 8,4 подают на колонку из отдельного сосуда.
г) Нанесение сыворотки. 2 мл свежей или размороженной перед опытом сыворотки в течение суток диализуют против стартового буферного раствора. Буферный раствор над ионообменникрм в колонке осторожно удаляют и пипеткой наносят диализованную сыворотку. После ее нанесения остатки препарата трижды смывают отдельными порциями буферного раствора по 2 мл.
д) Хроматография. Сначала хроматографию ведут в стартовом буферном растворе со скоростью протекания 50 мл/ч до тех пор, пока не выйдет первый пик. Затем, не меняя этой скорости, начинают градиентное элюирование. Собирают фракции элюата по 3—5 мл (всего около 500 мл) и определяют содержание белка в полученных фракциях либо непрерывной спектрофотометрией, например с помощью “Увикорда” фирмы LKB, либо спектрофотометрией каждой фракции при 280 нм.
ПРИМЕЧАНИЯ
1. Хроматографию сыворотки можно проводить при комнатной температуре, однако все же лучше колонку охлаждать.
2. По нашим данным, емкость различных препаратов ДЭАЭ-целлюлозы может вообще существенно различаться, а также изменяться после регенерации. Поэтому в каждом случае приходится применять колонки разных размеров и наносить разное количество белка. В связи с этим рекомендуется в предварительном опыте с данным препаратом ионообменника определить наиболее подходящие условия хроматографии.
3. Регенерируют ДЭАЭ-целлюлозу так же, как и при подготовке ее к фракционированию сыворотки (см. стр. 209).
4. Проще всего идентифицировать белковые компоненты сыворотки, содержащиеся в разных фрациях элюата, с помощью иммуноэлектрофореза. В вышедшем со стартовым буферным раствором первом пике обычно содержится значительная часть сывороточного IgG; за ним выходят остальные фракции у-глобулина, ß- и а-глобулины, и последним элюируется альбумин.
5. Если градиентное элюирование проводить так, как это описал Фехий, то в смеситель заливают 0,1 М фосфатный буферный раствор pH 8,0, а в резервуар — 0,3 М фосфатный буферный раствор pH 8,0.
6. Непрерывную подачу буферного раствора с постоянной скоростью лучше всего можно осуществить с помощью подходящих насосов. Хорошо себя зарекомендовали используемые для этой цели насосы фирмы LKB: “Минифлоу”, “Перистальтический” и “Перпекс”.
7. Концентрирование белковых фракций с помощью диализа под давлением. Для этой цели используют трубки из диализной мембраны диаметром 8 мм (трубка “Вискинг” фирмы Scientific Instrument Centre Ltd). Трубку соответствующей длины смачивают дистиллированной водой, и один конец завязывают двойным узлом. Чтобы проверить герметичность нижнего узла, трубку погружают в воду и надувают воздухом. Верхний конец диализной трубки пропускают через отверстие в резиновой пробке и надевают на конец воронки соответствующих размеров, затем воронку с надетой диализной трубкой вставляют в отверстие резиновой пробки. Концентрируемый раствор белка через воронку заливают в диализную трубку, легким нажатием изгоняют пузырьки воздуха и помещают заполненную трубку в вакуумную колбу Бунзена подходящих размеров так, чтобы пробка, через которую проходит конец воронки, плотно входила в горло колбы. Герметичность контакта резины со стеклом можно проверить, нанеся несколько капель воды по краю пробки.
Вакуумную колбу соединяют с водоструйным насосом и создают разрежение. Под вакуумом происходит фильтрация растворителя через диализную мембрану внутрь колбы и начинается концентрирование раствора белка. На выходной шланг вакуумной колбы накладывают зажим, чтобы сохранить разрежение, и всю систему помещают в холодильник или в холодную комнату. Если объем концентрируемого раствора больше объема воронки, то по мере концентрирования раствор белка подливают. Когда объем раствора уменьшится до нужной степени, вакуумную колбу с диализной трубкой извлекают из холодильника, открывают зажим и вынимают трубку из колбы. Затем надрезают мембрану и переливают сконцентрированный белковый раствор в соответствующий сосуд, смыв туда же небольшим количеством буферного раствора остатки со стенок диализной трубки.
8. Концентрирование растворов с помощью лифогеля. Лифогель, изготовляемый фирмой Gelman Instrument Company (США), представляет собой полиакриламидный гель, с помощью которого можно концентрировать растворы высокомолекулярных веществ. Каждый грамм лифогеля способен связать до 5 г воды, причем равновесие устанавливается в течение 5 ч. Концентрируемый раствор помещают в сосуд соответствующего размера и прибавляют столько лифогеля, сколько требуется для того, чтобы была достигнута необходимая концентрация (при этом нужно иметь в виду, что 1 г лифогеля, набухая в водной среде, занимает объем 25 мл). Когда концентрирование закончится, набухший лифогель легко удаляют фильтрованием. После высушивания при 65°С его можно использовать вновь1.
1 Одним из наиболее быстрых и удобных методов концентрирования белковых растворов является мембранная фильтрация (см. стр. 27). — Прим. ред.