Химия белка - Часть 2 - Избранные разделы частной химии белка - Ашмарин И. П 1968
Белки плазмы
Роль белков плазмы в реакциях иммунитета
Одно из центральных мест в защите человека и животных от действия бактерий, вирусов, токсинов и чужеродных белков принадлежит особой группе протеинов плазмы — иммуноглобулинам, или антителам. Различные типы иммуноглобулинов могут отличаться по своему составу и физико-химическим свойствам, но все они обладают общей способностью избирательно взаимодействовать только с теми соединениями или микроорганизмами (антигенами), появление которых стимулирует выработку данного вида антител.
Антигены по-разному взаимодействуют с антителами. Микробные или иные чужеродные клетки, соединяясь с антителами, либо разрушаются ими (реакция лизиса), либо «склеиваются» в крупные агрегаты, захватываемые клетками ретикуло-эндотелиальной системы (реакция агглютинации). Растворимые антигены (белки, токсины), взаимодействуя с антителами, теряют свою активность в результате блокировки биологически активных центров (реакция нейтрализации) или образования нерастворимого комплекса антиген—антитело, выводимого из кровеносного русла клетками ретикуло-эндотелиальной системы (реакция преципитации).
Таблица 6 Основные характеристики иммуноглобулинов
|
Тип иммуноглобулинов |
Константа седиментации S20, W, ед. Сведберга |
||||||
|
Новое обозначение |
Старое обозначение |
Содержание в сыворотке крови, % |
Молекулярный вес М∙105 |
Электрофо ретическая подвижность |
Содержаниe % углеводов, |
Антигены, взаимодействующие с данным типом иммуноглобулина |
|
|
IgG, y2G |
y, y2, 7Sy |
1,33±0,27 |
1,6 |
6,6 |
(Медленные y-глобулины |
2,5 |
Стрептококки, стафилококки, пневмококки, дифтерийная палочка, вирус инфекционного гепатита и др. |
|
IgA, y1A |
yA, β2A |
0,18±0,06 |
1,6 |
7,0-11 |
Быстрые у-глобулины |
10,7 |
Гриппозный вирус А2, вирус полиомиелита |
|
IgM, y1M |
yM, ß2M |
0,10±0,02 |
10 |
19 |
Быстрые у-глобулины |
10,0 |
Тифоидные бактерии типа Н и O, изоатглютининогены |
Физическими и химическими методами иммуноглобулины можно разделить на три основные группы, отличающиеся по электрофоретической подвижности, молекулярному весу и составу. Основные данные, характеризующие каждую из этих групп, приведены в табл. 6.
Как видно из таблицы, основную массу антител составляют у2G-глобулины — белки с электрофоретической подвижностью y2-глобулина, молекулярным весом 160 000 и константой осаждения (седиментации) около 7 единиц Сведберга. Ко второй группе иммунологически активных белков относятся у1А-глобу лины, имеющие такой же или несколько более высокий молекулярный вес, но обладающие большей электрофоретической подвижностью и содержащие до 10—11% углеводов. Антитела с высоким молекулярным весом (около 800 000—1 000 000) и константой седиментации 19S—у1М-глобулины — составляют третью группу иммуноглобулинов.
Все эти протеины синтезируются особыми, так называемыми иммунокомпетентными клетками лимфоретикулярной системы, причем каждая из таких клеток синтезирует, как правило, антитела к какому-либо одному антигену.
Процесс антителообразования состоит из нескольких стадий. Первая из них — индуктивная, протекает со сравнительно высокой скоростью и заканчивается образованием высокомолекулярных у1М-глобулинов. В ряде случаев антителообразовательный процесс обрывается на этой стадии, но обычно вслед за первой стадией идет вторая — продуктивная, когда синтезируется основная масса y2G- и у1А-иммуноглобулинов. Следует отметить, что имеются значительные различия в скоростях биосинтеза и распада высоко- и низкомолекулярных гамма-глобулинов. Так, например, у человека период полуобновления у1М-глобулинов составляет 8 дней, а для y2G- и у1А-иммуноглобулинов он равен примерно 20 дням.
Поскольку различные иммуноглобулины обладают разной серологической специфичностью, т. е. способны избирательно взаимодействовать только с определенными антигенами, то, естественно, перед исследователями встал вопрос: какими структурнохимическими особенностями обусловлена удивительная избирательность иммуноглобулинов? Исследования химического состава и физико-химических свойств антител не дали на него ответа, ибо аминокислотный и углеводный состав, а также основные физико-химические характеристики (константа седиментации, электрофоретическая подвижность и др.) антител, имеющих разную специфичность, во многих случаях совершенно идентичны.
Значительные успехи в изучении этой проблемы были достигнуты только в последние годы благодаря применению специальных методов ферментативного гидролиза и восстановительного ацетилирования иммуноглобулинов. Оба метода позволяют разделять сложную глобулиновую молекулу на более простые фрагменты и изучить структуру каждого из них. Было установлено, что в реакции антиген—антитело принимает участие не вся молекула иммуноглобулина, а только ее небольшой участок, так называемый комбинационный, или реактивный, центр, в состав которого входит только около 1% аминокислот, содержащихся в молекуле. Используя вышеуказанные методы, Портер и Эдельман показали, что молекула у2G-глобулина состоит из четырех полипептидных цепей: двух легких, с молекулярным весом около 20 000 (L-цепи), и двух тяжелых, имеющих молекулярный вес 60 000 (Н-цепи) (рис. 13). Легкие цепи различных антител весьма близки по своему строению, в то время как Il-цепи заметно отличаются по содержанию аминокислот и углеводов.
Структурными особенностями тяжелых цепей определяется избирательность взаимодействия антител с соответствующими антигенами; их принадлежность к тому или иному классу иммуноглобулинов (y2G, у1А или у1М), видовые и типовые (индивидуальные) различия гамма-глобулинов, а также способность антител проникать через плаценту, обеспечивающая иммунную защиту плода в период эмбрионального развития.
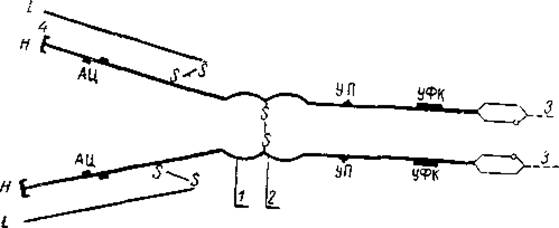
Риc. 13. Схема молекулы гамма-глобулина (Портер, 1962).
АЦ — активный центр; УЦ — участок молекулы, обусловливающий транс- плацентарную проницаемость; УФК — участок, фиксирующий комплемент.
1 — связь, расщепляемая панаином; 2 — связь, расщепляемая пепсином; 3 — C-концевой, участок молекул с углеводными группами; 4 — N-концевой участок молекулы.
Метод восстановительного ацетилирования оказался весьма эффективным и при исследовании строения Y1M-макроглобулинов. При восстановлении дисульфидных связей молекула макроглобулина распадается на 5—6 субъединиц, каждая из которых по молекулярному весу, иммунологической специфичности и электрофоретической подвижности тождественна молекуле у2G (7Sy)-глобулина. Таким образом, иммунные макроглобулины могут рассматриваться как своеобразная «полимерная форма» 7Sу-глобулинов.
Структурные различия y2G- и у1М-глобулинов обусловлены тем, что каждый из них синтезируется разными типами клеток. Иммуноглобулины, имеющие высокий молекулярный вес, продуцируются лимфоидными клетками, а у2G-глобулины образуются в так называемых плазматических клетках.
Изучение структуры, функций и особенностей биосинтеза иммуноглобулинов имеет не только теоретическое значение, но представляет большой интерес для физиологии и медицины. Выявление у-глобулиновой природы антител и разработка производственных методов препаративного выделения гамма-глобулинов открыли возможность их широкого применения для лечения и профилактики ряда инфекционных заболеваний — кори, коклюша, вирусного гепатита и многих других.
Торможение синтеза у-глобулинов ведет к резкому понижению иммунологической сопротивляемости организма и возникновению бактериальных и вирусных инфекций. Не менее тяжелые последствия вызывает неконтролируемый синтез иммунологически инертных у-глобулинов, лишенных способности специфически взаимодействовать с антигенами. Такие белки — парапротеины — появляются при ревматизме, миеломной болезни и макроглобулинемии Вальденштрема, когда содержание y2G- или у1M-глобулинов в 5—7 раз превышает норму и, несмотря на это, иммунная сопротивляемость организма резко снижена. Наконец, в последние годы выявлены заболевания, сопровождающиеся нарушением координации биосинтеза легких и тяжелых цепей иммуноглобулинов В кровеносном русле может возникать избыток одной из полипептидных цепей, и развиваются состояния, известные под названиями: болезнь Франклина (болезнь тяжелой цепи) и протеинурия Бенс-Джонса (болезнь легкой цепи).
Наряду с антителами важную роль в защите организма от бактерий и вирусов играют содержащиеся в плазме вещества белковой природы — комплемент и пропердин.
Комплемент является весьма важным компонентом многих иммунологических реакций. Особую роль он играет в процессах лизиса бактериальных клеток и сенсибилизированных эритроцитов (эритроцитов, на поверхности которых адсорбирован тот или иной антиген). Используя методы диализа и ионообменной хроматографии, комплемент можно разделить на четыре компонента. Общее содержание комплемента в плазме крови человека составляет 20—50 мг%, из них около 3/4 приходится па долю так называемого первого компонента — С'1, его молекулярный вес 100 000, а изоэлектрическая точка — 5,6. Этот компонент участвует в начальной стадии процесса лизиса клеток. Комплемент термолабилен и полностью инактивируется при нагревании до 56° С в течение 30 мин. Химическая природа и свойства его изучены слабо. По-видимому, часть компонентов комплемента С'2 и С'4 относятся к мукопротеидам. При электрофорезе компоненты комплемента выявляются во фракции ß-глобулинов.
В 1954 г. Пиллемер, изучая свойства комплемента, обнаружил в крови человека новый белок, получивший название пропердин (от латинского perdere — разрушать) Это высокомолекулярный протеин с молекулярным весом около 1 000 000, изоэлектрической точкой 5,5—5,8 и электрофоретической подвижностью у-глобулина. Содержание пропердина в плазме крови человека составляет примерно 2 мг%, но его уровень может заметно изменяться при некоторых заболеваниях, например при лучевой болезни.
Пропердин в присутствии ионов магния и всех четырех компонентов комплемента разрушает многие бактерии, участвует в реакциях нейтрализации вирусов и обладает способностью гемолизировать эритроциты. Особенности взаимодействия пропердина с микробами или вирусами позволяют сделать вывод о том, что пропердин не является антителом и его роль заключается в том, чтобы защищать организм от тех патогенных факторов, против которых нет специфических антител.
Пронердин термолабилен и теряет значительную часть своей активности уже при 50° С, а при 56° С полностью инактивируется за 30 мин.
Одной из особенностей этого протеина является его способность образовывать нерастворимые комплексы с полисахаридом, выделяемым из дрожжевых клеток, - эимозаном. На этом свойстве пропердина были основаны первые методы его препаративного получения и анализа. Изучение пропердина с помощью электрофореза и ультрацентрифугирования, а также использование методов восстановительного ацетилирования показали, что молекула пропердина по некоторым свойствам сходна с макроглобулином и состоит из нескольких субъединиц, имеющих константу седиментации, равную 6, и соединенных между собой дисульфидными мостиками. Вероятно, пропердин, как и высокомолекулярные иммунные глобулины, вырабатывается клетками лимфоидной ткани.