Химия белка - Часть 2 - Избранные разделы частной химии белка - Ашмарин И. П 1968
Гистоны
Первичная и вторичная структуры гистонов
Несмотря на гетерогенность гистонов, их основные фракции хорошо изучены по аминокислотному составу, N- и С-концевым группам и степени ацетилирования (табл. 10, 11) Для всех характерно высокое содержание основных аминокислот лизина и аргинина (от 22 до 29 мол. %), сравнительно высокое содержание аланина и пролива, полное отсутствие триптофана и почти полное отсутствие тирозина, фенилаланина и серусодержащих (цистеин, цистин) аминокислот. Исследования последних лет позволили обнаружить лишь незначительные количества цистеина и цистина (около 1 мол. %) во фракции аргининбогатых гистонов.
Таблица 10 Аминокислотный состав основных фракций гистонов тимуса теленка (в мол. %) (Johns, 1964, Phillips, 1967; Phillips a. Johns, 1965)
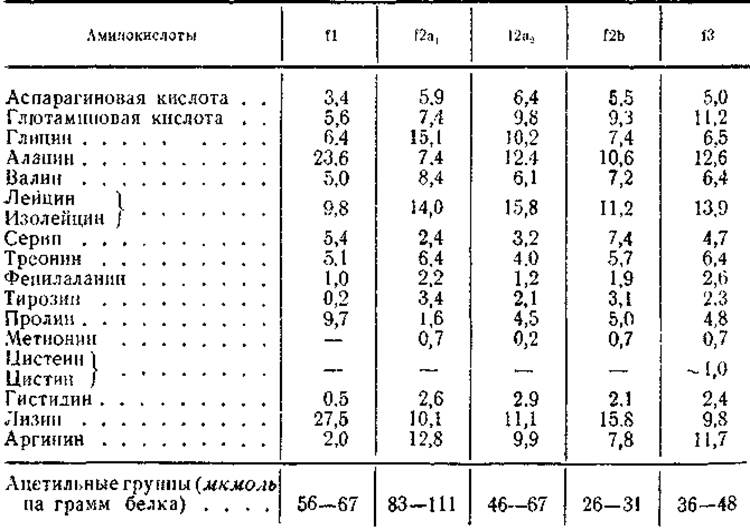
Таблица 11 Основные характеристики отдельных фракций гистонов (Butler, 1966)
|
Основные характеристики |
f1 |
f2a1 |
f2a2 |
f2b |
f3 |
|
Отношение лизин/аргинин |
10-13 |
<1 |
1,1-1,20 |
Около 2 |
<1 |
|
Основные N-концевые группы |
Ацетил |
Ацетил |
Ацетил |
Пролин |
Аланин |
|
Основные С-концевые группы |
Лизин |
Глицин |
Лизин |
Лизин |
Аланин |
|
Высокое содержание аминокислот |
Пролина и аланина |
Глицина |
— |
Серина |
Глютаминовой кислоты |
|
Молекулярный вес: |
|||||
|
1) седиментация, |
9 000-15 000 |
— |
25 000—37 000 (pH 1-7) |
Около 55 000 |
|
|
2) N-концевая+ацетил |
12 000-14 000 |
10 000 |
20 000 |
10 000-11 000 |
10 000 |
Помимо этих общих для всех гистоновых фракций особенностей, каждая из них отличается интересными различиями в аминокислотном составе. Так, относительные количества лизина и аргинина существенно разнятся для каждой фракции, хотя сумма этих аминокислот в них приблизительно одинакова. Поэтому, как уже говорилось, соотношение лизин/аргинин является величиной, строго определенной для каждой фракции. Для f1 оно составляет 10 — 13, для f2a1 — меньше 1, для f2a2 — 1,2, для f2b — 2 и для 13 — меньше 1 (см. табл. 11). Кроме того, каждая из перечисленных фракций отличается повышенным содержанием какой-то одной или двух неосновных аминокислот. Например, для лизинбогатых гистонов характерно высокое содержание аланина (до 24 мол. %) и пролина (до 10 мол. %). Фракция f2a отличается повышенным содержанием глицина (до 13 мол.%), почему ее часто называют гистоном, богатым глицином, а фракция f2b — высоким содержанием серина (7,4 мол.%). Наконец, аминокислотный состав аргининбогатых гистонов характеризуется повышенным содержанием глютаминовой кислоты (11 мол.%). Интересно, что помимо обычных аминокислот в составе двух последних фракций обнаружен ε-N-метиллизин. Содержание этой аминокислоты невелико (0,3—0,8 мол.%), и ее присутствие связывают с процессом метилирования гистонов (см.§ б).
Основными N-концевыми группами гистонов фракции f1 являются пролин и аланин (50 и 35% соответственно от всех N-концевых аминокислот). Для фракции f2a они представлены аланином, пролином, глицином и лизином (54, 12, 11, 11% соответственно). Молекулярные веса этих фракций, определенные по N-концевым аминокислотам (см. табл. 8 и 11), оказались значительно больше величин, измеренных по осмотическому давлению и скорости седиментации. Так, для f1 величины молекулярного веса, найденные физическими и химическими методами, соответственно составляли 15 000 и 30 000, а для фракции f2a — 15000 и 112000. Причина этого несоответствия, как было показано работами Филлипса, заключалась в том, что N-концевые группы во фракциях f1 и f2а оказались ацетилированными. В случае фракции f2a1 и f2a2 известен даже состав пептидов, выделенных из их триптических гидролизатов и содержащих ацетильную группу (N-Ацетил—Сер—Гли—Apr). При расчете молекулярных весов гистонов f1 и f2а с учетом степени ацетилирования N-концевых групп были получены результаты, весьма сходные с результатами ультрацептрифугирования (см. табл. 11).
N-концевыми группами фракций f2b и f3 являются соответственно пролин (80—82%) и аланин (95%). Сравнительно небольшая гетерогенность этих фракций гистонов в отношении N-концевых аминокислот позволила оценить их молекулярный вес равным 10000—11 000. С-концевыми группами у гистонов фракций f1, f2a2 и f2b является лизин, у фракции f2a1 — глицин и у аргининбогатых гистонов f3 — аланин. Таким образом, для основных фракций гистонов весь набор С-концевых групп сводится к трем аминокислотам.
Обратимся теперь к другой особенности первичной структуры гистонов — распределению остатков основных, кислых и неполярных аминокислот по длине полипептидной цепочки. Основными методами в этом случае являются электрометрическое титрование гистонов и их энзиматическое расщепление трипсином. Хорошо известно, что трипсин разрывает только те связи, которые образованы карбоксильными группами лизина и аргинина и аминогруппами других аминокислот. Таким образом, анализ пептидов триптического гидролизата позволяет оценить промежутки (число неосновных аминокислот) между основными остатками в исходной цени. Например, обнаружение пептида Ала — Apr, который не является N-концевым, означает, что в исходном белке должна существовать последовательность Лиз—Ала—Apr (Apг—Ала—Apr) с размещением одного неосновного остатка между двумя остатками основных аминокислот.
Исследования ряда авторов показали, что при гидролизе фракций f2a и f3 трипсином наряду с растворимыми пептидами образуется осадок, получивший название «кора». Эти осадки, составляющие 27% от исходного белка, содержали почти в два раза меньше основных аминокислот, чем исходные гистоновые фракции, но зато были гораздо богаче остатками дикарбоновых и неполярных аминокислот, таких, как аланин, лейцин, изолейцин и валин. В составе растворимого гидролизата фракции f3 наряду со свободными лизином и аргинином были обнаружены пептиды следующего состава:
|
Ала—Лиз |
Лиз—Apr |
|
Ала—Apr |
Гли—(Apг, Глю2)—Apг |
|
Асн—Лиз |
Гли—(Сер, Гли, Тре)—Лиз |
Это означает, что определенная доля лизина и аргинина образует дуплеты типа Лиз—Apг, Лиз—Лиз и Apг—Apг и что промежутки между такими дуплетами включают от 0 до 4 неосновных аминокислот. С учетом нерастворимых пептидов промежутки между основными аминокислотами увеличиваются до 7 других остатков. Для фракций f2a1 и f2a2 средние интервалы между основными аминокислотами составляют 3—9 других остатков. Учитывая относительно низкое содержание основных аминокислот в коре триптического гидролизата фракций f3 и f2а, можно заключить, что остатки лизина и аргинина иррегулярно расположены вдоль полипептидной цепи и группируются близко друг к другу в отдельных ее участках. Это заключение хорошо согласуется с данными электрометрического титрования. Этим методом было показано, что имидазольные, карбоксильные и тирозиновые группы титруются при pH, близких к значениям рK этих группировок, тогда как величины рK для гуанидиновых и ε-аминогрупп оказались значительно заниженными. Последнее может происходить только при большой концентрации положительного заряда и говорит о том, что лизиновые и аргининовые остатки группируются очень близко друг к другу на полипептидной цепи. Нормальные значения рK, наблюдаемые для карбоксильных групп, указывают на то, что эти группы не расположены поблизости от участков высокого положительного заряда. Анализ коровых пептидов фракции f3 показал в них высокое содержание и частоту повторения остатков дикарбоновых и неполярных аминокислот.
Однако до последнего времени было неясно, расположены ли группы основных аминокислот в разных участках полипептидной цепи аргининовых гистонов или же они смещены к какому-либо ее концу. Ответом на этот вопрос явились роботы по изучению первичной структуры гистона, богатого аргинином и глицином (фракция f2а1 или IV) Исследованиями группы Боннера и группы Буша было показано, что N-терминальная половина молекулы этого белка содержит 15 из 26 основных аминокислот, причем многие из них собраны в пачки из 3—5 последовательных остатков. С другой стороны, в С-концевой части молекулы собраны все ароматические аминокислоты, около по логины дикарбоновых аминокислот и 19 из 32 неполярных остатков. Такое расположение остатков позволяет предположить, что N-терминальная часть молекулы гистона f2a1 может участвовать в связывании с ДНК, тогда как С-концевой участок, пo-видимому, обеспечивает специфическую конформацию самого гистона и взаимодействие с другими агентами.
Фракция лизинбогатых гистонов f1 не образует нерастворимого осадка при триптическом гидролизе и одна треть пептидов гидролизата содержит в качестве N-концевых групп лизин. Следовательно, на каждые 100 аминокислотных остатков должно приходиться не менее 7 Лиз—Лиз-последовательностей, что эквивалентно примерно 50% всех лизиновых остатков. Таким образом, для фракции f1 предполагается возможным существование 15 Лиз—Лиз-последовательностей на молекулярный вес белка 21000. Кроме. того, в триптическом гидролизате были обнаружены пептиды, которые с N-конца содержали больше одного лизинового остатка. Очевидно, что наряду с дуплетами основных аминокислот во фракции f1 имеются и триплеты Лиз— Лиз—Лиз. По данным Джонса, при кислотной деградации фракции f1 80% фрагментов состояли из аланина, пролина и лизина со средним интервалом между основными аминокислотами, равным 1,7 неосновных остатков. Очевидно, что и у лизинбогатых гистонов остатки лизина распределены неравномерно относительно полипептидной цепи и группируются в «пачки». Это допущение подтверждается данными Бастина и сотр по структуре гистона, очень богатого лизином. Эти авторы показали, что карбоксил-термииальная половина молекулы белка содержит 45 из 61 лизиновых остатков и около 3/4 остатков протипа. Амино-концевая часть молекулы, наоборот, обогащена остатками дикарбоновых аминокислот (около 3Д остатков) и содержит много гидрофобных радикалов. Следует также отметить, что около 1/4 молекулы, представленной двумя пептидами, полностью лишено пролина. Эти два пептида находятся близко от середины полипептидной цепи и расположены в Н2К-половине ее. Такое расположение аминокислотных остатков в гистоне. И дает возможность предполагать, что карбоксил-термииальная область молекулы может служить для специфического взаимодействия с ДНК, тогда как амино-концевая часть ее — для взаимодействия с некоторыми другими агентами, например с теми, которые включаются в процессы репрессии и дерепрессии. В триптических гидролизатах фракции f2b обнаружено относительно небольшое количество нерастворимых пептидов (около 10% от исходного белка), которые содержат значительное количество остатков дикарбоновых и неполярных аминокислот Расстояния между основными аминокислотами здесь колеблют ся от 3 до 6 других остатков, что весьма близко к таковому для аргининбогатых гистонов.
Таким образом, эти исследования показывают, что для всех фракций гистонов характерна иррегулярность расположения основных аминокислот, промежутки между которыми могут включать от 0 до 9 других остатков. В этом отношении гистоны не отличаются от других белков, таких, как гемоглобин, миоглобин, лизоцим и рибонуклеаза, для которых указанные промежутки колеблются от 0 до 22. Однако в гистонах степень иррегулярности значительно выше, так как основная масса диамино- и дикарбоновых кислот в них группируются, по-видимому, в различных половинах молекулы. При этом отдельные фракции гистонов также отличаются друг от друга по неоднородности расположения полярных и неполярных остатков относительно полипептидной цепи. Как показывают данные электрометрического титрования, степень объединения основных аминокислот наиболее высока в гистонах f3 и f2a и значительно ниже во фракции f2b. Что касается фракции f1, то в настоящее время трудно оценить ее местоположение среди других гистонов по степени иррегулярности расположения основных остатков, так как первичная структура этого белка еще неизвестна. Однако уже сейчас можно отметить характерные отличия первичной структуры гистона f1 от структуры других фракций гистонов. Эти отличия состоят в очень высоком содержании пролина, относительно малом содержании дикарбоновых аминокислот и, вероятно, относительно равномерном распределении гидрофобных остатков в полипептидной цепи.
Все эти особенности первичной структуры отдельных фракций гистонов находят свое отражение в конформации их молекулы. Уже первоначальные измерения, проведенные на растворах и ориентированных пленках этих белков, показали, что вторичная структура гистонов весьма лабильна. Так, на ИКС-спектрах гистонов, экстрагированных из ДНП кислотой, была обнаружена только одна полоса амида I в области 1657 см-1. Если же гистоны осаждались из экстракта этиловым спиртом, то наряду с полосой амида I при 1657 см-1 наблюдалась и полоса в области 1634 см-1*. Эта полоса доминировала в спектре ориентированных пленок, получаемых из водных растворов гистонов, и уменьшалась в интенсивности, если гистоны растворялись в этиленхлоргидрине (растворитель, благоприятный для образования а-спирали). Измерения дисперсии оптического вращения также показали, что в растворе этиленхлоргидрина до 60% белка находилось в спиральном состоянии, тогда как в водных растворах доля а-спирали падала до 20%. Таким образом, эти исследования показали, что значительная часть нативного гистона находится в форме а-спирали, которая легко переходит в ß-структуру при воздействии этанола или хранении в разбавленных водных растворах.
* Колебания амидной группы дают серию характеристических полос в ИКС спектре белков. Некоторые из них а именно амид I (1660—1620 см-1) и амид II (1560—1520 см-1), чувствительны к конформации полипептидной цепи а Спираль связана с полосами 1657 см-1 для амида I и 1555 см-1 для амида II тогда как ß структура связана с полосами 1634 и 1530 см-1 соответственно
Аналогичные результаты были получены при анализе отдельных фракций гистонов. Работами Брэдбари, Меррей и Пикока было доказано, что в водных растворах степень спирализации всех фракций гистонов невелика, а для f1 она равна 0. Увеличение ионной силы и pH раствора повышали степень спирализации гистоновых фракций f2a, f2b и f3 за счет уменьшения заряда и отталкивания одноименно заряженных основных групп. Однако лизинбогатые гистоны даже в этих условиях отличались крайне малой долей спиральных участков (около 6%). С другой стороны, увеличение дисперсии оптического вращения для аргининбогатых гистонов наблюдалось не только при увеличении pH, но и при его сдвиге в кислую сторону. Очевидно, что увеличение степени спирализации в последнем случае связано как с уменьшением заряда карбоксильных групп, так и с экранирующим влиянием ионов хлора на положительно заряженные группы белка.
Все это говорит о том, что основные аминокислоты в гистонах f2a, f2b и f3 входят в те участки полипептидной цепи, которые образуют a-спираль, и что эти остатки располагаются относительно близко друг от друга. Зависимость степени спирализации гистонов от ионизации карбоксильных групп позволяет допустить, что в состав этих же спиральных сегментов входят и кислотные остатки. По-видимому, взаимодействие между основными и кислотными группировками стабилизирует спиральные yчастки за счет электростатического притяжения или образования солеобразных связей. Низкое содержание дикарбоновых аминокислот и очень высокая доля пролина в лизинбогатых гистонах делают понятным малую степень спирализации этих белков даже при высоких pH и ионной силе. Наконец, методом ядерного магнитного резонанса было доказано, что спиральные зоны гистонов f2a, f2b и f3 содержат и некоторые количества неполярных остатков.
Сопоставив данные по дисперсии оптического вращения, электрометрическому титрованию и вискозиметрии гистонов и зависимость этих показателей от pH и ионной силы раствора, Рамм, Воробьев и сотр. предположили, что молекулы гистонов имеют конформацию статистического клубка. Их полипептидные цепи содержат при нейтральном pH как спиральные, так и клубкообразные участки (рис. 17). Впервые, как уже говорилось, наряду с основными остатками входят кислые и неполярные аминокислоты. Клубкообразные участки полипептидной цепи содержат, по-видимому, большое количество основных остатков и при нейтральном pH имеют высокую плотность положительного заряда. Поэтому эти участки не спирализуются в водных растворах и лишь в малой степени приобретают конформацию а-спирали при увеличении pH и ионной силы раствора. Возможно также, что эти области обогащены неполярными аминокислотами, которые могут действовать как дестабилизаторы спиральной структуры.
Таким образом, степень спирализации отдельных гистонов и расположение спиральных и аморфных участков определяется распределением нарядов и неполярных радикалов вдоль полипептидной цени, т. е. первичной структурой белка.
При этом размеры этих участков и их местоположение в молекуле неодинаковы для различных гистонов. Так, фракция f2b, где степень группировки основных и неполярных остатков ниже, чем у аргининбогатых гистонов, содержит, по-видимому, значительное число коротких спиральных участков. У аргининбогатых гистонов число спиральных сегментов меньше при относительно большой их длине. Фракция f1 почти не содержит спиральных областей и характеризуется вытянутой конформацией даже при высоких pH и ионной силе раствора.
Как будет показано ниже, эти различия в первичной и вторичной структуре гистоновых фракций имеют непосредственное отношение к особенностям их взаимодействия с ДНК и к той роли, которую они могут играть в организации хроматина.

Рис. 17. Модель молекулы гистона (Рамч и сотр, 1970).