Химия белка - Часть 2 - Избранные разделы частной химии белка - Ашмарин И. П 1968
Гистоны
Генетическая функция гистонов
Предполагаемые функции гистонов весьма многообразны и могут быть подразделены на три группы. К ним относятся структурные («цементирование» молекул ДНК друг с другом, стабилизация ДНК, образование скелета хромосом и др.), генетические (угнетение функции гена, т. е. синтеза РНК, блокирование или стимуляция синтеза ДНК, функционирование в качестве рибонуклеаз) и некоторые другие (угнетающее действие на клетки, изменение активности митохондрий и пр.) функции. Среди них, по-видимому, наибольший интерес представляют генетические функции гистонов, и в частности модуляции действия генов.
Мысль о том, что гистоны могут играть некоторую роль в регуляции генома, была высказана еще в 1943 г. супругами Стедман на том основании, что количество ДНК в ядрах различного типа клеток менялось не столь значительно, как доля гистонов и кислых белков («хромосомина»). Это допущение позднее было сформулировано в виде гипотезы, согласно которой гистоны блокируют те участки ДНК, которые не функционируют в данном типе клеток. «Неприкрытые» участки ДНК остаются активными и определяют характер этих клеток.
Впоследствии эта гипотеза нашла свое подкрепление в работах многих авторов. Так, Олфри и Мирский показали, что до 80% ДНК может быть удалено из ядер тимуса ДНК-азой без существенного изменения интенсивности синтеза РНК. Очевидно, большая часть ДНК ядра не участвует в этом процессе и находится в репрессированном состоянии. Аналогичные результаты были получены и в тех опытах, где в качестве матрицы для синтеза РНК использовался хроматин, изолированный из клеток печени крысы. Как показали Хуанг, Боннер и другие исследователи, активность хроматина в поддержании ДНК-зависимого синтеза РНК составляет лишь 1/5 активности ДНК, приготовленной из того же хроматина (рис. 21). При этом ограничение транскрипции носит специфический характер. Последнее было убедительно доказано опытами Пола и Гильморано конкурентной гибридизации РНК. Оказалось, что РНК, транскрибированная in vitro с ядерной ДНК, гибридизуется с 40—50% депротеинизированной ДНК, тогда как РНК, синтезированная на хроматине, — лишь с 5—10% свободной ДНК. Очевидно, что только часть хромосомальной ДНК считывается РНК-полимеразой. С другой стороны, популяции молекул РНК,
генерированных с хроматинов различных тканей, почти не конкурируют между собой при гибридизации с денатурированной ДНК и содержат различные последовательности оснований. Последнее говорит о дифференцированной активности наследственного материала клетки.
Если сам хроматин в присутствии РНК-полимеразы и предшественников РНК (ГТФ, ЦТФ, УТФ и С14-АТФ) был активен в синтезе РНК, то нуклеогистонный компонент хроматина (комплекс ДНК — гистон) не обладал матричной активностью. Это также говорило о том, что ДНК в хроматине содержится в двух формах. Последнее заключение подтверждается и прямыми экспериментальными данными. Так, плавление хроматина представляет собой двухступенчатый процесс: первая ступень имеет Тпл, соответствующую Тпл чистой ДНК, тогда как вторая — Тпл нуклеогистона (рис. 22). Кроме того, хроматин проростков гороха удалось разделить на две фракции, одна из которых (10—20% ДНК хроматина) была обеднена гистоном (отношение ДНК/гистон равно 0,4) и активно поддерживала синтез РНК в присутствии ее предшественников и. РНК-полимеразы. И наконец, было показано, что комплекс ДНК- гистон, в котором фосфатные группы нуклеиновой кислоты полностью нейтрализованы основными остатками белков, не может быть матрицей РНК-полимеразной реакции.
Таким образом, все эти данные говорят о том, что часть ДНК присутствует в хроматине в форме, способной осуществлять синтез РНК, тогда как другая часть, и притом большая (80—90%), находится в форме нуклеогистона и неактивна в генерации РНК. Очевидно, что эта неактивность нуклеогистонового комплекса обусловлена присутствием гистонового компонента. Целый ряд экспериментальных данных подтверждает это заключение.
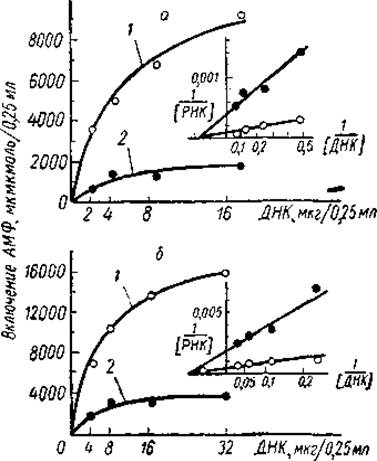
Рис. 21. Сравнение матричной активности хроматина из печени крыс и депротеинизированной ДНК из того же хроматина (Marushige a. Bonner, 1966).
а — содержание РНК-полимеразы Е. coli 30 мг, КМ — 5,3 мкг,0,25 мл; б — содержание РНК-полимеразы Е. coli 60 мг, КМ = 10,5 мкг/0,25 мл. 1 — ДНК; 2 — хроматин.
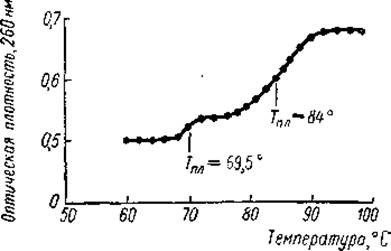
Рис. 22. Кривая плавления очищенного хроматина зародышей гороха (Боннер, 1967).
Избирательное удаление лизинбогатых гистонов (но не других белков) из хроматина 0,4 М раствором хлорноватокислого натрия (NаСlO4) резко увеличивало его матричную активность. То, что при подобной обработке хроматина активируются ранее репрессированные гены, было доказано иммунохимическим анализом синтезируемых белков. Используя хроматин проростков гороха, обедненный гистонами, РНК-полимеразу Е. coli, четыре рибозидтрифосфата и рибосомальную белоксинтезирующую систему, Хуанг и Боннер осуществили синтез белков, среди которых был выявлен и глобулин семян гороха. В обычных условиях этот белок синтезировался только в системе, которая содержала хроматин из развивающихся семядолей. Хроматин же из проростков гороха не мог служить матрицей для синтеза необходимых и-РНК. Следовательно, в хроматине проростков ген, ответственный за производство глобулина семян, репрессирован лизинбогатыми гистонами. Последние составляют значительную часть суммарного гистона проростков и потому, вероятно, подавляют активность еще многих других генов.
Аналогичные результаты были получены Г. П. Георгиевым и сотр. с нуклеопротеидами ядер асцитных клеток. При удалении из них лизинбогатых гистонов 0,6 М раствором хлористого натрия наблюдалось значительное увеличение матричной активности нуклеопротеидов, которое сопровождалось увеличением степени гибридизации вновь синтезированных РНК с ДНК этих комплексов. Очевидно, что такие нуклеопротеиды отличались не только степенью матричной активности, но также и качественно, давая РНК иного состава.
То, что гистоны при комплексировании с ДНК изменяют ее способность считываться РНК-полимеразой, было показано и другими исследованиями. Известно, что нуклеогистоны могут быть реконструированы из ДНК и гистонов путем совместного растворения их в среде с высокой ионной силой (1—2,5 М хлористый натрий) и последующего уменьшения ее с помощью диализа. Такие нуклеогистоны были воссозданы Хаунг и Боннером, Барром и Батлером из ДНК проростков гороха или тимуса теленка и четырех фракций гистонов из тех же источников. Эти комплексы были исследованы на их активность в поддержании ДНК-зависимого синтеза РНК. Оказалось, что реконструированные нуклеогистоны обнаруживают неодинаковую способность поддерживать такой синтез. Например, нуклеогистон, содержащий лизинбогатые гистоны, практически не обладал матричной активностью, тогда как комплексы, включающие аргининбогатые гистоны, сохраняли до 66% активности контроля. Фракции гистонов, относительно богатые лизином и аргинином, занимали промежуточное положение. Сходные результаты были получены в опытах Хнилицы с сотр. и А. Г. Букринской с сотр., изучавших синтез РНК в ядрышках асцитной опухоли Новикова и включение С14-уридина в куриные фибробласты. И здесь лизинбогатые гистоны значительно эффективнее тормозили синтез РНК, чем гистоны, богатые аргинином.
Угнетающее действие гистонов и их отдельных фракций на синтез РНК было также показано в опытах Олфри и Мирского е цельными ядрами тимуса теленка. Наряду с подавлением РНК-полимеразной реакции гистоны ингибировали целый ряд других процессов в ядре, в том числе и синтез АТФ. Желая доказать, что гистоны действительно изменяют матричную активность ДНК, а не тормозят синтез РНК посредством блокировки энергетических процессов, авторы поставили ряд экспериментов по удалению гистонов ядер трипсином. Для ограничения действия энзима и сохранения структуры ядра в систему добавляли специфический ингибитор трипсина соябин. В этих условиях наблюдалось 70%-ное увеличение синтеза РНК, причем преобладающим типом вновь синтезированной РНК был уже не А—У, а Г—Ц-тин. Все это говорило о том, что удаление гистонов активирует ранее репрессированные участки ДНК с иным средним составом оснований.
Однако в одном отношении данные Олфри и Мирского существенно отличались от результатов Хуанг и Боннера, полученных на реконструированных нуклегистонах. Они показали, что наиболее эффективными ингибиторами синтеза РНК в ядрах тимуса являются нe лизинбогатые, а аргининбогатые гистоны (рис. 23). Последние не только более сильно подавляли генетическую активность хромосом, но и меняли их морфологию. Как было показано на ламповых хромосомах овоцитов тритона, даже кратковременное воздействие аргининбогатых гистонов приводило к втягиванию хромосомных петель, которые являются местом активного синтеза РНК. В этом отношении аргининбогатые гистоны напоминали актиномицин Д.
Аналогичные результаты были получены и целым рядом других исследователей. Так, например, в опытах Скалка для одинакового подавления синтеза РНК в системе, включающей ДНК, четыре рибозидтрифосфата и РНК-полимеразу Е. coli, требовалось в пять раз больше лизинбогатых гистонов тимуса, чем гистонов, богатых аргинином.
Таким образом, все эти исследования говорят о том, что именно гистоны являются ингибиторами матричной активности ДНК. Правда, в одних опытах ДНК-зависимый синтез РНК наиболие эффективно угнетали лизинбогатые гистоны, тогда как них — гистоны, богатые аргинином. Возможно, что эти обусловлены неодинаковыми концентрациями гистонов з используемых модельных системах. Известно, что матричная активность хроматина может быть в значительной степени обусловлена его физическим состоянием у что синтез РНК значительно сильнее протекает в диффузном (растворимом) хроматине, чем в конденсированном (гелевом). Поскольку все эти эксперименты проводились в растворах низкой ионной силы, то при соотношении гистон/ДНК, равном 0,8-1,5, наиболее активными репрессорами ДНК могли быть лизинбогатые гистоны. Напомним, что последние полнее всего осаждают. ДНК при указанных концентрациях. При большем избытке белка таковыми, возможно, становились аргининбогатые гистоны, ибо фракция f1 в этих условиях могла вызвать перерастворение комплекса ДНП и сделать его доступным для транскрипции. В пользу такого предположения говорят данные Джонса и Форрестера, которые показали, что в растворах низкой ионной силы лизинбогатые гистоны вызывают растворение комплекса ДНК — гистон f1, если отношение белок/ДНК становится выше 1,6.
С другой стороны, подавление РНК-полимеразной реакции гистонами может зависеть и от структурных особенностей самих гистонов. На это указывают модельные опыты по синтезу РНК в системе, содержащей РНК-полимеразу из ядер. Оказалось. что в этих условиях наиболее сильно подавляли полимеразную реакцию как аргининбогатые гистоны тимуса, так и лизинбогатые гистоны проростков гороха. По мнению Олфри и Мирского, различия в угнетающем действии отдельных гистонов на синтез РНК определяются такими факторами, как распределение поверхностного заряда, степень спирализации, вторичные структурные изменения, степень агрегации. Иными словами, угнетающий эффект отдельных гистонов на полимеразную реакцию может зависеть от особенностей их первичной и вторичной структуры. Существенным подтверждением этого положения является целый ряд данных, говорящих о том, что модификация структуры гистонов в результате ацетилирования, фосфорилирования или замыкания дисульфидных сшивок существенно изменяет их способность подавлять синтез РНК (см. § 7). Возможно также, что различный ингибиторный эффект отдельных фракций гистонов может быть обусловлен и различным их отношением к самой РНК-полимеразе.
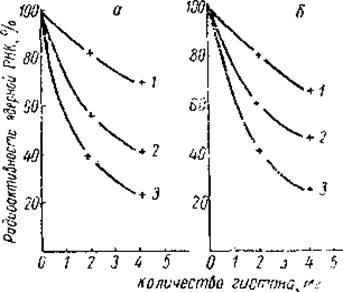
Рис. 23. Влияние гистонов на включение в РНК 8-С14-гуанозина (а) и 8-С14-аденозина (ff), добавленных к препаратам ядер тимуса теленка (Allfrey et al. 1963).
1 — фракция f1, 2 — суммарные гистоны, 3 — фракция f3.
Наконец, различия в угнетающем действии отдельных гистонов могут, вероятно, определяться не только особенностями самих гистонов, но и порядком чередования оснований в ДНК. Выше уже приводились некоторые данные о повышенном сродстве лизинбогатых гистонов к АТ-парам ДНК. Работами Л. П. Ананьевой, Г. П. Георгиева и сотр. показано, что в хромосомах высших организмов существует неравномерная повторяемость нуклеотидных последовательностей ДНК. Ограничение транскрипции с ДНК в ДНП носит специфический характер — прежде всего ограничен синтез на повторяющихся нуклеотидных последовательностях ДНК. Обработка ДНП 0,6 M хлористым натрием, т. е. удаление лизинбогатых гистонов, приводит к увеличению синтеза РНК именно па этих последовательностях. Отсюда был сделан вывод, что лизинбогатыe гистоны ответственны за ограничение транскрипции с повторяющихся последовательностей ДНК, в которых преобладают, вероятно, АТ-пары оснований. В этой связи интересны данные о том. что повторяющиеся последовательности ДНК топографически связаны с компактным хроматином и что именно лизинбогатым гистонам принадлежит особая роль в организации структуры последнего (см. § 5).
О роли азотистых оснований ДНК в процессе взаимодействия последней с гистонами говорят и опыты по изучению влияния поликатионов на процесс транскрипции. Так Скалка, Гурвич и Видхолм показали, что подавление гистонами РНК-полимеразной реакции пропорционально содержанию АТ-оснований в ДНК-матрице (чем выше соотношение А+Т/Г+Ц, тем слабее включение нуклеотидов в РНК при одной и той же концентрации гистонов в системе). Характер синтезируемой РНК (соотношение оснований А+У/Г+Ц и частота сочетаний соседних нуклеотидов) зависел как от типа гистона-ингибитора, так и от содержания тимина и аденина в ДНК. Например, если в качестве матрицы использовали ДНК с соотношением А+Т/Г+Ц, равным 1,8, то соотношение А+У/Г+Ц в синтезированной РНК составляло 3,15. При добавлении в систему лизинбогатых гистонов это соотношение понижалось до 2,08, тогда как аргининбогатые гистоны повышали его до 4,5—5,3. Значительное уменьшение АУ-пар в синтезируемой РНК при подавлении реакции гистоном f1 говорит о повышенном сродстве последнего к АТ-парам ДНК.
Таким образом, имеющиеся данные говорят о том, что в хроматине клетки ДНК находится в двух формах, одна из которых неактивна в поддержании синтеза РНК (80—90% всей ДНК). Подавление матричной активности ДНК обусловлено пістонами, положительные группы которых электростатически взаимодействуют с ДНК. Различные типы гистонов оказывают неодинаковый эффект не только на интенсивность ДНК-зависимого синтеза РНК, по и на тип синтезируемой РНК, подавляя, вероятно, активность различных генов. Вместе с тем угнетение РНК-полимеразной реакции зависит не только от типа гистона, но и вторичных изменений последнего, происходящих при модификации его первичной и вторичной структур. Известную роль в этом процессе может играть и соотношение гистон/ДНК, равно как и ионная сила среды.
Вероятно, что присоединение лизинбогатых гистонов определяется азотистыми основаниями ДНК и происходит преимущественно по участкам, обогащенным АТ-парами. Однако селективность взаимодействия остальных типов гистонов с определенными участками ДНК (специфичность репрессии) еще не доказана. Поэтому один из основных вопросов биохимии гистонов состоит в том, как сочетаются эффект действия гистонов на ДНК со специфичностью. Для решения этого вопроса необходимо прежде всего выяснить, обладают ли сами гистоны тканевой и видовой специфичностью.