Основи біоорганічної хімії (навчальний посібник) - Г. О. Сирова - 2018
Тема
Класифікація, номенклатура та ізомерія біоорганічних сполук.
Природа хімічного зв'язку
Актуальність теми. Біоорганічна хімія вивчає речовини, які беруть участь у процесах життєдіяльності в безпосередньому взаємозв'язку з їхніми біологічними функціями. Головна проблема для біології та медицини - з'ясування взаємозв'язку структури сполуки з механізмом її біологічного функціонування, тобто взаємозв'язок «структура-функція».
Унаслідок унікальної здатності атома карбону утворювати безліч карбон- карбонових зв'язків органічних сполук налічується вже понад 10 мільйонів. Щоб орієнтуватися в цьому розмаїтті речовин, необхідно знати їх наукову класифікацію й номенклатуру. Розуміння характеру хімічного зв'язку біоорганічних сполук створює основу для засвоєння хімічних властивостей цих речовин, а значить - для прогнозування їхньої поведінки в біохімічних перетвореннях.
Дана тема є базовою при вивченні як курсу біоорганічної хімії, так і біологічної хімії, фармакології та ін. медико-біологічних дисциплін, оскільки органічні речовини, представлені в живій природі, використовуються як лікарські засоби.
Загальна мета: засвоїти основні принципи наукової класифікації та номенклатури біоорганічних сполук; уміти характеризувати тип хімічного зв'язку в цих сполуках.
Конкретні цілі:
1. Знати класифікацію органічних сполук за характером карбонового скелету та функціональними групами.
2. Засвоїти принципи міжнародної замісної номенклатури (ІЮПАК).
3. Уміти записувати структурні формули біоорганічних речовин за назвою.
4. Вивчити ізомерію біоорганічних речовин.
5. Пояснювати механізм виникнення хімічних зв'язків у біоорганічних сполуках залежно від валентного стану атома карбону.
Теоретичні питання
1. Класифікація органічних сполук за характером карбонового ланцюга.
2. Класифікація органічних сполук за функціональними групами.
3. Номенклатура органічних сполук:
а) тривіальна.
б) міжнародна замісна номенклатура ІЮПАК.
в) радикало-функціональна (раціональна).
4. Електронна будова атома карбону в органічних сполуках. Природа хімічного зв'язку в органічних сполуках.
5. Ізомерія в органічних сполуках. Внесок Бутлерова О.М. в розроблення основних положень ізомерії.
1. За характером карбонового ланцюга безліч органічних сполук поділяються на:
1. Ациклічні сполуки, що мають незамкнуті ланцюги карбонових атомів:
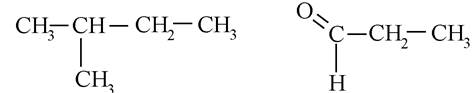
2. Карбоциклічні сполуки, які містять цикли, утворені лише атомами карбону:
3. Гетероциклічні сполуки, які містять цикли, в утворенні яких, крім атомів карбону, беруть участь атоми інших елементів (гетероатоми: N, O, S):

2. Усередині кожної групи існують класи сполук, властивості яких обумовлені наявністю певних груп атомів, що називаються функціональними групами. Функціональні групи, класи, які їм відповідають, їхні загальні формули подані в таблиці.
Функціональні групи та відповідні класи сполук

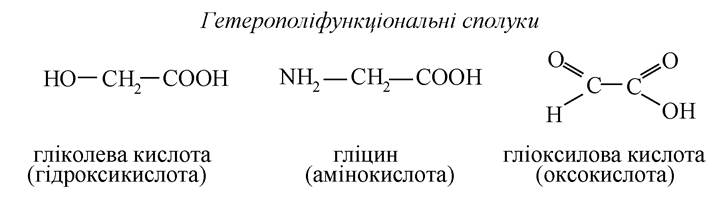
Сполуки, подані в таблиці, містять одну функціональну групу і є монофункціональними.
Однак, ознакою фізіологічної активності є поліфункціональність, тобто наявність в тій самій речовині кількох однакових (гомополіфункціональні) або декількох різних (гетерополіфункціональні) функціональних груп. Приклади:
Сполуки кожного класу органічних сполук можна розташувати в гомологічні ряди - групи споріднених сполук, що мають однакові властивості, у яких кожна наступна відрізняється від попередньої на групу -СН2-
(гомологічна різниця).
3. Номенклатура - система правил, що дозволяє давати однозначну назву кожній індивідуальній речовині. Існує кілька видів номенклатур: тривіальна номенклатура, замісна номенклатура (женевська номенклатура, міжнародна номенклатура ІЮПАК), радикало-функціональна (раціональна).
Тривіальні назви виникли історично, випадково й не систематично. Ці назви відображають джерела виділення речовин (лимонна кислота, молочна кислота, мурашина кислота та ін.), способи отримання (піровиноградна кислота отримана піролізом виноградної кислоти), галузь застосування (аскорбінова кислота - проти «скорбуту» - цинги) і т. ін.
Найбільш інформативною є сучасна наукова замісна номенклатура ІЮПАК. При складанні назв за цією номенклатурою використовують поняття радикал, родоначальна структура, характеристична група, замісник.

Радикал - частинка з неспареними електронами, що утворюється при відніманні одного або декількох атомів гідрогену від молекули вуглеводню (карбогідрогену). Найчастіше в назвах використовуються радикали перших чотирьох представників гомологічного ряду насичених вуглеводнів (карбогідрогенів):
«Перв.» - первинний, вільна валентність розташована біля первинного атома карбону, - атома, поєднаного тільки з одним сусіднім атомом карбону.
«Втор.» - вторинний, вільна валентність розташована біля вторинного атома карбону, - атома, пов'язаного з двома сусідніми атомами карбону.
«Трет.» - третинний, вільна валентність розташована біля третинного атома карбону, - атома, поєднаного з трьома сусідніми атомами карбону.
Родоначальна структура - це хімічна структура, яка складає основу названої сполуки (головний карбоновий ланцюг або цикл).

Характеристична група - функціональна група, пов'язана з родоначальною структурою або така, що частково входить до її складу.
Замісник - будь-яка характеристична група або радикал, приєднаний до родоначальної структури.
Формування назви органічної сполуки відповідно до замісної номенклатури здійснюють за такими правилами:
1) визначають старшу характеристичну групу, якщо вона присутня (див. таблицю). Ця група відображається у назві закінченням;
2) визначають родоначальну структуру. Це повинен бути найдовший карбоновий ланцюг, який містить максимальну кількість кратних зв'язків, характеристичних груп;
3) нумерують родоначальний ланцюг так, щоб старша характеристична група отримала найменший номер;
4) називають молодші характеристичні групи, некарбонові характеристичні групи, вуглеводневі (карбогідрогенні) радикали префіксами в алфавітному порядку, зазначивши їхнє місце розташування відповідними цифрами;
5) називають родоначальну структуру назвою бічних вуглеводнів (карбогідрогенів) з відповідною кількістю карбонових атомів і додають до назви закінчення для старшої характеристичної групи.
Ступінь насиченості родоначальної структури відображають суфіксами: насичений вуглеводневий (карбогідрогенний) скелет - ан; наявність подвійного зв'язку - ен; потрійного зв'язку - ін (-ин).
Цифри ставлять перед префіксами і після суфіксів або закінчення. Якщо в сполуці є кілька однакових замісників або кратних зв'язків, то перед відповідним позначенням ставиться помножуючий префікс: ди-, три-, тетра-, пента- і т. ін.
Деякі некарбонові характеристичні групи, які зазначають лише в префіксах
Група |
Префікс |
-Br, -I, -F, -Cl |
Бром, йод, фтор, хлор |
-OR |
Алкокси |
-SR |
Алкілтіо |
-NO2 |
Нітро |
Порядок старшинства характеристичних груп, які зазначають і у префіксі, і в закінченні
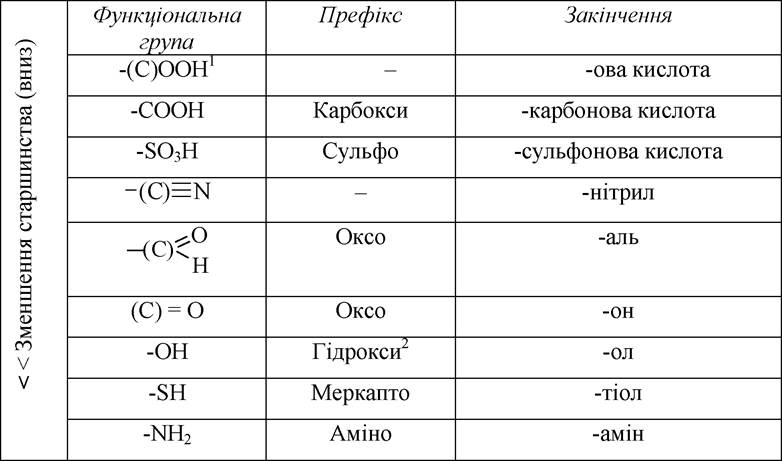
1 - атом карбону, взятий в дужки, входить до складу карбонового ланцюга;
2 - у російськомовній літературі група -ОН називається також оксигрупою.
Приклади назв:
Монофункціональні сполуки:
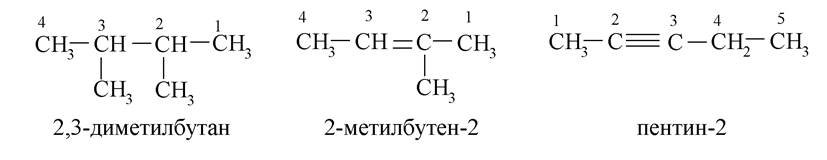
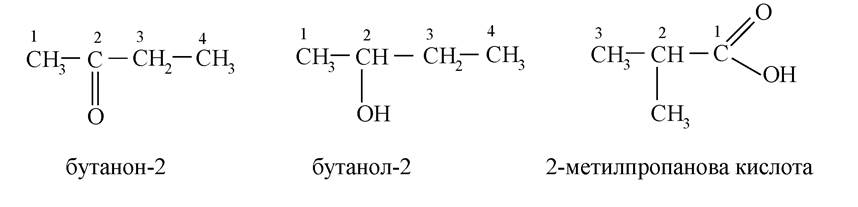
Гомополіфункціональні сполуки
Багатоатомні спирти:
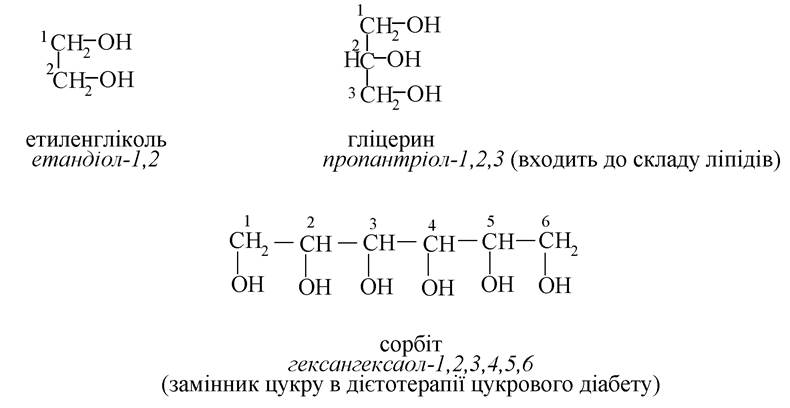
Двоосновні карбонові кислоти (дикарбонові):

Гетерополіфункціональні сполуки
Аміноспирти

Гідроксикислоти
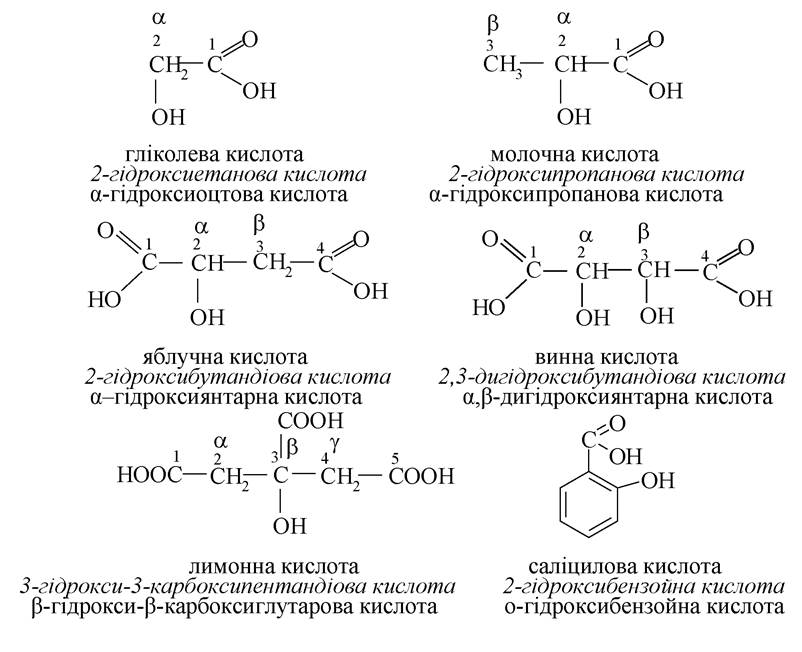
Оксокислоти (альдегідо- та кетокислоти)


Альдегідо- та кетоноспирти
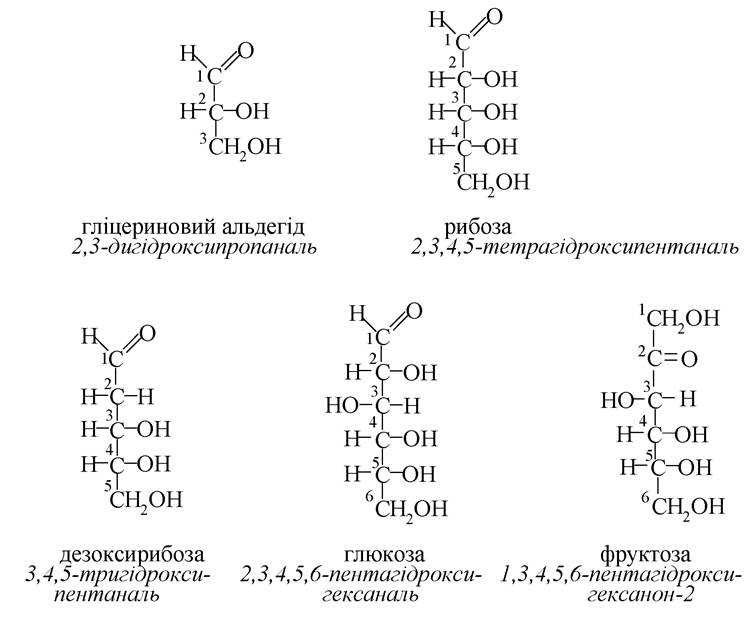
Амінокислоти

Застосування радикало-функціональної номенклатури більш обмежене. Вона використовується для назви простих моно- і біфункціональних сполук і деяких класів природних речовин (див. гідроксикислоти, оксокислоти, амінокислоти).
Якщо сполука має одну характеристичну групу, то її назва будується з назв радикалів і характеристичної групи або класу сполук:

У більш складних речовинах вибирають родоначальний ланцюг або цикл, розташування замісників позначають буквами грецького алфавіту: α, β, γ, δ, ε і т. ін.
Для дизаміщених бензолу положення замісників позначається префіксами: орто- (о-), мета- (м-), пара- (п-).
4. Властивості органічних сполук багато в чому визначаються електронною будовою атома карбону і характером його хімічних зв'язків. У збудженому стані (1s2 2s1 2p3 ) атом карбону має чотири неспарених електрони і, отже, може утворити чотири ковалентні зв'язки. При цьому всі зв'язки в структурах типу СХ4 рівноцінні. Для пояснення цього явища Л. Полінг ввів поняття «гібридизація» - своєрідна взаємодія близьких за енергією орбіталей з утворенням так званих гібридних орбіталей з більш низькою енергією.
Для атома карбону можливі три різних типи гібридизації.
1. sр3 -гібридизація, при якій взаємодіють одна s- і три р-орбіталі і утворюються чотири енергетично рівноцінні гібридні орбіталі, які мають форму об’ємних вісімок з неоднаковими лопатями (рис. 1). Найбільше віддалення електронів відповідає напрямку гібридних орбіталей до вершин правильного тетраедра під кутом 109°28'. Атоми карбону, не зв’язані з іншими атомами кратними зв’язками, перебувають в sр3 -гібридному стані та орбіталі мають просторову конфігурацію. Хімічні зв’язки в цьому випадку утворюються за рахунок осьового перекривання гібридних орбіталей атома карбону з орбіталями сусідніх атомів. У результаті утворюються σ-зв’язки, в яких максимальна електронна густина знаходиться між ядрами атомів на прямій, яка їх з’єднує. Типовими сполуками, в яких атом карбону перебуває в sp3-гібридному стані, є насичені вуглеводні (карбогідрогени), алкани.
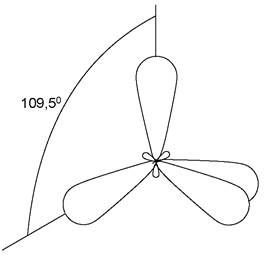
Рис. 1
2. sp2-гібридизація, при якій взаємодіють одна s- та дві р-орбіталі з утворенням трьох гібридних орбіталей, осі яких розташовані в одній площині та спрямовані з центру трикутника до його вершин під кутом 120° (рис. 2).
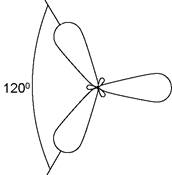
Рис. 2
Напрямок негібридизованої р-орбіталі перпендикулярний площині, в якій розташовані гібридні орбіталі. При sр2 -гібридизації має місце осьове перекриття гібридних орбіталей між атомами карбону та бічне перекривання негібридних р-орбіталей (рис. 3).
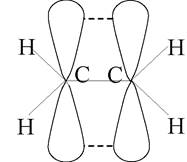
Рис. 3
У останньому випадку утворюється π-зв’язок, електронна хмара якої розташована вище та нижче площини σ-зв’язків. Типовими сполуками, в яких атоми карбону перебувають у стані sр2 -гібридизації, є етилен та його гомологи (алкени).
3. sp-гібридизація, при якій взаємодіють одна s- та одна р-орбіталь, а також утворюються дві гібридні орбіталі. Вони розташовані лінійно під кутом 180°. Дві негібридні р-орбіталі, що залишилися, розташовані у взаємно перпендикулярних площинах. При сполученні двох атомів карбону в стані sр-гібридизації між ними утворюється один σ- та два π-зв’язки (рис. 4). sр-Гібридизація карбонових атомів реалізується в ацетилені та його гомологах (алкінах).
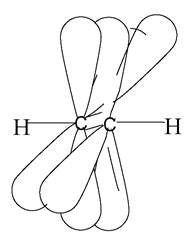
Рис. 4
Основними величинами, які характеризують міцність зв’язку, є його енергія й довжина. У загальному випадку зв’язок тим міцніший, чим більша його енергія та менша довжина. У таблиці наведено значення енергії й довжини деяких зв’язків.
Зв’язок |
Е, кДж/моль |
∆Е |
l, нм |
C - C C = C C ≡ C C - H |
346 620 810 411 |
274 190 |
0,154 0,133 0,120 |
З порівняння величин енергії одинарного й кратного зв'язків видно, що енергія π-зв'язку менша, ніж енергія σ-зв'язків, тобто πп-зв'язок менш міцний.
Залежно від електронегативності атомів, що утворюють ковалентний зв'язок, він може бути неполярним або полярним. Електронегативність - це здатність атома зміщувати до себе загальну пару електронів при утворенні ковалентного зв'язку з іншими атомами.
Полярність зв'язку зростає зі зростанням різниці електронегативності зв'язаних атомів. Поляризованість зв'язку - міра зсуву електронів зв'язку під впливом зовнішнього електричного поля, у тому числі атакуючої частинки. Поляризованість характеризується рухливістю електронів. Більш рухливі електрони більш віддалені від ядра. Поляризованість π-зв'язку вища, ніж σ-зв'язку.
Велике значення для формування структури й властивостей біоорганічних сполук відіграє водневий зв'язок. Це зв'язок, що виникає між атомами гідрогену й іншим сильно електронегативним атомом (N, O, F). Він може бути внутрішньомолекулярним і міжмолекулярним, позначається трьома крапками:
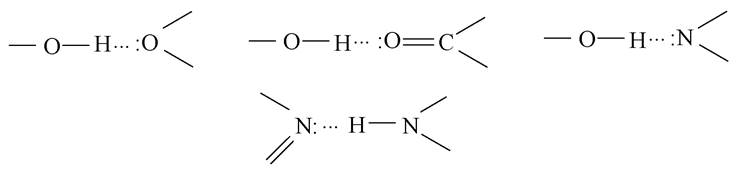
Енергія водневих зв'язків невелика (10-40 кДж/моль), тому цей зв'язок мало міцний, проте впливає на властивості сполук, у тому числі і на фізіологічні.
5. Найвизначнішою подією в розвитку органічної хімії було створення в 60-х роках XIX століття видатним російським вченим О.М. Бутлеровим теорії хімічної будови органічних сполук. Одним з положень цієї теорії є положення про те, що властивості речовин залежать не тільки від того, які атоми і в якій кількості входять до складу її молекули, але й від того в якому порядку вони з'єднані між собою, тобто від хімічної будови молекули.
Це положення теорії хімічної будови О.М. Бутлерова пояснювало надзвичайно широко поширене серед органічних речовин явище ізомерії. Ізомери - речовини, що мають однаковий якісний і кількісний склад, але відрізняються будовою, а значить - і властивостями.
Можлива ізомерія карбонового ланцюга:
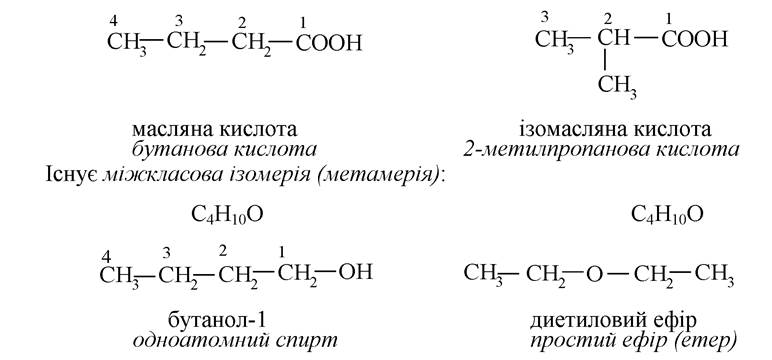
Деякі органічні сполуки відрізняються розташуванням функціональних груп у ланцюгу або в циклі (ізомерія положення):

У результаті різного розташування окремих частин молекули в просторі виникає просторова ізомерія (стереоізомерія). Одним з його видів є цис-транс- ізомерія похідних етилену. Цис-ізомер - сполука, у молекулі якої замісники перебувають по один бік від площини подвійного зв'язку. Транс-ізомери - сполука, в молекулі якого замісники перебувають по різні боки від площини подвійного зв'язку.

Більш стабільними є транс-ізомери.
Виконайте завдання та перевірте правильність їх розв’язання за еталонами відповідей
Завдання № 1
1. Назвіть правильну міжнародну назву речовини:
A. Оксоетанова кислота.
B. Альдегідокислота.
C. Гідроксиетанова кислота.
D. Г ліоксилова кислота.
2. Місцевоанестезуючі засоби - новокаїн, анестезин та ін. - похідні n-амінобензойної кислоти. Вкажіть її структуру.
3. Вкажіть сполуку, у молекулі якої є атоми карбону в sp-гібридному стані:
Еталони відповідей: 1 - А; 2 - В; 3 - С.
Завдання № 2
1. Укажіть тип гібридизації атомів у молекулі піролу.
А. sp B. sp2 C. sp3 D. spd2
2. Які з названих сполук є ізомерами:
A. Бутанова кислота та бутанол.
B. Диетиловий етер та диметиловий етер.
C. Оцтовометиловий ефір та пропанова кислота.
D. Пропен і пропан.
3. Укажіть правильну раціональну назву речовини:

А. 2,3-дигідроксибутандіова кислота.
B. Винна кислота.
C. Дигідроксибутанова.
D. α, β-дигідроксиянтарна кислота.
Еталони відповідей: 1 - В; 2 - С; 3 - D.
Завдання № 3
1. Який тип хімічного зв’язку у наведеній нижче речовині:

A. Ковалентний неполярний.
B. Ковалентний полярний.
C. Водневий.
D. Іонний.
2. До якого класу сполук належить речовина:

A. Ароматична амінокислота.
B. Амінокислота.
C. Ароматичний аміноспирт.
D. Аміноспирт.
3. Який тип ізомерії можливий для бутендіової кислоти?
A. Ізомерія карбонового ланцюга.
B. Цис-транс-ізомерія.
C. Ізомерія положення кратного зв’язку.
D. Міжкласова ізомерія.
Еталони відповідей: 1 - С; 2 - А; 3 - В.