Основи біоорганічної хімії (навчальний посібник) - Г. О. Сирова - 2018
Тема
Структура, властивості і біологічне значення функціональних похідних карбонових кислот (гідрокси-, кето-, фенолокислот)
Актуальність теми. Характерною властивістю живої матерії є біологічний обмін речовин з навколишнім середовищем. При цьому мають перебіг численні, надзвичайно різноманітні реакції біосинтезу, розщеплення, окиснення, заміщення та інші. Г етерофункціональні органічні сполуки, зокрема гідрокси- і кетокислоти, є речовинами, які беруть участь у процесах метаболізму. Багато окиснювально-відновних реакцій в організмі пов'язані з утворенням і участю гідрокси- і кетокислот (окиснення вуглеводів і жирних кислот, цикл трикарбонових кислот, трансамінування амінокислот та ін.). Оскільки складні біологічні системи визначаються властивостями простих органічних функцій, то знання хімічних властивостей функціональних груп допомагає прогнозувати властивості фізіологічно активних речовин. Вивчення будови і хімічних властивостей гідрокси- і кетокислот становить основу для розуміння їх метаболічних перетворень в організмі. Низка похідних гідрокси-, кето-, фенолокислот є лікарськими препаратами. Наприклад, солі молочної кислоти (лактати) застосовуються при недокрів'ї, складний ефір саліцилової кислоти з оцтовою (аспірин) має жарознижувальну та слабку аналгетичну дію і т. ін.
Загальна мета: уміти аналізувати відповідність структури біоорганічних сполук фізіологічним функціям, які вони виконують в організмі людини.
Конкретні цілі
1. Робити висновки й аналізувати взаємозв'язок між будовою, конфігурацією і конформацією біоорганічних сполук.
2. Інтерпретувати залежність реакційної здатності біоорганічних сполук від природи хімічного зв'язку та взаємного впливу атомів у молекулі.
3. Інтерпретувати механізм реакцій різних класів біоорганічних сполук, їх перетворення в біологічних системах.
Теоретичні питання
1. Класифікація та ізомерія гідроксикислот.
2. Хіральність, асиметричний атом карбону, енантіомери, діастереоізомери. Оптична активність.
3. Хімічні властивості і біологічне значення гідроксикислот.
4. Біологічне значення кетонокислот та їхніх похідних.
5. Кетонові тіла, діагностичне значення їх визначення при цукровому діабеті.
6. Кето-енольна таутомерія кетонокислот та їхніх похідних.
7. Фенолокислоти та їх похідні. Використання їх в медицині у вигляді лікарських препаратів.
1. Гідроксикислоти - це гетерофункціональні органічні сполуки, що містять гідроксильні й карбоксильні групи. Класифікацію гідроксикислот виконують залежно від кількості гідроксильних і карбоксильних груп. При цьому розрізняють:
- моногідроксимонокарбонові кислоти:
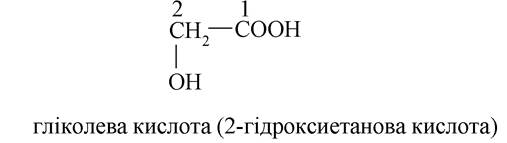
- моногіроксидикарбонові кислоти:
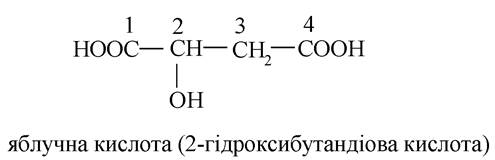
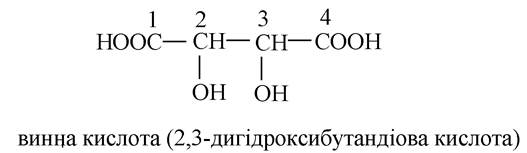
- дигідроксидикарбонові кислоти:
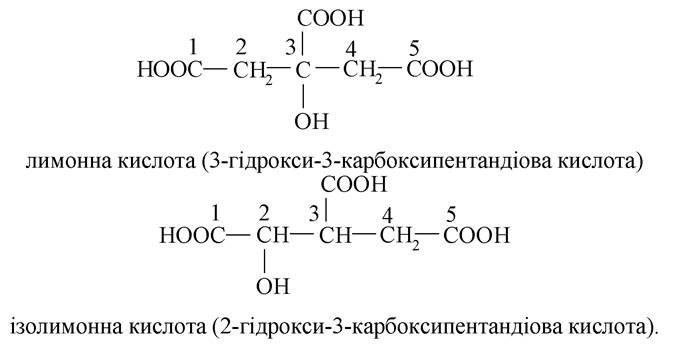
- моногідрокситрикарбонові кислоти:
Для гідроксикислот характерна ізомерія, викликана різним розташуванням гідроксильних груп (функціональна ізомерія), тому класифікують гідроксикислоти залежно від положення гідроксигруп:
- α-гідроксикислоти:

α-гідроксипропіонова кислота (молочна кислота)
- β-гідроксикислоти:
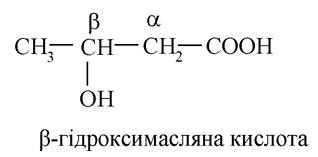
- γ-гідроксикислоти:

Поряд зі структурною ізомерією для гідроксикислот характерна стереоізомерія (просторова ізомерія). Стереоізомери гідроксикислот є конфігураційними ізомерами, які відрізняються різним просторовим розташуванням замісників при атомі карбону.
2. Органічну молекулу можна розглядати як геометричне тіло і застосовувати до неї поняття симетрії геометричних фігур. Одним з елементів симетрії є площина симетрії - це уявна площина, що проходить через молекулу або атом карбону з його замісниками і ділить молекулу на дві однакові частини. Однак існують органічні молекули, що не мають площини симетрії, і такі молекули виявляються несумісними зі своїм дзеркальним зображенням. Ця властивість називається хіральністю, а молекули - хіральними. Термін «хіральність» означає, що будь-які два предмети знаходяться в таких відносинах один з одним, як ліва і права рука. Хіральність - поняття геометричне, а не хімічне.
Найпростіший випадок виникнення хіральності молекули обумовлений наявністю центру хіральності, яким слугує sp -гібридизований атом (карбон, нітроген та ін.), що містить чотири різних замісника. У зв'язку з тим, що в такого атома відсутня симетрія, його називають асиметричним і позначають С*. Однак наявність хірального центру - не єдина умова хіральності молекули.
Більшість молекул гідроксикислот є хіральними. Прикладом слугує молочна кислота:
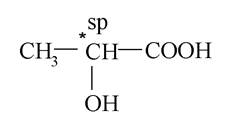
Обидві її функціональні групи розташовані при одному sp 3-гібридизованому атомі карбону з чотирма різними замісниками. Цей атом карбону називається хіральним центром, а молекула молочної кислоти - хіральною. Стереоізомери молочної кислоти за рахунок хіральності молекул, як було зазначено вище, відносяться між собою як предмет і несумісне з ним дзеркальне зображення. Такі стереоізомери називаються енантіомерами, вони мають однакові фізичні й хімічні властивості. Відрізняються вони тим, що при пропусканні через розчин, в якому знаходяться енантіомери, поляризованого променя світла площина його поляризації відхиляється на певний кут, то за годинниковою стрілкою, то проти годинникової стрілки. Здатність обертати площину поляризації світла називається оптичною активністю. Виходячи з цієї здатності енантіомерів, їх називають оптичними ізомерами. Енантіомери мають однакове значення кута обертання (а), але протилежний його напрямок: один лівообератльний (-); інший - правообертальний (+). Величина і знак обертання визначаються експериментально за допомогою приладів (наприклад, поляриметра). Суміш однакових кількостей енантіомерів називається рацематами. Останні не мають оптичної активності. Для зображення енантіомерів на площині використовують проекційні формули Фішера.
Розглянемо зображення енантіомерів на площині на прикладі молочної кислоти. Як зазначалося вище, хіральний атом карбону кислоти знаходиться в sp3 -гібридизації - гібридні орбіталі спрямовані в просторі до вершин тетраедра, тому молочна кислота в просторі має тетраедричну модель, яку перед проектуванням на площину розташовують так, щоб вгорі опинилася карбоксильна група (найбільш окиснена), а на горизонтальному ребрі розташовуються атом гідрогену і гідроксигрупа. У точці перетину горизонталі і вертикалі переноситься хіральний атом карбону, він не позначається символом. Замісники, віддалені від спостерігача, розміщуються по вертикалі:

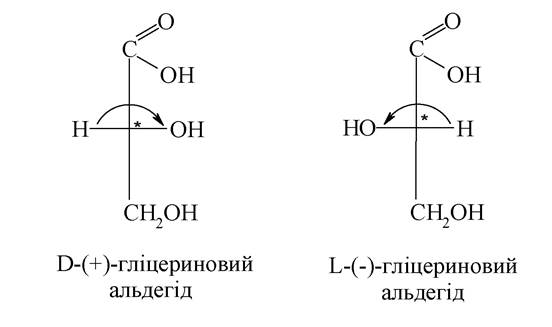
Для позначення конфігурації оптичних ізомерів використовують стереохімічну номенклатуру. Великі букви D і L стали символами цієї номенклатури. До D-стереохімічного ряду належать споріднені до D-гліцеринового альдегіду (конфігураційний стандарт) сполуки з такою конфігурацією хірального центру, коли гідроксигрупа в проекції Фішера розташовується праворуч від вертикальної, а до L-ряду - ліворуч:
Багато біологічних речовин містять у молекулі кілька центрів хіральності. Підрахунок числа стереоізомерів здійснюється за формулою 2n, де n - число хіральних центрів. Так, наприклад, винна кислота є представником сполук з двома центрами хіральності. За розрахунками вона повинна існувати у вигляді двох пар енантіомерів і двох рацематів. Однак у неї є тільки чотири такі форми:
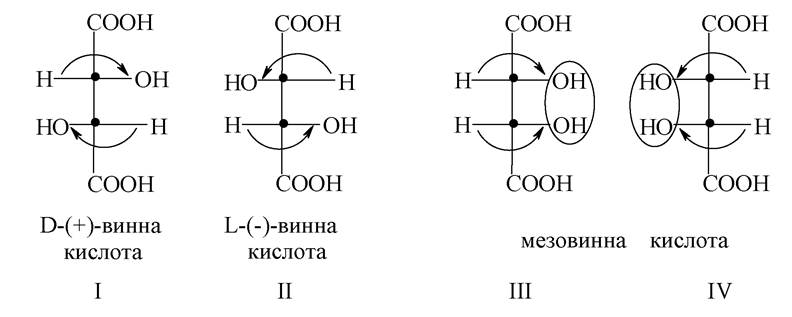
Стереоізомери I і II є парою енантіомерів, що мають протилежні знаки обертання.
Стереоізомери III і IV повинні були б скласти другу пару енантіомерів, проте вони ідентичні. Стереоізомери III і IV не є енантіомерами, тому що при повороті однієї з проекційних формул на 180о на площині паперу проекційні формули їх збігаються і відповідають тій самій сполуці - мезовинній кислоті. Це пояснюється тим, що обидва центри хіральності мають однакові замісники. Тому в молекули з'являється площина симетрії, і вона ахіральна, тобто не має оптичної активності. Стереоізомери, які не є дзеркальним зображенням один одного і мають різні фізичні і хімічні властивості, називаються діастереомерами. З просторовою будовою молекул пов'язана стереоспецифічність біохімічних процесів, яка, наприклад, проявляється при біологічній дії одного з енантіомерів у той час, як інший енантіомер може бути повністю не активний, хоча їх хімічні властивості однакові. Так, лікарський засіб протипухлинної дії сарколізін є лівообертальним енантіомером, а правообертальний енантіомер сарколізину не активний, що пояснюється так. Активність лікарських речовин проявляється при їх взаємодії з рецепторами клітини. При цьому молекула лікарського препарату повинна мати таку конфігурацію, яка дозволяла б найбільш повно зв'язуватися з рецептором. Макромолекули біологічних каталізаторів - ферментів, побудовані з L-α-амінокислот, тобто з хіральних молекул, вступають у взаємодію тільки з тими субстратами, які також мають певну конфігурацію. Хіральний реагент проявляє чутливість до хіральності молекул, які з ним реагують, у зв'язку з цим ферментативні реакції дуже специфічні.
3. Властивості гідроксикислот обумовлені наявністю функціональних груп, що входять до їх складу, і їхнім впливом одна на одну. Наявність карбоксильної групи в гідроксикислоті обумовлює кислотні властивості, декарбоксилювання, здатність утворювати складні ефіри і галогенангідриди. Виявляючи кислотні властивості, гідроксикислоти взаємодіють з металами, оксидами металів, гідроксидами металів, солями. Реакція заміщення протона гідрогену в дикарбонових кислотах відбувається поступово: спочатку утворюється кисла сіль, а потім - середня.
Кислі солі - малорозчинні сполуки, а середні солі добре розчиняються у воді:
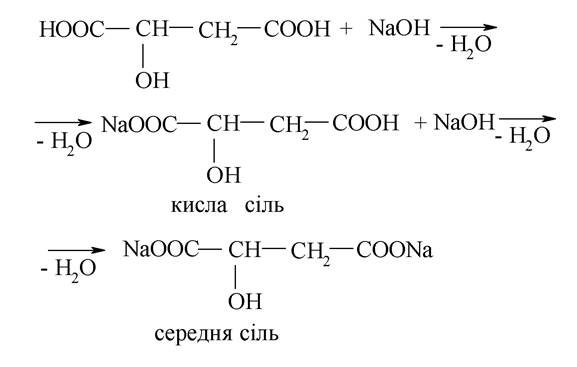
Ця властивість використовується для доказу наявності в кислоті двох карбоксильних груп.
Декарбоксилювання - одна з найбільш важливих реакцій. Наявність у гідроксикислоті гідроксилу (особливо в a-положенні), що є електроноакцепторною групою, і поляризуючого зв'язку атома з карбоксильною групою полегшує процеси декарбоксилювання:

Реакції отримання з гідроксикислот складних ефірів та галогенангідридів за своїм механізмом належать до реакцій нуклеофільного заміщення:
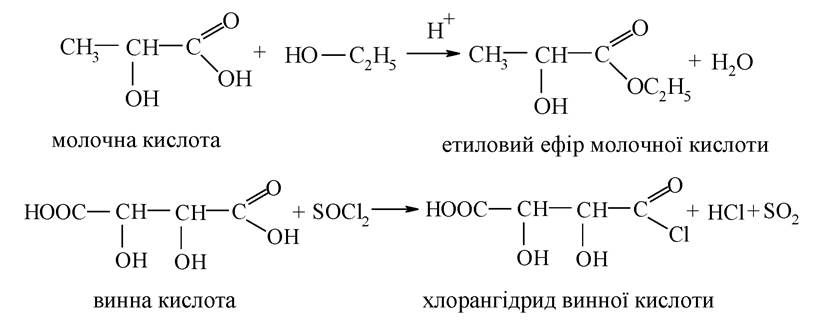
За гідроксильною групою для гідроксикислот характерні властивості спиртів - вони утворюють прості й складні ефіри, проявляють кислотність, взаємодіють з галогеноводневими сполуками, окиснюються до кетоно- або альдегідо-кислот. Реакції утворення простих і складних ефірів, заміщення гідроксилу на галоген, за механізмом належать до реакцій нуклеофільного заміщення:
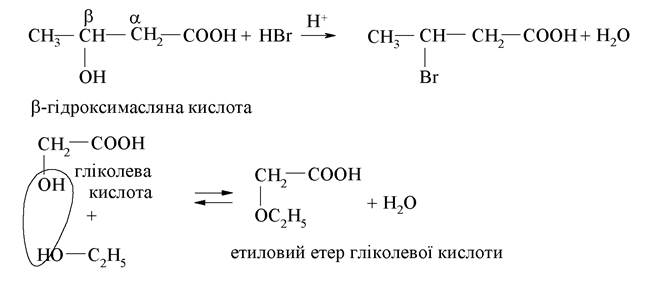
Окиснення гідроксикислот за спиртовою групою (-ОН) до кетона або альдегіду відбувається шляхом дегідрування. Одним з учасників біологічного дегідрування є кофермент НАД+, який слугує акцептором гідрид-іона, перетворюючись при цьому на відновлену форму коферменту НАДН:

Ця реакція проходить на одній із стадій циклу Кребса. Для гідроксикислот характерні специфічні реакції, обумовлені взаємним розташуванням функціональних груп.
α-Гідроксикислоти при нагріванні зазнають міжмолекулярної дегідратації. При цьому від двох молекул а-функціональної сполуки відщеплюються дві молекули води і утворюються шестичленні кисневмісні гетероцикли, які називаються лактидами і являють собою циклічні складні ефіри:

γ-Гідроксикислоти і кислоти з більш віддаленим розташуванням функціональних груп при нагріванні зазнають внутрішньомолекулярної дегідратації з утворенням п’ятичленного гетероциклу. При цьому утворюються внутрішні циклічні складні ефіри - лактони:
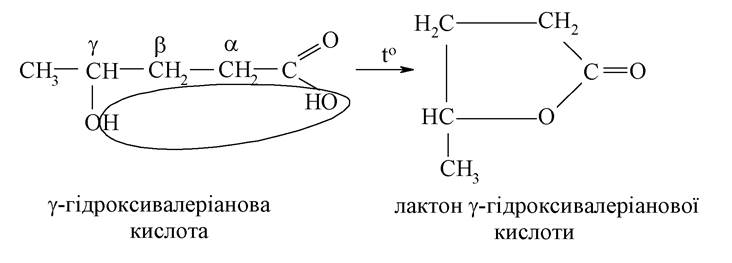
β-Гідроксикислоти при нагріванні внутрішньомолекулярно відщеплюють воду, при цьому утворюються ненасичені карбонові кислоти:
Ця реакція протікає на одній зі стадій циклу трикарбонових кислот, вона обумовлена підвищеною СН-кислотністю атома гідрогену метиленової групи, що знаходиться в α-положенні по відношенню до карбоксилу.
Таким чином, гідроксикислотам притаманні кислотні властивості й реакції нуклеофільного заміщення за обома функціональними групами, реакція декарбоксилювання характерна за карбоксильною групою, реакція окиснення - за гідроксильною групою.
Значна роль гідроксикислот у процесах метаболізму. Так, молочна кислота, що утворилася в процесі гліколізу, окиснюється в процесі дихання до піровиноградної кислоти і саме при повному окисненні цієї сполуки до СО2 і Н2О вивільняється головна маса енергії, сконцентрована у вуглеводах (~ 95 %), і забезпечує цією енергією організм, особливо м'язову систему.
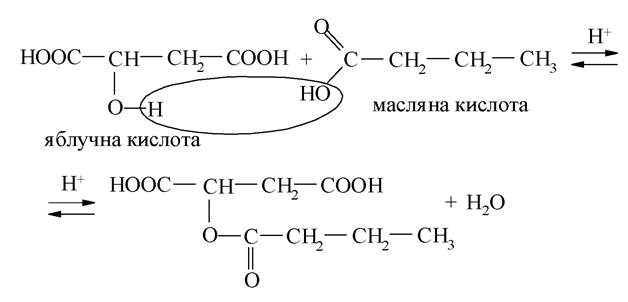
Гідроксикислоти (лимонна, ізолимонна, яблучна) беруть участь у перетвореннях циклу трикарбонових кислот - окиснення оцтової кислоти до СО2 і Н2О в процесі аеробної фази. У результаті цього процесу вивільняється головна маса енергії вуглеводів, ліпідів, білків. Однак значення циклу трикарбонових кислот не вичерпується тільки вирішальною роллю в забезпеченні організму енергією. При окисненні оцтової кислоти утворюються проміжні речовини, які використовуються для різних процесів біосинтезу.
1. Кетокислоти - це сполуки, що містять одночасно карбоксильну і кетонну групи. Їм притаманні властивості за карбоксильною групою такі самі, як і гідроксикислотам. Біологічна роль кетокислот в організмі дуже велика. Так, піровиноградна кислота (ПВК) є продуктом гліколізу. Завдяки наявності кетогрупи, для якої характерна реакція відновлення, ПВК реагує з відновленою формою НАД+ (НАДН+Н+) і перетворюється на кінцевий продукт гліколізу - молочну кислоту:
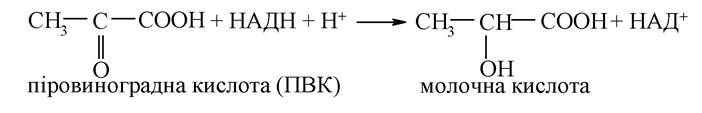
Піровиноградна кислота в умовах дихання підлягає окисному декарбоксилюванню (властивість притаманна групі -СООН) та перетворюється на активну форму оцтової кислоти - ацетилкофермент А:
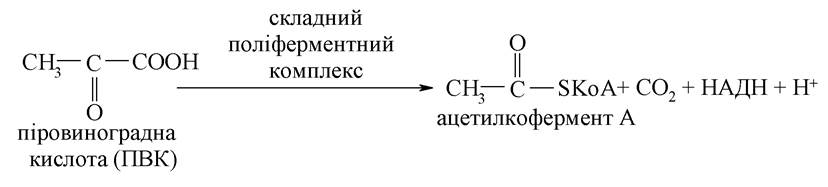
Продукт реакції включається в окиснювальний цикл трикарбонових кислот:
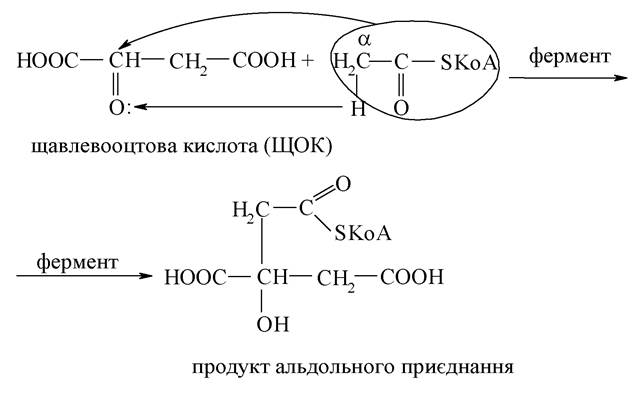
Альдольне приєднання характерне для кетонів за наявності СН-кислотності.
При гіпоксії (нестачі кисню) відбувається відновлення піровиноградної кислоти в молочну під дією (НАДН+Н+). Накопичення молочної кислоти може мати негативний вплив на організм, зокрема, послаблювати скорочення м'язів - виникає характерний біль. Під час відпочинку запаси кисню поновлюються, і молочна кислота окиснюється до ПВК.
α-Кетоглутарова в циклі трикарбонових кислот піддається окиснювальному декарбоксилюванню - утворюється янтарна кислота, яка піддається подальшим перетворенням. У результаті утворюється той субстрат, з якого розпочався цикл (ЩОК). α-Кетоглутарова кислота бере участь у різних процесах біосинтезу. Наприклад, вона може перетворюватися на глутамінову кислоту, яка використовується для біосинтезу білків.
З кетокислот - піровиноградної, щавелевооцтової і α-кетоглутарової можливе часткове утворення замінних амінокислот, тому що ці кетокислоти легко амінуються і переамінуються.
Оксокислоти здатні приєднувати аміни (амінокислоти), утворюючи іміни (основи Шиффа), що є проміжними продуктами в багатьох ферментативних процесах, зокрема, у процесах біосинтезу α-амінокислот.
Реакція отримання іміну протікає за механізмом нуклеофільного приєднання-відщеплення (властивість оксогрупи).
Таким чином, кетокислоти беруть участь як у процесах обміну енергії в організмі, так і в різних процесах біосинтезу.
В організмі в будь-якій клітині, тканині, органі одночасно протікають тисячі надзвичайно різноманітних хімічних процесів і реакцій (окиснення, гідратація, декарбоксилювання та ін.). Ці реакції складають ланки єдиного цілого, вони взаємозв'язані, спряжені. При цьому кожна з потікаючих реакцій, обумовлена будовою органічної сполуки, якою визначаються хімічні властивості цієї сполуки.
Як приклад розглянемо цикл трикарбонових кислот. Він складається з таких стадій:
1. Біосинтез лимонної кислоти з ЩОК і ацетилкоферменту А:
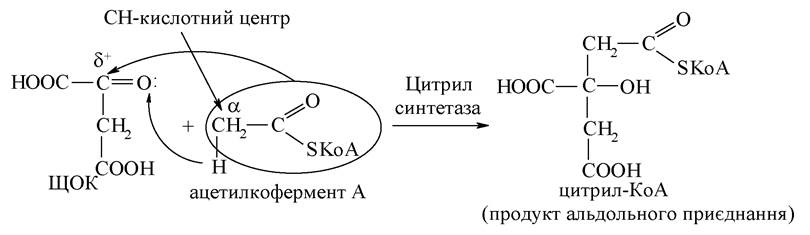
Ця реакція протікає на зразок альдольного приєднання, що характерно для кетонів (кетокислот) при взаємодії з тіоефіром карбонової кислоти. Отримана сполука піддається гідролізу за тіоефірним зв'язком:
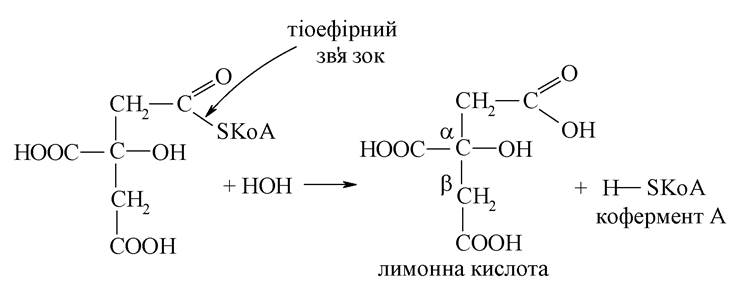
2. Утворення ізолимонної кислоти з лимонної.
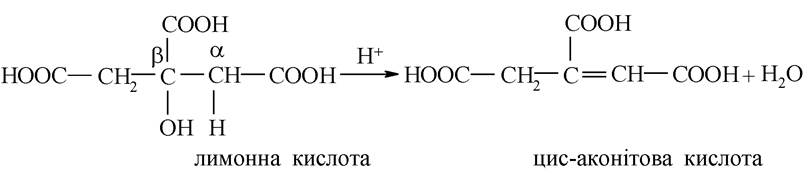
Лимонна кислота належать до Р-гідроксикислот, а ізолимонна - до a-гідроксикислот. Процес протікає ступінчато: спочатку утворюється ненасичена кислота, а з неї шляхом гідратації - ізолимонна. Утворення ненасиченої кислоти відбувається шляхом дегідратації лимонної кислоти на зразок Р-гідроксикислот (внутрішньомолекулярна дегідратація):

До цис-аконітової кислоти приєднується молекула води за механізмом електрофільного приєднання,і вона перетворюється на ізолимонну:

3. Утворення з ізолимонної кислоти а-кетоглутарової кислоти: а) ізолимонна кислота окислюється за типом одноатомних спиртів:
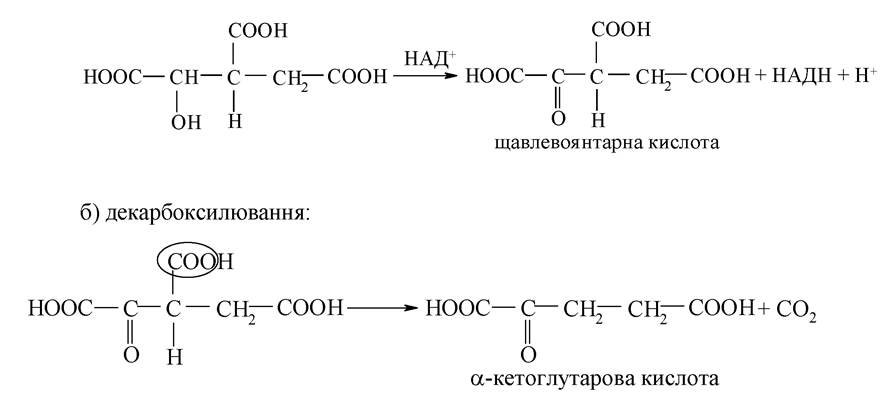
4. Утворення з α-кетоглутарової кислоти фумарової кислоти: а) окиснювальне декарбоксилювання а-кетоглутарової кислоти:
а) окиснювальне декарбоксилювання α-кетоглутарової кислоти:
б) дегідрування янтарної кислоти за типом реакції дегідрування алканів:
5. Утворення з фумарової кислоти ЩОК:
а) гідратація фумарової кислоти з утворенням яблучної кислоти:
б) окиснення яблучної кислоти до ЩОК:

Отже, у циклі трикарбонових кислот, який відіграє вирішальну роль у забезпеченні організму енергією, протікають прості реакції: альдольне приєднання, гідроліз, гідратація, окиснення за типом одноатомних спиртів, декарбоксилювання, дегідрування. Ці реакції характерні для кетонів, кислот, спиртів.
5. Важливим продуктом обміну є активна форма ацетооцтової кислоти, тобто ацетоацетил-КоА, який вступає в різні реакції обміну. Біосинтез вільної ацетооцтової кислоти відбувається складним шляхом у печінці з ацетоацетил- КоА і ацетил-КоА під впливом ферменту.
При тяжких формах діабету посилюється розщеплення жирів, а ресинтез знижується і у великих кількостях утворюється ацетил-КоА, за рахунок цього ацетооцтова кислота накопичується. Частина її декарбоксилюється, утворюючи ацетон, а також вона відновлюється до β-гідроксимасляної кислоти:
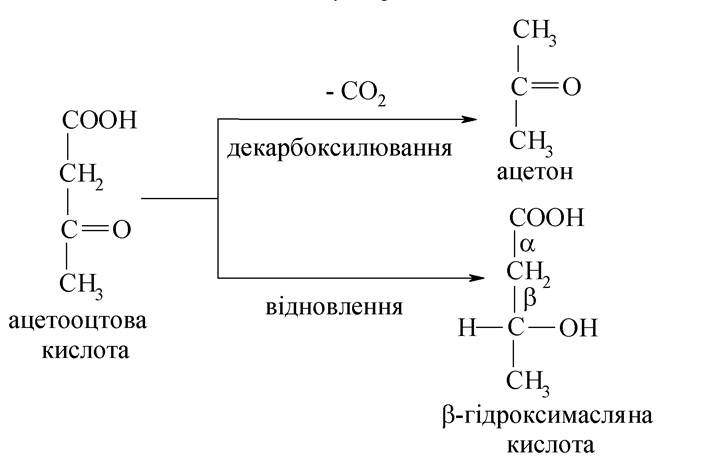
Усі ці три речовини, тобто ацетооцтова кислота, β-гідроксимасляна кислота й ацетон, об'єднують за назвою кетонових (ацетонових) тіл. Накопичення кислих продуктів призводить до зрушення рН крові та інших тканин у кислий бік, тобто до ацидозу, який викликає низку ускладнень в організмі. Тому вивчають здатність організму до нейтралізації кислих продуктів. З цією метою визначають резервну лужність, тобто здатність крові нейтралізувати кислоти.
6. В ацетооцтовій кислоті знаходяться дві функціональні групи (карбоксильна і кетогрупа), розташовані досить близько одна від одної і які чинять взаємний вплив.

Обидві функціональні групи електроноакцептори. У результаті, в αa-положенні з'являється СН-кислотний центр, на якому виникає дефіцит електронної густини, за рахунок цього α-карбоновий атом набуває протонної рухливості (СН-кислотність), що призводить до кето-енольної таутомерії:
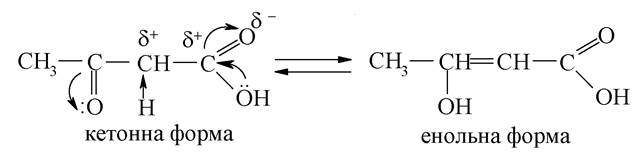
Кетонна форма існує в рівновазі з енольною формою, яка термодинамічно менш вигідна, ніж кетонна. Однак різниця в енергії може стабілізуватися за рахунок виникнення в молекулі спряження і внутрішньо-молекулярних водневих зв'язків. Така стабілізація має місце в енольній формі ацетооцтового естеру:

У кетонній формі ацетооцтовий естер вступає в типові реакції нуклеофільного приєднання:
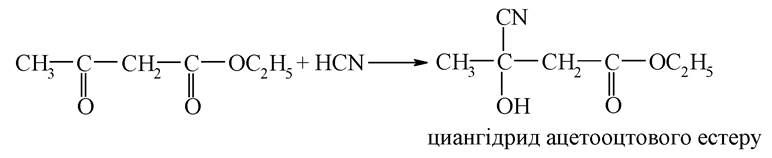
Наявність енольної форми підтверджується реакцією з хлоридом феруму (III), що слугує якісною пробою для виявлення енольного фрагмента - енол дає з FeCl3 характерне фіолетове забарвлення.
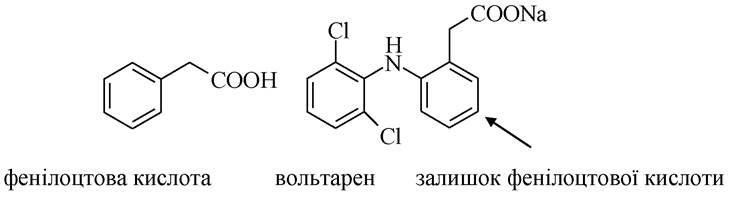
Бензойна кислота міститься в багатьох ягодах, плодах, травах. Вона здатна вступати в реакцію електрофільного заміщення. Карбоксильна група є замісником ІІ-го роду і тому орієнтує електрофіл в мета-положення:
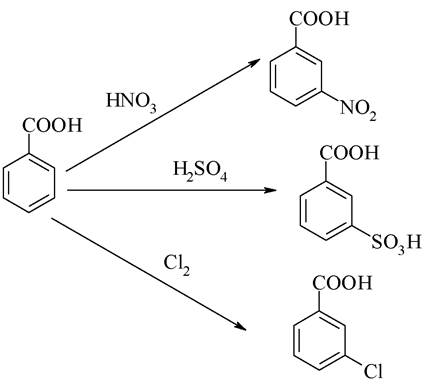
Бензойна кислота є одним з найстаріших медикаментів. Проявляє місцевоподразнювальну і антисептичну дію, застосовується як зовнішній протимікробний і фунгіцидний засіб. Застосовується всередину у вигляді солі натрію як відхаркувальний засіб. В організмі людини бензойна кислота є кінцевим продуктом окиснення жирних кислот з непарним числом атомів карбону. Бензойна кислота існує також у зв'язаному вигляді: наприклад, у сечі людини і травоїдних тварин вона знаходиться у вигляді гіпурової кислоти. Гіпурова кислота C6H5CONHCH2COOH складається із залишків бензойної та амінооцтової кислот, утворюється при дезінтоксикації ароматичних речовин.
При введенні в бензенове кільце різних хімічних груп (аміно-, нітро- та інших) утворюються заміщені ароматичні кислоти.
Відновлення о-нітробензойної кислоти спричиняє утворення про- амінобензойної або антранілової кислоти - найважливішої речовини для синтезу багатьох лікарських препаратів (фуросемід).
Введення в молекулу бензойної кислоти конструктивних фрагментів гліцину, піразолу, піридину дозволяє припустити, що ці похідні будуть проявляти протизапальну, аналгетичну дію, оскільки об'єднання в одній молекулі двох біологічно активних центрів за допомогою катіонно-аніонного зв'язку дає можливість посилити дію складових частин, підвищити розчинність. Деякі ароматичні кислоти містять карбоксильну групу в бічному ланцюзі (фенілоцтова кислота). І бензойна, і фенілоцтова кислоти є найважливішими продуктами метаболізму, входять до складу багатьох лікарських препаратів, наприклад, «золотим стандартом» при лікуванні запальних процесів є диклофенак натрію (вольтарен).
7. Саліцилова (о-гідроксибензойна) кислота - одна з трьох ізомерних гідроксибензойних кислот, які належать до групи фенолокислот. Вона значно більш сильна, ніж бензойна. Це пов’язано з утворенням внутрішньомолекулярного водневого зв’язку, який сприяє стабілізації карбоксилат-аніона і, отже, спричиняє зростання кислотності:

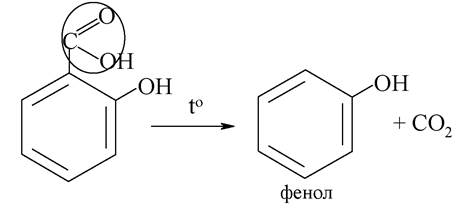
Подібно до інших а-оксикислот саліцилова кислота при нагріванні легко декарбоксилюється з утворенням фенолу:
Саліцилова кислота розчинна у воді. Вона дає фіолетове забарвлення з FeCl3, що свідчить про наявність вільного фенольного гідроксилу в саліциловій кислоті. Вона має знеболюючу, жарознижувальну, протизапальну дію. Саліциловій кислоті притаманні сильні місцевоподразнювальні властивості, тому вона застосовується тільки зовнішньо.
З хімічної точки зору похідні саліцилової кислоти (саліцилати) є в основному естерами, отриманими з використанням обох функціональних груп.
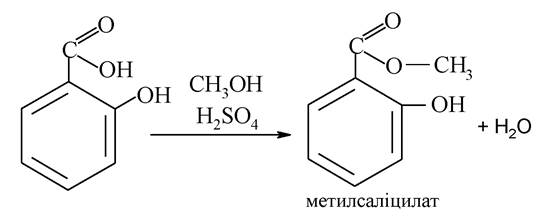
При нагріванні саліцилової кислоти з метиловим спиртом в присутності H2SO4 утворюється метилсаліцат, який являє собою безбарвну рідину з ароматним запахом, проявляє подразнювальну, анальгетичну і протизапальну дії. Застосовується для розтирань і компресів (з рослинною олією при суглобовому ревматизмі):
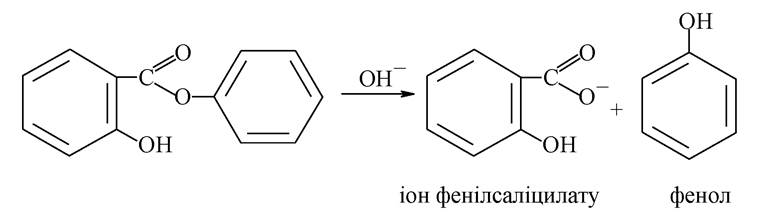
Фенілсаліцат (салол) є естером саліцилової кислоти і фенолу:

Фенілсаліцилат, проходячи через шлунок не змінюється, а в лужному середовищі кишковика омилюється з утворенням солі саліцилової кислоти й фенолу, які й визначають лікувальну дію:
Використовуючи здатність фенілсаліцилату не розчинятися в шлунку, його часто використовують як матеріал для покриття таблеток, щоб у разі необхідності вони не змінювалися в шлунку і виділили інгредієнти в кишківнику. Використовується салол як антисептичний засіб при кишкових захворюваннях.
За фенольними гідроксилами саліцилова кислота утворює складні ефіри з кислотами. Складний ефір саліцилової кислоти з оцтовою кислотою (аспірин) утворюється при взаємодії саліцилової кислоти з ангідридом або хлорангідридом оцтової кислоти:
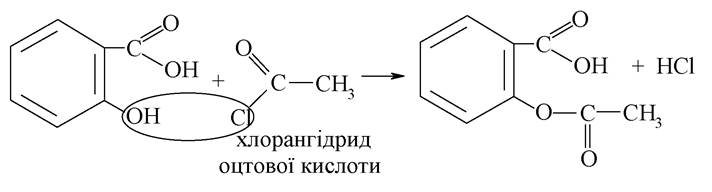
Препарат являє собою білий кристалічний порошок зі слабким запахом, слабокислого смаку, малорозчинний у воді. Має жарознижувальну, протизапальну дію, аналгетичну і антиагрегативну активність. Застосовується у вигляді порошків і таблеток. Часто комбінується з іншими анальгетиками (аскофен, цитрамон та ін.).
Виконайте завдання та перевірте правильність їх розв’язання за еталонами відповідей
Завдання № 1
1. Назвіть естер саліцилової кислоти з фенолом:
А. Фенацетин. В. Салол. С. Аспірин.
2. При нагріванні якої з наведених оксикислот утворюється лактид?
А. γ-оксикапронової. В. β-оксимасляної. С. α-оксивалер’янової.
3. Для якої з наведених кислот характерна реакція утворення естерів за обома функціональними групами?
А. Піровиноградної. В. Ацетооцтової. С. Гліколевої.
Еталони відповідей: 1-В; 2-С; 3-С.
Завдання № 2
1. Яка сполука утворюється при нагріванні β-гідроксимасляної кислоти?
А. Лактид. В. Лактон. С. Ненасичена кислота.
2. Яка з наведених кислот не утворює енантіомерів?
А. ЩОК. В. α-гідроксипропіонова. С. Яблучна.
3. Який реагент використовують для виявлення ацетону в сечі?
A. Розчин солі хлориду феруму (III).
B. Йод у присутності лугу.
C. Формальдегід, розчин NaOH, розчин CuSO4.
Еталони відповідей: 1-С; 2-А; 3-В. Завдання № 3
1. Яка з наведених кислот не має оптичної активності?
А. β-гідроксимасляна. В. Мезовинна. С. Ябучна.
2. За яким механізмом перебігає реакція взаємодії галогеноводню з гідроксикислотою?
A. Нуклеофільне приєднання.
B. Електрофільне заміщення.
C. Нуклеофільне заміщення.
3. Для якої з наведених кислот характерна реакція відновлення?
А. Ацетооцтова. В. Гліколева. С. β-гідроксимасляна.
Еталони відповідей: 1-В; 2-С; 3-А.