Основы биохимии - А. А. Анисимов 1986
Ферменты (энзимы)
Активный центр
В ходе ферментативных реакций осуществляется контакт между ферментом и субстратом, образуются промежуточные фермент- субстратные комплексы (ES). Та область ферментативной молекулы, в которой происходит связывание и превращение субстрата, называется активным центром (на его долю обычно приходится лишь небольшая часть молекулы). Активный центр образуется определенными боковыми радикалами аминокислотных остатков полипептидной цепи, а в двухкомпонентных ферментах в него входят и некоторые группировки небелковой части. У ферментов, имеющих четвертичную структуру, число активных центров, как правило, совпадает с числом субъединиц.
Активный центр функционально неоднороден, в нем условно выделяют несколько зон. Тс группировки активного центра, которые контактируют с подвергающимися превращению фрагментами молекул субстрата, т. е. принимают непосредственное участие в синтезе или расщеплении связи субстрата, входят в каталитическую вону. Группировки, контактирующие с непревращаемыми фрагментами субстрата, и укрепляющие его в активном центре, относятся к зоне связывания (рис. 3.1).
Связывание субстрата, как правило, многоточечное, оно осуществляется при участии нескольких группировок ферментативной молекулы и субстрата. В молекуле фермента существуют также остатки аминокислот, которые не имеют прямых контактов с субстратом, но способствуют катализу, фиксируя группировки каталитической зоны в активном состоянии.
Наиболее часто в состав активных центров входят такие аминокислоты, как сер, гис, тре, цис, глу, асп, арг. Аминокислоты, образующие активный центр, по длине полипептидной цепи находятся далеко друг от друга и оказываются сближенными при формировании пространственной структуры. Например, в активный центр химотрипсина входят гис — 57, асп — 102, сер — 195, всего фермент состоит из 246 аминокислотных остатков. Химотрипсин, как и некоторые другие, в основном секретируемые ферменты, образуется сначала в неактивной форме, в форме профермента (зимоген) — химотрипсиногена. Химотрипсиноген не имеет окончательно сформированного активного центра и не способен активно катализировать свойственные ферменту реакции. При активации химотрипсиногена под действием трипсина и химотрипсина гидролизуются четыре пептидные связи, в результате чего выщепляются дипептиды 14—15 и 147—148 (рис. 3.2), происходит окончательное формирование активного центра, сближение 57-й, 102-й и 195-й аминокислот, участвующих непосредственно в акте катализа (см. рис. 3.7).

Рис. 3.1. Активный центр фермента:
а — группировки каталитической зоны, б — группировки зоны связывания
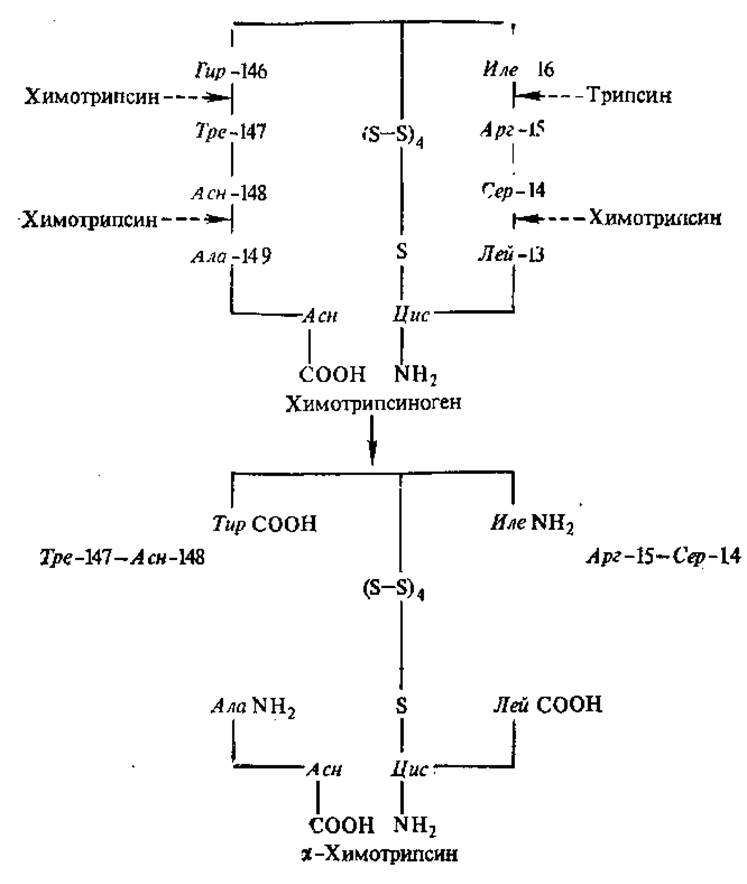
Рис. 3.2. Активация химотрипсиногена (одна полипептидная цепь).
Образующийся d-химотрипсин состоит из трех цепей, соединенных дисульфидными связями
Для многих ферментов сейчас известны аминокислоты, образующие активный центр, а также выполняемая ими функция в катализе Заключение о нахождении тех или иных аминокислотных остатков ферментативной молекулы в активном центре можно сделать изучая кинетику ферментативных реакций и применяя специфические реагенты на определенные группировки. Специфические реагенты подобраны для таких аминокислот, как три (N-бромсукцинимид), цис (органические производные ртути, например р-хлормеркурибензоат — ПХМБ, монойодуксусная кислота), сер (диизопропилфторфосфат - ДИФФ) и ряда других.
Сведения о функциональных группах активного центра позволяет получить и применение протеолитических ферментов, расщепляющих избирательно пептидные связи в ферментативной молекуле. Ценную информацию дает сравнение пространственных структур фермента в отсутствие и присутствии ингибиторов в совокупности с информацией о первичной структуре.
Активные центры ферментов расположены в углублениях на поверхности ферментативной молекулы (рис. 3.3). Например, у многих дегидрогеназ активные центры находятся во впадине между двумя доменами. Микросреда активного центра отличается от остального окружения фермента более низкой диэлектрической проницаемостью, приближающейся к таковой для некоторых органических растворителей. Среда с пониженной диэлектрической проницаемостью является более благоприятной по сравнению с водой для протекания реакций с переносом заряда, которые характерны для работы большого числа ферментов. Кроме указанной особенности, микросреда активного центра характеризуется повышенной микровязкостью, что ограничивает свободу вращательного движения группировок активного центра. Если фермент двухкомпонентен, то его активный центр достраивается после взаимодействия апофермента с небелковой частью. Показано, например, что пируват — субстрат фермента лактатдегидрогеназы не связывается ферментом до тех пор, пока не образуется комплекс между апоферментом и НАДН. Следовательно, пируватсвязывающий центр на поверхности фермента возникает после присоединения НАДИ вследствие изменения конформации, а возможно, и заряда в этом участке белковой молекулы.
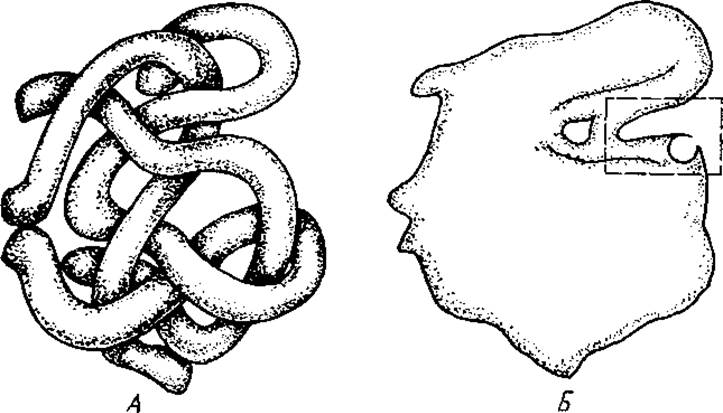
Рис. 3.3. Модель молекулы фермента. А — третичная структура молекулы; Б — силуэт молекулы с активным центром (в рамке)
Индивидуальные особенности строения активных центров различных ферментов обусловливают специфичность их действия. Специфичность ферментов может быть абсолютной и относительной. В случае абсолютной специфичности ферменты катализируют превращение только одного вещества, в случае относительной — небольшой группы близких по свойствам веществ. Примерами ферментов с абсолютной специфичностью являются уреаза, сукцинатдегидрогеназа (СДГ):
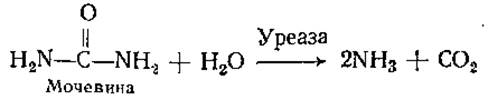
К ферментам с относительной специфичностью относятся эстеразы, расщепляющие обширный ряд эфиров карбоновых кислот; некоторые фосфатазы, действующие на эфиры фосфорной кислоты; пептидазы и протеиназы, гидролизующие пептиды и белки.
Относительная специфичность протеиназ выражается также и в том, что они расщепляют большое число различных белков. У ряда ферментов это сочетается со способностью гидролизовать только определенные пептидные связи в субстрате, что объясняется особенностями строения их активных центров. Так, различие в селективности действия трипсина, химотрипсина и эластазы обусловлено небольшими изменениями в строении того участка активного центра, куда попадает боковая цепь аминокислоты расщепляемого субстрата.
В химотрипсине этот участок («карман») приспособлен к связыванию больших гидрофобных радикалов (фен, тир, три), в трипсине — положительно заряженных группировок, так как на дне «кармана» активного центра фермента находится отрицательно заряженная СООН-группа асп — 189. В эластазе (гидролизует белки по ала) у входа в «карман» вместо двух гли, как в химотрипсине, находятся вал и тре, предотвращающие попадание туда больших боковых радикалов субстрата.
Подобным же образом объясняются различия в специфичности действия карбоксипептидаз А и В. Оба фермента гидролизуют белки с С-конца, первый отщепляет с наибольшей скоростью С-концевые ароматические аминокислоты (тир, три, фен), второй — преимущественно лиз и арг. Основное различие этих ферментов заключается в том, что связывающий остаток в «кармане» карбоксипептидазы А — иле — 255, а в В — асп — 255, что и определяет сродство к различным С-концевым аминокислотным остаткам.
Кроме химической специфичности некоторые ферменты обнаруживают и стерическую специфичность. Такие ферменты различают стереоизомеры и катализируют превращение только одного из них: D- или L-, а- или ß-, цис- или транс-. Например, существуют а- и ß-гликозидазы, гидролизующие только один из видов гликозидов. Фумарат-гидратаза действует лишь на фумарат (трансизомер) и не превращает малеинат (цис-изомер). При дегидратации малата (эта реакция протекает в цикле трикарбоновых кислот) образуется только фумарат:
