Основы биохимии - А. А. Анисимов 1986
Интеграция и регуляция метаболизма
Циклические нуклеотиды
Внеклеточные сигналы в форме первичные посредников — гормонов и нейромедиаторов, а также некоторых других биологически активных веществ при достижении клеток-мишеней вызывают образование вторичных посредников внутри клетки — циклических нуклеотидов (цАМФ и цГМФ). Увеличение или уменьшение концентрации последних в клетке приводит к различным изменениям в метаболизме в зависимости от типа клетки и ее состояния в данный момент. цАМФ был впервые выделен и идентифицирован в 1958 г. Е. Сатерлендом, получившим впоследствии за исследования свойств и функций этого соединения Нобелевскую премию. цАМФ образуется из АТФ при участии фермента адекилатциклазы:
![]()
Аденилатциклаза представляет собой компонент клеточной мембраны; состоит из трех субъединиц. Регуляторная субъединица находится на наружной стороне цитоплазматической мембраны и является составной частью гормонального рецептора или тесно связана с ним. На внутренней стороне мембраны расположена каталитическая субъединица, ответственная за превращение АТФ в 3', 5'-АМФ. В толще мембраны находится сопрягающая субъединица, через которую передается сигнал от рецептора к каталитической субъединице (см. рис. 12.1). Необходимыми компонентами сопрягающей субъединицы являются фосфолипиды; обработка фермента фосфолипазами вызывает потерю чувствительности к гормонам.
Каталитическая субъединица активна только при взаимодействии гормонов с рецепторной субъединицей. Активация аденилатциклазы, увеличение содержания цАМФ происходит под действием
катехоламинов (адреналин, норадреналин), представляющих собой одновременно и гормоны, и нейромедиаторы, многих других гормонов (АКТГ, глюкагон, паратиреоидный гормон, вазопрессин и др.) и ряда биологически активных веществ: простагландини E1и Е2, гистамин, холерный токсин и т. д. Кофакторами аденилатциклазы являются Mg2+и ГТФ.
Гуанилатциклаза в отличие от предыдущего фермента непрочно связана с цитоплазматической мембраной. Реакция образования цГМФ активируется Mg2+, Са2+ усиливает эту активацию:
![]()
Гуанилатциклаза отличается от аденилатциклазы, кроме того, нечувствительностью к большинству гормонов. Исключение составляют некоторые стероидные гормоны, например эстрогены. Другие стимуляторы аденилатциклазы тоже не действуют на гуанилатциклазу. Этот фермент активируется ацетилхолином (в присутствии Са2+), простагландинами F2а. Содержание цГМФ увеличивается и под влиянием фитогемагглютинина (см. разд. 2.5.3). Действие инсулина на ткани также сопровождается увеличением количества внутриклеточного цГМФ, через который, видимо, инсулин как-то опосредует свое действие. Однако внутренние механизмы этого явления, причины указанных корреляций еще недостаточно ясны.
Фосфодиэстераза 3', 5'-АМФ и фосфодиэстераза 3', 5'-ГМФ катализируют гидролитическое расщепление циклических нуклеотидов с образованием нециклических 3'-нуклеозидмонофосфатов:
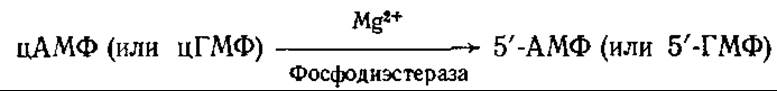
Регуляторная функция циклических нуклеотидов осуществляется через активацию соответствующих протеинкиназ. Они состоят из двух субъединиц: каталитической и рецепторной (или регуляторной), содержащей аллостерический участок связывания цАМФ. В отсутствие цАМФ обе субъединицы образуют малоактивный комплекс, при связывании цАМФ происходит его диссоциация и каталитическая субъединица приобретает максимальную активность.
Белки, фосфорилируемые цАМФ-зависимыми протеинкиназами, очень разнообразны, содержатся во всех компонентах клетки: белки хроматина (гистоновые, негистоновые), рибосомальные и мембранные белки, многие ферменты и др. Однако существуют механизмы, определяющие специфичность фосфорилирования строго определенных белков в каждой ситуации. Такая направленность обеспечивается особенностями дифференцировки клетки, характером внешнего сигнала и функциональным состоянием клетки.
Доступность того или иного белка для протеинкиназы зависит от его конформации, на которую оказывают влияние состав и концентрация ионов, присутствие различных регуляторов и т. д. цГМФ-зависимые протеинкиназы тоже состоят из каталитической и регуляторной субъединицы. Наличие этих протеинкиназ в клетке дает основание предполагать, что цГМФ является самостоятельным внутриклеточным посредником, независимым от цАМФ. В связи с этим для физиологических и биологических процессов большое значение имеет не концентрация какого-то одного из циклических нуклеотидов, а соотношение их концентраций. Фосфорилирование белков протеинкиназами, как правило, активирует эти белки (например, ферментативные) или вызывает другой биохимический эффект: активацию генов, изменение проницаемости мембран и др. Фосфорилированные белки могут достаточно быстро дефосфорили- роваться гидролитически, с участием фосфопротеинфосфатаз, которые таким путем снимают активирующее действие протеинкиназ.
цАМФ и цГМФ рассматривают как самостоятельно функционирующие регуляторы клеточного метаболизма, однако между ними во многих случаях имеются антагонистические и реципрокные отношения: 1) цГМФ (как и адреналин) стимулирует сердечные сокращения, цГМФ (как и ацетилхолин) — тормозит; 2) цАМФ (как и адреналин) угнетает сокращение гладкой мускулатуры (кишечника, матки, сосудов), цГМФ (или ацетилхолин) — активирует; 3) цАМФ тормозит пролиферацию клеток, а цГМФ — стимулирует ее; 4) цГМФ, подобно ацетилхолину, способствует деполяризации постганглионарных нейронов, тогда как цАМФ вызывает их гиперполяризацию.
Наряду с этим известны и случаи однонаправленного действия цАМФ и цГМФ: 1) секреция амилазы поджелудочной железой примерно одинаково стимулируется цАМФ и цГМФ; 2) в границах определенных концентраций оба нуклеотида стимулируют гликогенолиз.
Из биохимических и физиологических эффектов, вызываемых цАМФ, кроме перечисленных заслуживают также внимания: 1) активация липолиза, фосфоролиза гликогена; 2) стимуляция секреции инсулина, простагландинов, кальцитонина, соляной кислоты в желудке; 3) действие на белковый синтез (см. разд. 5.4); 4) ингибирование роста клеток; 5) ингибирование агрегации эритроцитов.
цАМФ легко диффундирует из клеток в различные жидкости организма — кровь, церебральную жидкость, желудочный сок и принимает участие в осуществлении разнообразных процессов жизнедеятельности: увеличивает проницаемость мембран, участвует в кортикостероидогенезе, в выработке приспособительных реакций, в обмене всех классов веществ, в нервно-мышечной трансмиссии возбуждения, в осуществлении функций ЦНС. Считают, что реализация столь разнонаправленных эффектов аденилатциклазной системы возможна вследствие образования посредников (мессенджеров) 3-го порядка — разнообразных веществ с биологической активностью.
В последние годы накапливается все больше сведений о важной роли Са2+ в регуляции клеточного метаболизма в связи с действием циклических нуклеотидов, гормонов и нейромедиаторов.
Высказывают предположения (М. А. Федоров, 1979), что Са2+ является основным и более древним внутриклеточным посредником действия различных факторов на клетку, роль цАМФ часто заключается главным образом в стимуляции притока Са2+ извне и из митохондрий. Концентрация Са2+ в клетке под влиянием внешних стимулов может быстро и значительно меняться (от 10-5 до 10-8М). Вполне вероятно, что систему внутриклеточной регуляции (по крайней мере, для ряда случаев) можно представлять как цепь из трех мессенджеров: гормоны→ациклические нуклеотиды→Са2+.
Циклические нуклеотиды найдены у многих видов животных, в бактериях и ряде одноклеточных организмов. У прокариот цАМФ играет существенную роль в регуляции биосинтеза белков (см. разд. 5.4). У некоторых миксомицетов (слизевики) цАМФ служит своеобразным гормоном, межклеточным химическим сигнализатором. Он может образовываться в начальной фазе развития миксомицетов, если истощаются запасы пищи. Отдельные миксомицеты движутся в сторону исходного источника цАМФ, агрегируются, формируют плодовые тела, образуют споры.
Наличие циклических нуклеотидов у высших растений достоверно не доказано. Однако обнаружение некоторыми авторами аде- нилатциклазной активности и цАМФ-зависимых протеинкиназ у высших растений заставляет воздерживаться от категоричности в этом вопросе.