Основы биохимии - А. А. Анисимов 1986
Белки
Физико-химические свойства белков
2.3.1. Выделение и очистка белков. Первым этапом выделения и очистки белков является извлечение их из клеток. Для этого клетки разрушают, т. е. превращают в гомогенат (разрушают клеточные оболочки, наружные мембраны, цитоплазматические структуры). Существуют различные методы гомогенизации клеток и тканей, и выбор того или иного метода определяется свойствами, составом, прочностью исходного объекта. Большинство животных клеток разрушается сравнительно легко, однако при работе с растительными и бактериальными клетками встречаются значительные трудности, обусловленные наличием клеточных оболочек.
Довольно простым и доступным методом разрушения является гомогенизация путем растирания клеток и тканей с твердым материалом — абразивом (например, кварцевый песок) в ступкe c пестиком в присутствии среды суспендирования. Недостаток метода заключается в том, что при этом может нарушаться структура наиболее крупных органелл, например хлоропластов.
Для разрушения животных клеток часто используют гомогенизаторы с вращающимися лопастями или пестиком, обычно выполненным из инертного материала — тефлона. С целью дезинтеграции микробных клеток применяют механичecкое встряхивание суспензии клеток с мелкими стеклянными бусинками диаметром от 50 до 500 мкм. Встряхивание с частотой 300—3000 колебаний/мин разрушает клетки, однако возникающая сильная вибрация может иногда вызывать и разрушение клеточных органелл. Гомогенизация микробных клеток может быть достигнута с помощью высокого давления при применении специальных прессов. При этом суспензию клеток помещают в камеру, создают избыточное давление (до 1⋅108 Па), затем его снижают. Резкий перепад давления приводит к тому, что клетки разрушаются. Клетки можно гомогенизировать также путем продавливания их через мелкие отверстия.
Широко используют для разрушения клеток специальные приборы — ультразвуковые дезинтеграторы. Однако, поскольку ультразвук — денатурирующий белки агент, следует очень тщательно подбирать режим работы прибора, чтобы избежать инактивации белков. Существуют также методы разрушения клеток с помощью осмотического шока, попеременного замораживания и оттаивания, обработки органическими растворителями (охлажденный ацетон, толуол), автолиза. Для удаления оболочек растительных и бактериальных клеток могут быть применены ферментативные препараты — лизоцим, комплекс целлюлолитических ферментов, хитиназа.
На всех этапах выделения и очистки белков следует учитывать их большую неустойчивость, лабильность, склонность к потере природных, нативных свойств, т. е. к денатурации. Белки очень чувствительны к действию многих химических реагентов (в том числе кислот, щелочей, органических растворителей), денатурируют при нагревании. Они адсорбируются многими веществами (например, фарфором ступок), что приводит к потере белка. Возможен автолиз белков (самопереваривание), разрушение их микроорганизмами, попавшими в раствор из воздуха или воды.
В большинстве случаев процесс разрушения клеток сопровождается выделением тепла, поэтому все процедуры по дезинтеграции клеток и выделению клеточных органелл с целью предотвращения тепловой денатурации следует проводить при пониженных температурах (около +4°С) в термостатированных холодных комнатах. Важно также поддержание постоянства активной реакции среды в определенном интервале, с этой целью среду суспендирования готовят на буферных растворах. Чтобы устранить воздействие ионов тяжелых металлов, которые могут попасть с водой и реактивами при гомогенизации, используют комплексообразователи — ЭДТА (этилендиаминтетраацетат), его натриевую соль — трилон Б и др.

Для предотвращения окисления сульфгидрильных групп в белках в среду выделения добавляют восстановители, например цистеин, ß-меркаптоэтанол, дитиотреитол и некоторые другие.

Белки могут терять биологическую активность вследствие поверхностной денатурации, что происходит при сильном вспенивании реагирующей массы. Образования пены избегают добавлением нейтральных поверхностно-активных веществ (ПАВ).
Известно, что многие белки локализованы в клеточных органеллах. Для их выделения гомогенат, полученный после разрушения клеток, подвергают центрифугированию. В зависимости от величины центробежного ускорения в осадке получают те или иные органеллы, с которыми затем проводят работу по выделению белка. Методом центрифугирования можно также отделить твердые частицы-обломки клеточных структур. Надосадочная жидкость (экстракт) представляет собой водный раствор различных органических и неорганических соединений — компонентов клетки и среды солюбилизации (растворения).
Многие белки в клетке находятся в ассоциированном состоянии с другими веществами или клеточными структурами, для их лучшей солюбилизации применяют слабые растворы детергентов (вещества с поверхностной активностью) или неполярных растворителей (эфир, бутанол и др.).
Неионные детергенты, такие, как дезоксихолат натрия, тритон X-100, широко применяющиеся для солюбилизации мембранных белков, ослабляют гидрофобные белково-липидные и белок-белковые взаимодействия, в результате чего белки высвобождаются из мембран. Анионные и катионные детергенты дестабилизируют также и ионные связи между заряженными группами компонентов мембран. Примером анионного детергента, использующегося для выделения белков мембран, является додецилсульфат натрия (ДСН, SDS).

После гомогенизации материала производится экстрагирование из него белков. В качестве растворителей в зависимости от свойств выделяемого белка и целей исследований применяют воду, солевые растворы, разнообразные буферные смеси, органические реагенты, водно-спиртовые растворы, слабые кислоты или щелочи. Очень часто экстракцию белков осуществляют в процессе гомогенизации материала.
В результате экстракции получают смесь белков и других веществ. Для выделения индивидуальных белков применяют различные методы очистки. Набор и последовательность использования этих методов подбирают экспериментально в каждом конкретном случае в зависимости прежде всего от физико-химических свойств выделяемого белка. Разделение на фракции может быть достигнуто за счет использования различий в растворимости белков при разных концентрациях нейтральных солей (высаливание), органических растворителей (этанол, серный эфир, ацетон, диоксан и некоторые другие), разных значениях pH, t° (см. разд. 2.3.4).
Высоленные белки содержат большое количество солей, для освобождения от них полученный при центрифугировании белковый осадок подвергают диализу против буферного раствора или гель-фильтрации на колонках с молекулярными ситами. Обессоливание с помощью молекулярных сит протекает во много раз быстрее.
Эффективным способом очистки белков является их фракционирование с применением хроматографических методов. Хроматографическим методом называют физико-химический метод разделения веществ, основанный на распределении компонентов смеси между двумя фазами, одна из которых неподвижная, а другая — поток, фильтрующийся через слой неподвижной фазы. Подвижной фазой чаще всего бывает жидкость (жидкостная хроматография) или газ (газовая хроматография). В зависимости от свойств, которыми обладает неподвижная фаза, различают несколько видов хроматографии. Ниже приведена характеристика хроматографических методов.
Принципы разделения |
Вид хроматографии |
Физическая сорбция веществ |
Адсорбционная |
Разделение веществ между двумя жидкими несмешивающимися фазами |
Распределительная |
Ионные взаимодействия между растворенными веществами и носителем |
Ионообменная |
Неодинаковая доступность внутреннего растворителя пористой структуры молекулам разделяемых веществ |
Молекулярно-ситовая (гель-проникающая) |
Избирательное взаимодействие со специфическими лигандами, закрепленными на носителе |
Аффинная (по сродству), биоспецифическая адсорбционная хроматография (БАХ) |
В белковой химии широкое применение нашли три последних вида хроматографии. При ионообменной хроматографии (ИОХ) разделение белков происходит вследствие их взаимодействия с противоположно заряженными частицами ионообменных смол (иониты) — твердых нерастворимых веществ, которыми после соответствующей обработки заполняется колонка.
Иониты содержат активные (ионогенные) группы с подвижными ионами, способными при определенных условиях обмениваться на ионы анализируемой смеси. Иониты, содержащие активные кислотные группы и способные к обмену подвижные катионы, называются катионитами. Анионитами называются иониты, содержащие активные группы основного характера и подвижные анионы.
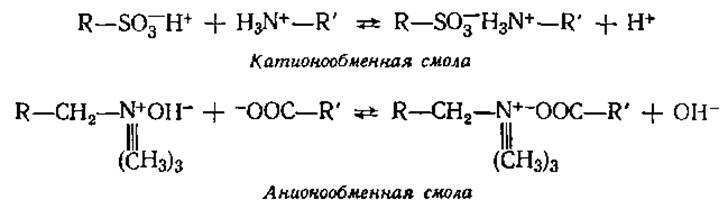
где R'—+NH3 и R'—СОО- — белок, — SO-3 —СН2—N+≡ (СН3)3 — функциональные (сульфо- и триметиламинометил-) группы, Н+ и ОН- — подвижные ионы, R — основа (матрица).
Применение гель-проникающей хроматографии (гель-фильтрация) позволяет разделять белки в соответствии с размерами их молекул. С этой целью используют различные пористые нерастворимые материалы — синтетические смолы, пористое стекло (био-глас), пористый кварц (порасил), производные полисахаридов на основе декстрана (сефадекс, молселект), агарозы (сефароза), синтетического полимера полиакриламида (биогель Р) и др.
Пористые материалы выпускают в виде гранул определенного размера, при суспендировании их в растворителе образуется две его фазы: одна внутри гранул, другая — вне. Суспендированными гранулами наполняют колонку, наносят смесь белков и пропускают растворитель. В зависимости от размера и формы белковых молекул они по-разному распределяются между обеими фазами: более крупные и асимметричные молекулы реже проникают или совсем не проникают (в зависимости от размера пор носителя) во внутреннюю фазу растворителя. Молекулы, для которых недоступен внутренний растворитель, остаются во внешней фазе и продвигаются по колонке с гораздо большей скоростью, чем мелкие молекулы. Белки с относительно небольшим размером молекул (менее диаметра пор) или низкомолекулярные соединения — соли, сахара, аминокислоты и др. — обязательно попадают в поры гранул и медленнее выходят с колонки, так как находятся в состоянии диффузионного равновесия с внутренним растворителем (рис. 2.3). Пористые материалы работают как молекулярное сито, точнее, как антисито, так как крупные молекулы проходят через них быстрее.
В качестве молекулярного сита наиболее часто используют сефадекс — производное синтетического полисахарида декстрана. В результате химической обработки в декстране образуются поперечные сшивки, и он становится нерастворимым в воде, но легко в ней набухает, образуя гель. Существует несколько марок сефадексов, различающихся по диаметру пор внутри гранул (табл. 2.2).

Рис. 2.3. Схема обессоливания белкового раствора с помощью сефадекса:
I, II, III — стадии фильтрования; 1 — гранулы сефадекса, 2 — молекулы белка, 3 — неорганические соли
Таблица 2.2. Типы сефадексов
Тип |
Область разделения по молекулярной массе (М), дальтон |
Поглощение воды, г/г сефадекса |
G - 25 |
1 000—5 000 |
2,5 |
G - 50 |
1 500—30000 |
5,0 |
G - 75 |
3 000—80000 |
7,5 |
G - 100 |
4 000—150 000 |
10,0 |
G - 150 |
5000—300000 |
15,0 |
G - 200 |
5 000—600 000 |
20,0 |
Аффинная хроматография основана на биоспедифическом взаимодействии выделяемого биополимера или группы биополимеров с определенным веществом. Этот вид хроматографии применим к ферментам, иммуноглобулинам, лектинам, рецепторным белкам, которые способны избирательно связываться с субстратами, ингибиторами, кофакторами, антигенами, рецепторами. Принцип этого метода хроматографии заключается в том, что на нерастворимом носителе закрепляют вещество, способное специфически связываться с выделяемым белком. Это вещество называют лигандом. Обработанный таким образом носитель (адсорбент) помещают в колонку и через нее пропускают смесь белков. С адсорбентом связывается только тот белок, который имеет сродство к специфическому лиганду (рис. 2.4). Затем белок снимают с колонки раствором, вызывающим диссоциацию образовавшегося комплекса между белком и лигандом.
Для разделения белков широко используют электрофоретические методы, основанные на движении заряженных молекул белков в электрическом поле со скоростью, зависящей от величины их зарядов при данном pH и ионной силе раствора. На скорость перемещения оказывают влияние также форма и масса белковых молекул, но в меньшей степени, чем их суммарный заряд.
Электрофоретическое разделение можно проводить в растворе или на твердых влажных носителях — в геле из крахмала, полиакриламида, силикагеле, на хроматографической бумаге. Высокой разрешающей способностью и чувствительностью характеризуется электрофорез в полиакриламидном геле (ПААГ), имеющем стандартный размер пор, определяемый концентрацией исходных мономеров, взятых для полимеризации геля. Поэтому в данном методе разделение веществ происходит и по величине заряда, и по размеру молекул.
К электрофоретическим методам относятся также изотахофорез и изоэлектрофокусирование (ИЭФ). При изотахофорезе (от греч. изос — равный, одинаковый, тахос — скорость) заряженные ионы сначала разделяются в соответствии с величинами их заряда и подвижности, а затем перемещаются в электрическом поле с одинаковыми и постоянными в данном опыте скоростями.
Метод изоэлектрофокусирования позволяет разделять белки одновременно как в градиенте напряжения, так и pH. Градиент pH поддерживают, добавляя в колонку смесь амфолитов-носителей (фирменные названия амфолины и сервалиты) — синтетических веществ, обладающих амфотерными свойствами и отличающихся друг от друга по величине ИЭТ. Амфолины, в частности, являются полиаминополикарбоновыми кислотами с молекулярной массой от 300 до 1000, их синтезируют на основе полиэтиленполиаминов. Под действием электрического поля амфолиты-носители распределяются по высоте колонки в строго определенной последовательности и создают линейный градиент pH. Диапазон градиента зависит от состава смеси амфолинов или сервалитов, величин их ИЭТ. Крутой градиент pH создается смесью амфолитов с широким интервалом ИЭТ, пологий — смесью с более узким спектром изоточек амфолитов (рис. 2.5). В последнем случае достигается более высокая разрешающая способность метода — разделению могут подвергнуться белки, отличающиеся по величине ИЭТ на 0,01 значения pH и меньше.

Рис, 2.4. Схема метода аффинной хроматографии:
1 — носитель (матрица), 2 — «ножка», 3 — лиганд, 4 — белок
Исследуемые белки, внесенные в колонку, перемещаются в ней под действием приложенного электрического поля
(рис. 2.6). Молекулы белка в той области, где pH выше его ИЭТ, заряжены отрицательно и перемещаются сверху вниз (к аноду). Напротив, молекулы белка в области с pH ниже его ИЭТ мигрируют снизу вверх. В итоге каждый вид белка оказывается сконцентрированным в зоне с pH, равным его ИЭТ. Здесь белок фокусируется, так как на молекулы, потерявшие заряд, электрическое поле перестает действовать.
Применение перечисленных методов извлечения и очистки белков позволяет выделять индивидуальные белки, имеющие высокую степень чистоты. Хорошо очищенные белки в отдельных случаях удается получить в кристаллическом виде. Белки выкристаллизовывают из растворов солей, органических растворителей. Перекристаллизация белков повышает степень их чистоты.
Выделенные препараты белка должны быть проверены на гомогенность. Прямых методов оценки чистоты белков не существует, гомогенность образца оценивают по отсутствию примесей. Вещество считают чистым, если ни один из методов определения гомогенности не выявит наличие примесей. С этой целью применяют обязательно несколько методов, основанных на разных принципах. Гомогенность образца по молекулярной массе устанавливают ультрацентрифугированием, по величине заряда — электрофорезом в ПААГ, ИЭФ. Чистое вещество дает только один симметричный пик при ультрацентрифугировании. Асимметричность пика, а также наличие плеча в пике или нескольких пиков свидетельствует о гетерогенности исследуемого белкового раствора. При электрофоретических методах оценки гомогенности после разделения также должна получаться только одна белковая зона. Кроме того, используют критерий функциональной гомогенности — определение специфической активности белков. Существует и биологический метод установления чистоты белковых препаратов, основанный на том, что большинство белков обладает свойствами антигенов, т. е. способностью вызывать у животного после введения появление специфических антител. Инъекция гомогенного вещества вызывает образование антител одного вида, а гетерогенного — нескольких видов.

Рис. 2.5. Границы pH смесей амфолитов-носителей
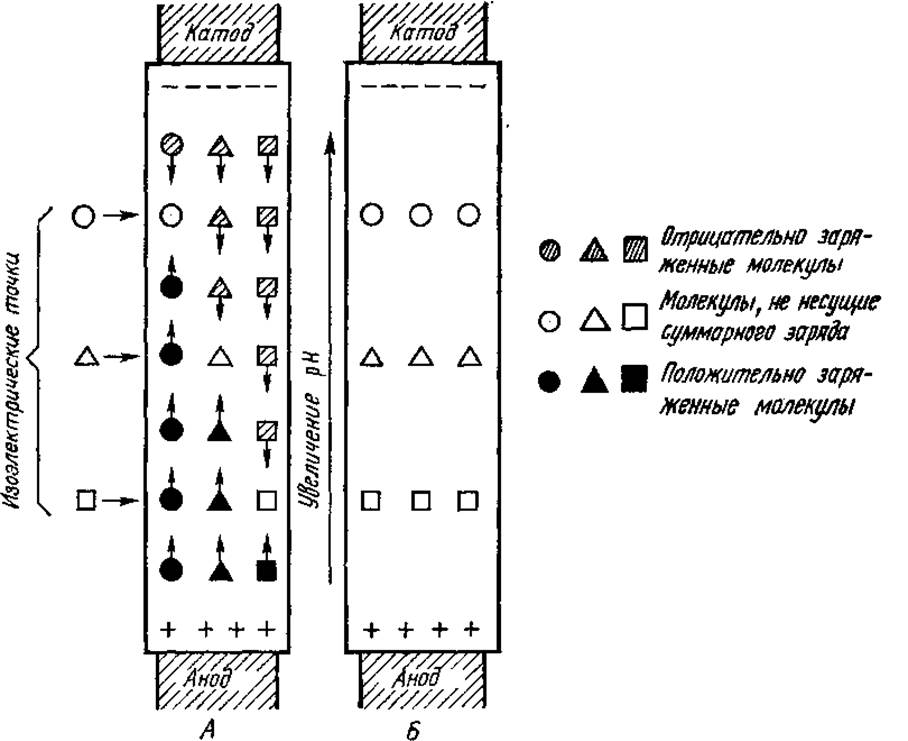
Рис. 2.6. Процесс миграции молекул белков при изоэлектрическом фокусировании. А — начало процесса; Б — окончание
Выделенный и очищенный белок должен храниться при пониженной температуре. Если белок кристаллизуется из раствора сульфата аммония, его можно хранить в этом растворе в виде суспензии. Чаще всего белки хранят в высушенном состоянии; сушку производят под высоким вакуумом из замороженного состояния (лиофилизация).
2.3.2. Молекулярная масса белков и методы ее определения.
Молекулярная масса белков может быть определена различными физическими методами, из которых наиболее часто используют гравитационный, гельфильтрационный и электрофоретический. Современные методы позволяют определять молекулярные массы с погрешностью, не превышающей 5%, что составляет несколько тысяч, а иногда и сотен дальтон. Выяснение первичной структуры многих индивидуальных белков дало возможность рассчитать их молекулярную массу с высокой точностью.
При гравитационном методе для определения молекулярной массы используют аналитические ультрацентрифуги, которые позволяют наблюдать процесс седиментации (оседание) частиц. В современных ультрацентрифугах развивается центробежное ускорение, превышающее ускорение силы тяжести до 500 000 раз. Определение молекулярной массы белка методом ультрацентрифугирования ведут по скорости седиментации белковых молекул и по седиментационному равновесию.
При определении молекулярной массы по скорости седиментации исследуемые белковые растворы центрифугируют при больших скоростях. Это приводит к тому, что равномерно распределенные по всему объему частицы белка в начале центрифугирования постепенно перемещаются ко дну ячейки. Между областями растворителя, свободной от белковых молекул и содержащей их, образуется граница раздела. Регистрируя перемещение этой группы в процессе центрифугирования, определяют скорость седиментации молекул, на основании чего рассчитывают молекулярную массу белка по уравнению Сведберга.
В методе седиментационного равновесия центрифугирование проводят при относительно небольших скоростях вращения ~7— 8 тыс. об/мин, что соответствует центробежному ускорению 40— 50 тыс. g. При таком ускорении даже частицы с большой молекулярной массой не оседают на дно. Центрифугирование продолжают до тех пор, пока не будет достигнуто равновесное распределение изучаемого белка по всей длине ячейки, при котором движение белка ко дну ячейки под действием центробежной силы уравновешивается движением вверх, обусловленным диффузией. По образовавшемуся градиенту концентрации белка в центрифужной ячейке рассчитывают молекулярную массу белка по специальной формуле.
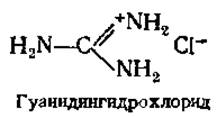
Установление молекулярной массы белков гель-фильтрацией проводят при заполнении пористым гелем (сефадекс, сефароза и др.) колонки или нанесении его тонким слоем на твердую подложку (тонкослойная хроматография). При колоночном варианте фиксируют объем элюирования (Vе) исследуемого белка и белков с известной молекулярной массой, затем строят калибровочный график зависимости lgM от Ve/Vo и по нему определяют молекулярную массу изучаемого белка. Vo (внешний объем) — объем растворителя между гранулами, определяется как объем, необходимый для элюирования соединения, которое не проникает в поры гранул. Значения молекулярных масс большинства белков укладываются на калибровочную прямую, исключение составляют лишь белки с ярко выраженной асимметричной формой молекул. Этим методом устанавливают и молекулярные массы субъединиц белков, имеющих четвертичную структуру (см. разд. 2.4.7). В этом случае используют 6М гуанидингидрохлорид, вызывающий диссоциацию белка на субъединицы и потерю нативной конформации, что позволяет избежать влияния формы молекулы.
При тонкослойной хроматографии на пористых гелях определяют путь, пройденный белком за определенное время, и рассчитывают молекулярную массу, используя калибровочный график, построенный в координатах lgM от х (пройденное белком расстояние) с использованием стандартных белков.
При электрофоретическом методе определения молекулярной массы белка в ПААГ также сравнивают подвижность исследуемого белка с подвижностью белков-маркеров. Графическая зависимость подвижности белка от логарифма его молекулярной массы выражается прямой линией. Чтобы избежать влияния формы молекул и их заряда на электрофоретическое разделение белков, а также установить молекулярную массу отдельных субъединиц в молекуле с четвертичной структурой, предварительно проводят денатурацию белков с помощью додецилсульфата натрия (ДСН). С 1 г белка связывается примерно 1,4 г ДСН, при этом гидрофобные группы ДСН располагаются внутри образующегося комплекса, а сульфокислотные — на поверхности. Последние обеспечивают суммарный отрицательный заряд комплекса, зависящий только от массы белка, и при электроферезе в гелях с однородной пористостью комплексы мигрируют со скоростью, обратно пропорциональной молекулярной массе белка. Электрофорез в присутствии ДСН широко применяют при изучении сложных смесей мембранных белков, определении их молекулярной массы, поскольку многие мембранные белки плохо растворимы в отсутствие ДСН.
Каждый из указанных выше методов определения молекулярной массы имеет свои недостатки, поэтому точный результат может быть получен при сочетании различных методов.
Использование перечисленных методов позволило установить, что молекулярные массы различных белков колеблются в широких пределах: от 6 тыс. до нескольких миллионов дальтон. Ниже приведены молекулярные массы некоторых белков.
Белок |
Молекулярная масса |
Инсулин |
5700 |
Рибонуклеаза |
14000 |
Пепсин |
35500 |
Сывороточный альбумин |
66500 |
Каталаза |
250 000 |
Уреаза |
480 000 |
Гемоцианин |
2800000 |
2.3.3. Амфотерные свойства белков. Белки являются амфотерными электролитами, так как в их молекуле присутствуют как кислотные, так и основные группировки. Кислотно-основные свойства белков определяются главным образом боковыми радикалами аминокислот, способными к ионизации. Вклад концевых NH2- и СООН-групп крайне незначителен. Величины рК боковых радикалов аминокислот в составе белков несколько отличаются от таковых в свободных аминокислотах, поскольку степень ионизации групп в белках зависит от природы соседних боковых радикалов т. е. от электростатического окружения.
Присутствие диссоциирующих группировок в белках обусловливает определенный суммарный заряд молекулы, зависящий от pH среды. Большинство природных белков относится к кислым белкам благодаря значительному содержанию дикарбоновых кислот и поэтому при pH, близких к нейтральным, имеет, как и цитоплазма, в целом, отрицательный заряд.
Аминокислоты с диссоциирующими боковыми радикалами входят в состав всех белков, где они преимущественно располагаются на поверхности глобулы и тем самым определяют гидрофильность молекулы в целом, а также ряд других физико-химических свойств белковых молекул. Распределение заряда на поверхности молекулы неравномерно, различные участки ее могут иметь противоположные заряды, стабилизированные диполями воды. Сдвиг pH среды приводит к изменению характера диссоциации радикалов, перераспределению зарядов на поверхности молекулы, следствием чего является изменение пространственной структуры белков и степени их биологической активности.
Наличие большого числа точек диссоциации определяет и способность белковых молекул взаимодействовать с малыми ионами, в частности ионами металлов, другими заряженными макромолекулами, что очень важно для функционирования белка. Способность белков взаимодействовать как с катионами, так и с анионами имеет большое биологическое значение. Например, важную роль во многих физиологических процессах играет способность белков связывать катион кальция, что имеет непосредственное отношение к регуляции метаболических процессов.
Для каждого белка существует такое значение активной реакции среды, при котором положительные и отрицательные заряды в молекуле скомпенсированы. Значение pH, при котором белок не несет суммарного заряда и не движется в электрическом поле, называют изоэлектрической точкой (ИЭТ) и обозначают как pI. Величина ИЭТ может быть определена по кривым, полученным при кислотно-основном титровании белкового раствора, а также при изоэлектрофокусировании белка (см. разд. 2.3.1). Ниже приведены изоэлектрические точки некоторых белков.
Белок |
рI |
Пепсин |
1.0 |
Уреаза |
5,1 |
Каталаза |
5,6 |
Рибонуклеаза |
7,8 |
Лизоцим |
11,0 |
Значение pH, отвечающее ИЭТ белка, определяется числом его ионогенных групп и величинами их констант диссоциации (рК). ИЭТ выше 7, если белок содержит большое число остатков основных аминокислот, и менее 7 при преимущественном содержании кислых аминокислот. Для большинства глобулярных белков ИЭТ лежат в кислой области (4,5—6,5). Однако есть и исключения. Так, например, фермент пепсин, функционирующий в сильно кислой среде желудка, имеет ИЭТ около 1, а протамины — около 12.
Суммарный заряд белковой молекулы положителен при рН < рI и отрицателен, если рН > рI. Поскольку в ИЭТ молекула белка не несет суммарного заряда и между соседними молекулами отсутствует электростатическое отталкивание, белки легко осаждаются из растворов при pH, равном их ИЭТ.
Изоэлектрическую точку белка следует отличать от изоионной точки, так как эти величины не всегда совпадают. Изоионной точкой белка называется то значение pH, при котором число протонов, связанных с основными группами, равно числу протонов, отданных диссоциированными кислотными группами в белковой молекуле. Таким образом, изоионной точке соответствует значение pH, при котором суммарный заряд белковой молекулы равен нулю в условиях полного отсутствия электролитов в растворе. Следовательно, изоэлектрическая и изоионная точки совпадают только в том случае, когда раствор белка не содержит никаких других ионов, кроме ионизированных остатков аминокислот белковой молекулы и ионов, образующихся при диссоциации воды. Прямое измерение изоионной точки затруднено, поэтому ее определяют, измеряя ИЭТ при различных концентрациях солей и экстраполируя к нулевой концентрации. В отсутствие солей и при значении изоионной точки вблизи pH 7 она будет почти совпадать с изоэлектрической. Однако в присутствии солей различие между этими точками может быть весьма значительным.
Белки, являясь амфотерными электролитами, проявляют буферные свойства.
2.3.4. Растворимость белков. Подавляющее большинство белков — гидрофильные вещества, хорошо растворяющиеся в водных растворах. Растворимость их, как и других высокомолекулярных веществ, определяется природой тех групп, которые оказываются на поверхности молекулы при ее пространственной укладке в нативную конформацию. Большая часть поверхности белковой молекулы образована группами, способными гидратироваться.
Ггод гидратацией понимается связывание диполей воды с ионными и полярными группами. Ионными, несущими заряд, группами в белках являются радикалы, способные к диссоциации. В диссоциированном состоянии они притягивают молекулы воды за счет ион-дипольных взаимодействий. Неионные полярные боковые радикалы аминокислот (аспарагин, глутамин, серин, треонин) образуют с водой водородные связи. К образованию водородных связей с водой способны кислород и водород, входящие в состав пептидных групп, поскольку эти атомы несут избыточный отрицательный (О) и положительный (Н) заряды. Однако доступ воды к пептидным группам затруднен из-за стерического препятствия, создаваемого боковыми радикалами аминокислот, поэтому значительного вклада в гидрофильность белков они не вносят.
Растворимость белков в воде возрастает при добавлении небольших концентраций нейтральных солей [(NH4bSO4, Na2SO4, MgSO4и др.], этот эффект называют солевым растворением. Растворению белков, как и других веществ, способствуют те факторы, которые уменьшают взаимодействие между молекулами растворяемого вещества. Нейтральные соли в малых концентрациях увеличивают степень диссоциации ионизированных групп белка, экранируют заряженные группы белковых молекул и тем самым уменьшают белок-белковое взаимодействие. Известно, что степень диссоциации электролитов (в том числе белков) прямо пропорциональна диэлектрической постоянной растворителя, которая, в свою очередь, пропорциональна степени поляризации молекул растворителя, их дипольному моменту. У сильно поляризованных молекул воды, например, диэлектрическая постоянная при комнатной температуре равна 80, а у ацетона, этанола — 20—30. Нейтральные соли в малых концентрациях еще больше увеличивают диэлектрическую постоянную воды. В результате вода усиливает диссоциацию растворенного вещества, в частности белка. Входя между заряженными группами и ориентируясь вокруг них, диполи воды препятствуют их взаимодействию.
Высокие концентрации нейтральных солей, напротив, осаждают (высаливают) белки из водных растворов, наиболее активно это происходит в ИЭТ белка. Относительная эффективность высаливающего действия различных ионов зависит от их размера, величины заряда, способности к гидратации. При больших концентрациях ионов в растворе они оттягивают к себе от заряженных групп белка поляризованные молекулы воды и частично лишают тем самым белок гидратной оболочки, которая предотвращает его осаждение из раствора. При высоких концентрациях солей этот фактор играет решающую роль. По способности к высаливанию белков из водного раствора анионы и катионы могут быть расположены в особые ряды — ряды Гофмейстера, лиотропные ряды. Для анионов в более щелочной среде по сравнению с ИЭТ белка это будет такой ряд: S2-4 > F- > [цитрат]2- > [тартрат]2- > [ацетaт]- >Cl- > NО3- > Br- > І- > CNS-. Лиотропный ряд для катионов в этих же условиях выглядит следующим образом: Ba2+ > Sr2+ > Ca2+ > Mg2+ > Cs+ > Rb+ > K+ > Na+ > Li+.
Растворимость белков зависит также от pH растворителя, его состава, температуры. Минимальной растворимостью, как указывалось выше, обладают белки в ИЭТ, что объясняется отсутствием электростатического отталкивания между молекулами белка.
Добавление к белковому раствору смешивающихся с водой органических растворителей (этанол, ацетон) уменьшает растворимость белков, а при больших концентрациях растворителей наблюдается выпадение белков в осадок. Данное явление объясняется снижением диэлектрической постоянной среды и, кроме того, уменьшением степени гидратации белков, приводящими к увеличению притяжения между противоположно заряженными группами в белковой молекуле и к агрегации белков. Белки, обладающие разными по растворимости свойствами, осаждаются при различных интервалах концентрации солей или органических растворителей, при неодинаковых значениях активной реакции среды. Это свойство белков используют при их выделении и очистке фракционированием (см. разд. 2.3.1).
В растворах белки проявляют коллоидные свойства: они медленно диффундируют, не проходят через полупроницаемую мембрану, рассеивают свет, характеризуются высокой вязкостью. Однако следует иметь в виду, что белковые растворы не являются типичными коллоидными растворами, так как белки диспергированы до единичных молекул и образуют гомогенный раствор. В отличие от них типичные коллоидные растворы гетерогенны, двухфазны (растворенное вещество и растворитель), коллоидные частицы (мицеллы) растворенного вещества состоят из нескольких молекул. Сходство белковых и истинных коллоидных растворов основано на том, что молекулы белков имеют размеры, приближающиеся к размеру мицелл коллоидного раствора (10-4—10-7 см).
Образование коллоидных растворов белками и другими биологическими макромолекулами обусловливает многие физико-химические явления, наблюдающиеся в биологических жидкостях и организмах в целом. Растворы белков, как и все коллоидные растворы, могут при определенных условиях терять свою текучесть и образовывать гели, или студни. Гели возникают в результате объединения молекул в виде сетки, внутреннее пространство которой заполнено большим количеством растворителя, при этом разделения на жидкую и твердую фазы, как в случае коагуляции, не происходит. Полагают, что в ряде растительных и животных тканей белки находятся не только в виде растворов, но и гелей (в протоплазме клеток, хрусталике глаза, соединительной ткани и др.). В состояние геля белковые растворы, например молоко, могут переходить под воздействием ферментов микроорганизмов, результатом чего является образование простокваши, кефира. При подготовке растений к зимнему периоду жизни, в процессе так называемого осеннего «закаливания» происходит переход части белков из растворенного состояния в гелеобразное.
Гели со временем стареют, отслаивают воду и делятся на две фазы: уплотненный гель и разведенный золь. Этот процесс получил название синерезиса, он протекает, например, при стоянии кефира. Одним из свойств гелей является их способность к набуханию — увеличению объема за счет связывания большого количества воды. Такой процесс происходит, например, при прорастании семян. Белки соединительных тканей животных, поглощая воду, осуществляют тем самым ее запасание организмом. Набухание играет большую роль в технологии кожевенной промышленности, хлебопечении.
В растворах белков и других высокомолекулярных соединений может наблюдаться явление коацервации — слияния водных оболочек нескольких частиц без объединения самих частиц. Коацерваты возникают при ограниченной растворимости компонентов раствора, это служит причиной появления коацерватных капель. Коацерваты образуются, например, из белков с противоположными зарядами. Им придают большое значение в теории происхождения жизни, однако в отличие от биологических неравновесных структур коацерваты термодинамически равновесны.
Благодаря гидрофильным и гидрофобным группировкам белки могут влиять на растворимость других веществ, выступая в роли эмульгаторов — веществ, стабилизирующих эмульсию, которую образуют взаимно нерастворимые жидкости (вода—масло). В организме человека в эмульгированном состоянии находятся жиры в крови и лимфе. Белок образует на поверхности капелек жира тонкую пленку, которая притягивает воду и препятствует слипанию жировых частичек. Одной из причин образования мочевых и желчных камней может быть недостаток в организме муцинов — слизистых гликопротеинов, обволакивающих гидрофобные микрочастицы и способствующих тем самым их выведению из организма. Как эмульсию можно рассматривать и молоко, представляющее собой эмульгированные казеиногеном капельки жира в воде.
2.3.5. Денатурация белков. Под денатурацией белка понимают нарушение нативной пространственной структуры белковой молекулы, приводящее к уменьшению или полной потере ее растворимости, изменению других физико-химических свойств белка, утрате специфической биологической активности. Денатурация сопровождается разрывом ковалентных связей в остове полипептидной цепи. Происходит расщепление дисульфидных мостиков, гидрофобных, ионных, водородных связей. В результате нарушается нативная третичная структура и в значительной мере вторичная. Денатурацию белковых молекул вызывают как некоторые химические соединения, так и физические факторы. Механизм денатурирующего воздействия химических агентов определяется их строением. Например, мочевина, гуанидинхлорид, формамид благодаря наличию амидной группировки конкурируют с пептидными группировками белка за водородные связи, переключая их на себя. Эти реагенты нарушают также гидрофобные взаимодействия. Максимальное денатурирующее влияние мочевина и другие амиды проявляют в больших концентрациях (6М—10М).
Денатурирующее действие умеренно полярных органических растворителей (низшие спирты, этиленгликоль, диоксан, диметил-сульфоксид и др.) связано с резким уменьшением диэлектрической константы водных растворов белков, вследствие чего увеличиваются электростатические силы взаимодействия между заряженными- группами. Образование прочных внутри- и межмолекулярных ионных связей и приводит к денатурации белков. Органические растворители нарушают гидрофобные взаимодействия в молекулах белков. Неполярные алифатические и ароматические углеводороды разрушают внутримолекулярные гидрофобные связи белков вследствие прямого взаимодействия с их гидрофобными группами.
Ионные детергенты, например додецилсульфат натрия, соединяются с противоположно заряженными группами белка. Электростатическое отталкивание оставшихся в пептидной цепи одноименно заряженных групп приводит к разрыву водородных связей и других слабых взаимодействий, стабилизирующих нативную конформацию белка.
Денатурирующими агентами являются также катионы тяжелых металлов и анионы иода, тиоцианата. Эти вещества, по-видимому, образуют достаточно прочные соединения с полярными группами белков, искажая систему ионных и водородных связей.
Для трихлоруксусной кислоты и таннина характерен сложный механизм денатурации, включающий как непосредственное воздействие на водородные связи, так и блокирование полярных группировок.
Многие белки денатурируют при сильном подкислении (рН < 2—3) или подщелачивании (рН > 10—11). В этих условиях практически все диссоциирующие группы белка имеют одноименный заряд (преимущественно Н3N+-группы при низких значениях pH и СОО- — при высоких). Взаимное отталкивание одноименных зарядов вызывает разрыв части слабых связей, в результате чего нарушается нативная структура. Однако необходимо учитывать, что некоторые белки достаточно устойчивы при крайних значениях pH. Например, при pH 2 довольно стабильны гистоны, протамины, лизоцим, а у пепсина при pH 1,5—2,2 активность даже максимальна. Лизоцим, гистоны и протамины устойчивы и при pH 10, а у щелочных фосфатаз и аргиназы оптимум pH каталитической активности лежит в интервале 9,5—9,7.
Из физических факторов денатурации наиболее общим является нагревание. Усиление теплового движения полипептидных цепей приводит к разрыву водородных связей и нарушению гидрофобных взаимодействий. Скорость тепловой денатурации существенно зависит от активной реакции среды, присутствия солей, их концентрации. Тепловая денатурация сопровождается агрегацией белков, выпадением их в осадок, что представляет собой уже вторичное явление.
Существуют многочисленные данные о том, что у термофильных микроорганизмов большинство белков обладает повышенной термостабильностью. При нагревании до 60°С они не денатурируют, претерпевают лишь небольшие конформационные изменения, в то время как у белков мезофиллов (организмы, обитающие при обычных, средних температурах) при +60°С наблюдается существенная денатурация. У мезофиллов лишь редкие белки обладают повышенной термостабильностью.
Белки денатурируют и при многих механических воздействиях; высоком давлении (5000—10 000 атм), растирании сухих препаратов, энергичном встряхивании растворов, облучении звуковыми волнами высокой частоты. Все это следует иметь в виду при биохимических исследованиях белков. При лиофилизации большинство белков не денатурирует, что позволяет использовать этот способ сушки для получения белковых препаратов длительного хранения.
Физическими факторами денатурации белков являются также ультрафиолетовые свет (особенно в границах 260—310 нм), ионизирующее излучение. Денатурация белка происходит также при распределении его на границе раздела двух фаз, такая поверхностная денатурация наблюдается при вспенивании белковых растворов в процессе выделения белков и при образовании пены на поверхности водоемов.
При денатурации белков изменяются многие физико-химические свойства белка: растворимость, константа седиментации, вязкость, оптические свойства и др. В процессе денатурации белков с четвертичной структурой может происходить их диссоциация на субъединицы. В белке существенно уменьшается количество участков с регулярными типами вторичной структуры, снижается количество внутримолекулярных водородных связей и возрастает число этих связей между белком и водой. Поскольку при денатурации происходит нарушение гидрофобных взаимодействий в процессе развертывания белковой молекулы и гидрофобные группы оказываются на поверхности молекулы, это вызывает потерю растворимости и набухаемости белков в водных растворах.
При денатурации белка выявляются реактивные группы, которые в нативном белке не полностью доступны для обнаружения обычными методами (сульфгидрильные, фенольные, имидазольные и др.). Изменение числа реактивных групп при денатурации проявляется и в изменении ИЭТ белков. Как правило, изоэлектрическая точка смещается в сторону щелочных значений pH. Денатурация белков сопровождается возрастанием отрицательной оптической активности.
Превращение компактной молекулы в беспорядочный клубок, происходящее при денатурации, приводит к тому, что большинство пептидных связей становится доступным действию протеолитических ферментов. В связи с этим протеолиз денатурированных белков протекает с большей скоростью, чем нативных.
Потеря белками биологической активности выражается в инактивации ферментов, гормонов, вирусов. Это является важным критерием денатурации, хотя здесь и существуют некоторые исключения. Такие ферменты, как папаин, пепсин, сохраняют свою активность при денатурации мочевиной, а рибонуклеаза и лизоцим сохраняют активность при нагревании в разбавленной кислоте. При денатурации ряда белков происходит понижение антигенности, но сохраняется иммунологическая специфичность.
Медленная денатурация белков происходит при длительном хранении семян, в результате чего у них уменьшается набухаемость и, как следствие, снижается интенсивность прорастания.
Полная денатурация белка в большинстве случаев необратима, однако при подборе соответствующих условий иногда удается ренатурировать белки. Способность к ренатурации после нагревания показана, например, для фермента трипсина. Необходимым условием его ренатурации является очень медленное охлаждение белка до комнатной температуры («отжиг»), при этом восстанавливается нативная конформация и специфическая биологическая функция трипсина.
2.3.8 Оптические свойства. Все белки, как правило, поглощают ультрафиолетовый (УФ) свет в трех областях. Поглощение при длинах волн (Я) более 250 нм с максимумом около 280 нм обусловлено присутствием исключительно ароматических аминокислот — триптофана, тирозина и фенилаланина. Основной вклад дают аминокислоты триптофан (λ1max = 278 нм, ε2 = 5600) и тирозин (λmах = 275 нм, ε = 1300), входящий в больших количествах в состав почти всех белков. Поглощение при 210—250 нм имеет сложную природу и определяется наличием ароматических и ряда других аминокислот, а также присутствием в белках водородных связей, а-спиральных участков и т. д. Полоса поглощения, максимум которой расположен вблизи 190 нм, обусловлена главным образом наличием в белке пептидных связей. Интенсивность поглощения в этой области меняется в основном в зависимости от количества а-спиральных структур в белке.
На свойстве белков поглощать свет в УФ-области спектра основан спектрофотометрический метод количественного определения белка (по интенсивности поглощения при 280 нм). Он не очень точен, поскольку количество триптофана и тирозина в различных белках варьирует в довольно широких пределах. При работе с белками условно принимают, что 1 единица оптической плотности раствора при 280 нм соответствует концентрации, равной приблизительно 1 мг/мл (при толщине кюветы 1 см). Несмотря на недостаточную точность, этот метод широко применяют в современной биохимии, так как он прост и быстр в исполнении, дает возможность дальнейшего использования раствора белка после определения оптической плотности. Метод особенно часто используют при контроле за изменением концентрации белков при их разделении на колонках.
Спектрофотометрия позволяет также устанавливать зависимость оптической плотности растворов от длины волны поглощаемого света, т. е. получать спектры поглощения, и, кроме того, используется для определения пространственного расположения ароматических аминокислот в белковой глобуле (внутри или снаружи). Последний способ применения основан на том, что спектры поглощения ароматических аминокислот (их λmах и ε) претерпевают заметные изменения в зависимости от окружения, в частности от полярности растворителя, pH среды. Триптофан, тирозин и фенилаланин в менее полярном окружении (например, внутри белковой глобулы) имеют более высокие λmах и ε. Если спектр белка чувствителен к изменению полярности растворителя, это дает основание заключить, что аминокислоты, для которых наблюдаются изменения λmах и ε, располагаются в основном на поверхности белковой глобулы.
1 λmах — длина волны, при которой наблюдается максимальное поглощение.
2 ε — молярный коэффициент поглощения.
Подобного типа анализы обычно проводят путем снятия дифференциальных спектров, т. е. непосредственной регистрацией разности поглощения УФ-света белком в различных растворителях. Метод дифференциальной спектрофотометрии позволяет установить и степень полярности окружения ароматической аминокислоты, находящейся внутри глобулы. Так, если в спектре аминокислоты в составе белка, находящегося в полярном растворителе, наблюдаются большие λmах и ε, чем эти же величины для свободной аминокислоты в том же растворителе, то эта аминокислота находится во внутренней области белка и окружена неполярными аминокислотами.
В видимом диапазоне спектра (380—760 нм) способностью поглощать свет обладают только окрашенные белки, так называемые хромопротеины — гемоглобины, цитохромы, флавопротеины, «голубой белок» из Pseudomonas, интенсивно поглощающий свет с длиной волны около 600 нм, и некоторые другие.
В инфракрасной (ИК) области спектра (760—10 000 нм) поглощают свет все белки. ИК-спектроскопию широко используют для определения относительного содержания а-спиралей, ß-структур и аморфных участков в белковой молекуле. Это можно оценить по интенсивности некоторых полос спектра, в частности полосы амид I (~1680 см-1). При изображении ИК-спектров используют не длины волн, а частоты (v) или волновые числа (1/λ), поэтому положение полос определяют в обратных сантиметрах.
Использование поляризованного ИК-света позволяет определять ориентацию водородных связей относительно полипептидной цепи: в а-спирали они параллельны, в ß-структуре перпендикулярны цепи. Методом инфракрасного дихроизма регистрируют спектры поглощения белка для двух взаимно перпендикулярных направлений поляризации падающего света. В одном случае вектор напряженности электрического поля параллелен пептидным цепям, в другом — перпендикулярен им. В указанном методе получают так называемые растянутые пленки белков, в которых все белковые молекулы ориентированы в одном и том же направлении, и измеряют дихроичное отношение, т. е. отношение площадей полос, полученных, когда электрический вектор световой волны параллелен и перпендикулярен оси молекулы. Группы —С —О (1660 см-1) и —N—H (3300 см-1) поглощают наиболее сильно тогда, когда они параллельны вектору. По величине дихроичного отношения судят о вероятности а-спиральной структуры в белке.
Белки являются оптически активными веществами: они вращают проходящий через них плоскополяризованный свет и неодинаково поглощают левый и правый циркулярно поляризованный свет. Плоско поляризованный свет — это свет, у которого вектор напряженности электрического поля для всех фотонов светового пучка лежит в одной плоскости; циркулярно поляризованным светом называется свет, у которого вектор напряженности описывает спираль. Указанное свойство белков объясняется наличием в их молекуле хиральных атомов углерода. Взаимодействие с белками поляризованного света изучают методами дисперсии оптического вращения (ДОВ), кругового дихроизма (КД). С помощью этих методов в зависимости от длины волны измеряют способность оптически активного вещества вращать плоско поляризованный свет (ДОВ) и по-разному поглощать поляризованный по кругу вправо и влево свет (КД). Методы ДОВ и КД применяют для общего описания содержания спиральных структур в белках и исследования конформационных изменений.
Для белков и многих белковых структур характерно свойство оптической анизотропии, т. е. различие оптических свойств по разным направлениям. В одних случаях оптическая анизотропия обусловлена внутренним строением белков, в других — их формой или искусственно вызванной ориентацией.
Белковые растворы обладают также способностью флуоресцировать — испускать квант света при переходе из электронновозбужденного состояния в основное. На этом свойстве белков основана (флуоресцентная спектроскопия — измерение интенсивности испускаемого света при возбуждении образца (поглощение им кванта света при облучении УФ-светом). Спектр флуоресценции всегда бывает смещен относительно спектра поглощения в длинноволновую область, так как при переходе из возбужденного состояния в основное молекула теряет энергию.
Флуоресцирующими аминокислотными остатками в белках являются триптофан, тирозин и фенилаланин. Флуоресценцию каждого из них можно отличить по длине волны, при которой она наблюдается. Кроме того, сложные белки могут содержать и другие флуоресцирующие компоненты. Измерение флуоресценции дает сведения о конформационных перестройках белков, местах связывания лигандов, взаимодействиях с растворителем, степени гибкости молекулы, межмолекулярных расстояниях и др.