Биологическая химия - Березов Т. Т., Коровкин Б. Ф. 1998
Гормоны
Гормоны гипоталамуса
Гипоталамус служит местом непосредственного взаимодействия высших отделов ЦНС и эндокринной системы. Природа связей, существующих между ЦНС и эндокринной системой, стала проясняться в последние десятилетия, когда из гипоталамуса были выделены первые гуморальные факторы, оказавшиеся гормональными веществами с чрезвычайно высокой биологической активностью. Потребовалось немало труда и экспериментального мастерства, чтобы доказать, что эти вещества* образуются в нервных клетках гипоталамуса, откуда по системе портальных капилляров достигают гипофиза и регулируют секрецию гипофизарных гормонов, точнее их освобождение (возможно, и биосинтез). Эти вещества получили сначала наименование нейрогормонов, а затем рилизинг-факторов (от англ. release — освобождать), или либеринов. Вещества с противоположным действием, т.е. угнетающие освобождение (и, возможно, биосинтез) гипофизарных гормонов, стали называть ингибирующими факторами, или статинами. Таким образом, гормонам гипоталамуса принадлежит ключевая роль в физиологической системе гормональной регуляции многосторонних биологических функций отдельных органов, тканей и целостного организма.
* Впервые Р. Гиймену и Э. Шалли удалось в начале 70-х годов выделить из ткани гипоталамуса вещества, которые оказывали регулирующее действие на функцию гипофиза. Эти авторы за открытие так называемых сверхгормонов совместно с Р. Ялоу, разработавшей радиоиммунологический метод определения пептидных гормонов, были удостоены в 1977 г. Нобелевской премии.

К настоящему времени в гипоталамусе открыто 7 стимуляторов (либерины) и 3 ингибитора (статины) секреции гормонов гипофиза, а именно: кортиколиберин, тиролиберин, люлиберин, фоллилиберин, соматолиберин, пролактолиберин, меланолиберин, соматостатин, пролактостатин и меланостатин (табл. 8.1). В чистом виде выделено 5 гормонов, для которых установлена первичная структура, подтвержденная химическим синтезом.
Большие трудности при получении гормонов гипоталамуса в чистом виде объясняются чрезвычайно низким содержанием их в исходной ткани. Так, для выделения всего 1 мг тиролиберина потребовалось переработать 7 т гипоталамусов, полученных от 5 млн овец.
Следует отметить, что не все гормоны гипоталамуса, по-видимому, строго специфичны в отношении одного какого-либо гипофизарного гормона. В частности, для тиролиберина показана способность освобождать, помимо тиротропина, также пролактин, а для люлиберина, помимо лютеинизирующего гормона, — также фолликулостимулирующий гормон.
Таблица 8.1. Гипоталамические гормоны, контролирующие освобождение гормонов гипофиза 1
Старое название |
Принятые сокращения |
Рекомендуемое название |
Кортикотропин-рилизинг-фактор |
КРФ |
Кортиколиберин |
Тиротропин-рилизинг-фактор |
ТРФ |
Тиролиберин |
Гонадотропин-рилизинг-фактор |
ГРФ |
Гонадолиберин |
Рилизинг-фактор фолликулостимулирующего гормона |
ФРФ |
Фоллилиберин |
ФСГ-РФ |
||
Соматотропин-рилизинг-фактор |
СРФ |
Соматолиберин |
Соматотропинингибирующий фактор |
СИФ |
Соматостатин |
Пролактин-рилизинг-фактор |
ПРФ |
Пролактолиберин |
Пролактинингибирующий фактор |
ПИФ |
Пролактостатин |
Меланотропин-рилизинг-фактор |
МРФ |
Меланолиберин |
Меланотропинингибирующий фактор |
МИФ |
Меланостатин |
1 Гипоталамические гормоны не имеют твердо установленных наименований. Рекомендуется в первой части названия гормона гипофиза добавлять окончание «либерин»; например, «тиролиберин» означает гормон гипоталамуса, стимулирующий освобождение (и, возможно, синтез) тиротропина - соответствующего гормона гипофиза. Аналогичным образом образуют названия факторов гипоталамуса, ингибирующих освобождение (и, возможно, синтез) тропных гормонов гипофиза,- добавляют окончание «статин». Например, «соматостатин» означает гипоталамический пептид, ингибирующий освобождение (или синтез) гормона роста гипофиза - соматотропина.
Установлено, что по химическому строению все гормоны гипоталамуса являются низкомолекулярными пептидами, так называемыми олигопептидами необычного строения, хотя точный аминокислотный состав и первичная структура выяснены не для всех. Приводим полученные к настоящему времени данные о химической природе шести из известных 10 гормонов гипоталамуса.
1. Тиролиберин (Пиро-Глу-Гис-Про-NH2):
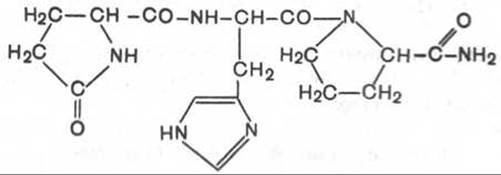
Тиролиберин представлен трипептидом, состоящим из пироглутаминовой (циклической) кислоты, гистидина и пролинамида, соединенных пептидными связями. В отличие от классических пептидов он не содержит свободных NH2- и СООН-групп у N- и С-концевых аминокислот.
2. Гонадолиберин является декапептидом, состоящим из 10 аминокислот в последовательности:
![]()
Концевая С-аминокислота представлена глицинамидом.
3. Соматостатин является циклическим тетрадекапептидом (состоит из 14 аминокислотных остатков)*:
![]()
Отличается этот гормон от двух предыдущих, помимо циклической структуры, тем, что не содержит на N-конце пироглутаминовой кислоты: дисульфидная связь образуется между двумя остатками цистеина в 3-м и 14-м положениях. Следует отметить, что синтетический линейный аналог соматостатина также наделен аналогичной биологической активностью, что свидетельствует о несущественности дисульфидного мостика природного гормона. Помимо гипоталамуса, соматостатин продуцируется нейронами центральной и периферической нервных систем, а также синтезируется в S-клетках панкреатических островков (островков Лангерганса) в поджелудочной железе и клетках кишечника. Он оказывает широкий спектр биологического действия; в частности, показано ингибирующее действие на синтез гормона роста в аденогипофизе, а также прямое тормозящее действие его на биосинтез инсулина и глюкагона в ß- и а-клетках островков Лангерганса.
4. Соматолиберин недавно выделен из природных источников. Он представлен 44 аминокислотными остатками с полностью раскрытой последовательностью. Биологической активностью соматолиберина наделен, кроме того, химически синтезированный декапептид:
Н-Вал-Гис-Лей-Сер-Ала-Глу-Глн-Лиз-Глу-Ала-ОН.
Этот декапептид стимулирует синтез и секрецию гормона роста гипофиза соматотропина.
5. Меланолиберин, химическая структура которого аналогична структуре открытого кольца гормона окситоцина (без трипептидной боковой цепи), имеет следующее строение:
Н-Цис-Тир-Иле-Глн-Асн-Цис-ОН.
6. Меланостатин (меланотропинингибирующий фактор) представлен или трипептидом: Пиро-Глу-Лей-Гли-NH2 или пентапептидом со следующей последовательностью:
Пиро-Глу-Гис-Фен-Дрг-Гли-NН2.
Необходимо отметить, что меланолиберин оказывает стимулирующее действие, а меланостатин, напротив, ингибирующее действие на синтез и секрецию меланотропина в передней доле гипофиза.
Помимо перечисленных гипоталамических гормонов, интенсивно изучалась химическая природа другого гормона - кортиколиберина. Активные препараты его были выделены как из ткани гипоталамуса, так и из задней доли гипофиза; существует мнение, что последняя может служить депо гормона для вазопрессина и окситоцина. Недавно выделен состоящий из 41 аминокислоты с выясненной последовательностью кортиколиберин из гипоталамуса овцы.
* В написании аминокислотных последовательностей полипептидов в настоящее время принято обозначать N-конец символом Н, а С-конец - ОН.
Местом синтеза гипоталамических гормонов, вероятнее всего, являются нервные окончания — синаптосомы гипоталамуса, поскольку именно там отмечена наибольшая концентрация гормонов и биогенных аминов. Последние рассматриваются наряду с гормонами периферических желез внутренней секреции, действующих по принципу обратной связи, в качестве основных регуляторов секреции и синтеза гормонов гипоталамуса. Механизм биосинтеза тиролиберина, осуществляющегося, скорее всего, нерибособальным путем, включает участие SH-содержащей синтетазы или комплекса ферментов, катализирующих циклизацию глутаминовой кислоты в пироглутаминовую, образование пептидной связи и амидирование пролина в присутствии глутамина. Существование подобного механизма биосинтеза с участием соответствующих синтетаз допускается также в отношении гонадолиберина и соматолиберина.
Пути инактивации гормонов гипоталамуса изучены недостаточно. Период полураспада тиролиберина в крови крысы составляет 4 мин. Инактивация наступает как при разрыве пептидной связи (под действием экзо- и эндопептидаз сыворотки крови крысы и человека), так и при отщеплении амидной группы в молекуле пролинамида. В гипоталамусе человека и ряда животных открыт специфический фермент пироглутамилпептидаза, которая катализирует отщепление от тиролиберина или гонадолиберина молекулы пироглутаминовой кислоты.
Гипоталамические гормоны непосредственно влияют на секрецию (точнее, освобождение) «готовых» гормонов и биосинтез этих гормонов de novo. Доказано, что цАМФ участвует в передаче гормонального сигнала. Показано существование в плазматических мембранах клеток гипофиза специфических аденогипофизарных рецепторов, с которыми связываются гормоны гипоталамуса, после чего через систему аденилатциклазы и мембранных комплексов Са2+ — АТФ и Mg2 — АТФ освобождаются ионы Са2+ и цАМФ; последний действует как на освобождение, так и на синтез соответствующего гормона гипофиза путем активирования протеинкиназы (см. далее).
Для выяснения механизма действия рилизинг-факторов, включая их взаимодействие с соответствующими рецепторами, большую роль сыграли структурные аналоги тиролиберина и гонадолиберина. Некоторые из этих аналогов обладают даже более высокой гормональной активностью и пролонгированным действием, чем природные гормоны гипоталамуса. Однако предстоит еще большая работа по выяснению химического строения уже открытых рилизинг-факторов и расшифровке молекулярных механизмов их действия.