Биологическая химия - Березов Т. Т., Коровкин Б. Ф. 1998
Гормоны
Гормоны гипофиза
Липотропные гормоны (ЛТГ, липотропины)
Среди гормонов передней доли гипофиза, структура и функция которых выяснены в последнее десятилетие, следует отметить липотропины, в частности ß- и у-ЛТГ. Наиболее подробно изучена первичная структура ß-липотропина овцы и свиньи, молекулы которого состоят из 91 аминокислотного остатка и имеют существенные видовые различия в последовательности аминокислот. К биологическим свойствам ß-липотропина относятся жиромобилизующее действие, кортикотропная, меланоцитстимулирующая и гипокальциемическая активность и, кроме того, инсулиноподобный эффект, выражающийся в повышении скорости утилизации глюкозы в тканях. Предполагают, что липотропный эффект осуществляется через систему аденилатциклаза — цАМФ—протеинкиназа, завершающей стадией действия которой является фосфорилирование неактивной триацилглицерол-липазы. Этот фермент после активирования расщепляет нейтральные жиры на диацилглицерол и высшую жирную кислоту (см. главу 11).
* К группе гонадотропинов относят также хорионический гонадотропин человека (ХГЧ), синтезируемый клетками плаценты и представленный гликопротеином.
Перечисленные биологические свойства обусловлены не ß-липотропином, оказавшимся лишенным гормональной активности, а продуктами его распада, образующимися при ограниченном протеолизе. Оказалось, что в ткани мозга и в промежуточной доле гипофиза синтезируются биологически активные пептиды, наделенные опиатоподобным действием. Приводим структуры некоторых из них:
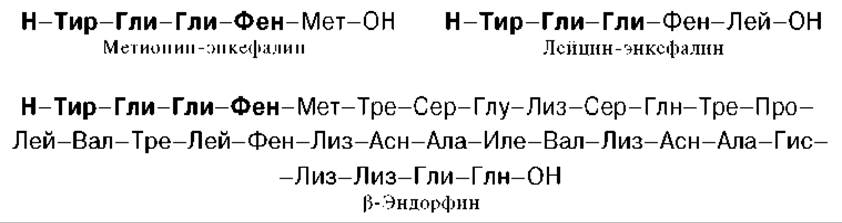
Общим типом структуры для всех трех соединений является тетрапептидная последовательность на N-конце. Доказано, что ß-эндорфин (31 АМК) образуется путем протеолиза из более крупного гипофизарного гормона ß-липотропина (91 АМК); последний вместе с АКТГ образуется из общего предшественника — прогормона, названного проопиокортином (является, таким образом, препрогормоном), имеющим молекулярную массу 29 кДа и насчитывающим 134 аминокислотных остатка. Биосинтез и освобождение проопиокортина в передней доле гипофиза регулируется кортиколиберином гипоталамуса. В свою очередь из АКТГ и ß-липотропина путем дальнейшего процессинга, в частности ограниченного протеолиза, образуются соответственно а- и ß-меланоцитстимулирующие гормоны (а- и ß-МСГ). С помощью техники клонирования ДНК, а также метода определения первичной структуры нуклеиновых кислот Сенджера в ряде лабораторий была раскрыта нуклеотидная последовательность мРНК—предшественника проопиокортина. Эти исследования могут служить основой для целенаправленного получения новых биологически активных гормональных лечебных препаратов.
Ниже представлены пептидные гормоны, образующиеся из ß-липотропина путем специфического протеолиза.
Участок ß-липотропина |
Пептидный гормон |
1-58 |
Y-Липотропин |
41-58 |
ß-МСГ |
61-65 |
Мет-энкефалин |
61-76 |
а-Эндорфин |
61-77 |
у-Эндорфин |
61-79 |
δ-Эндорфин |
61-91 |
ß-Эндорфин |
Учитывая исключительную роль ß-липотропина как предшественника перечисленных гормонов, приводим первичную структуру ß-липотропина свиньи (91 аминокислотный остаток):
Н-Глу-Лей-Ала-Гли-Апа-Про-Про-Глу-Про-Ала-Арг-Асп-Про-Глу-Ала-Про-Ала-Глу-Гли-Ала-Ала-Ала-Арг-Ала-Глу-Лей-Глу-Тир-Гли-Лей-Вал-Ала-Глу-Апа-Глу-Апа-Апа-Глу-Лиз-Лиз-Асп-Глу-Гли-Про-Тир-Лиз-Мет-Глу-Гис-Фен-Арг-Трп-Гли-Сер-Про-Про-Лиз-Асп-Лиз-Арг-Тир-Гли-Гли-Фен-Мет-Тре-Сер-Глу-Лиз-Сер-Глн-Тре-Про-Лей-Вал-Тре-Лей-Фен-Лиз-Асн-Ала-Иле-Вал-Лиз-Асн-Апа-Гис-Лиз-Лиз-Гли-Глн-ОН
Повышенный интерес к указанным пептидам, в частности энкефалинам и эндорфинам, диктуется их необычайной способностью, подобно морфину, снимать болевые ощущения. Эта область исследования - поиск новых природных пептидных гормонов и(или) их направленный биосинтез - является интересной и многообещающей для развития физиологии, нейробиологии, неврологии и клиники.