Биологическая химия - Березов Т. Т., Коровкин Б. Ф. 1998
Химия белков
Аминокислотный состав белков
Классификация аминокислот
Все встречающиеся в природе аминокислоты обладают общим свойством — амфотерностью (от греч. amphoteros — двусторонний), т.е. каждая аминокислота содержит как минимум одну кислотную и одну основную группы. Общий тип строения а-аминокислот может быть представлен в следующем виде:

Как видно из общей формулы, аминокислоты будут отличаться друг от друга химической природой радикала R, представляющего группу атомов в молекуле аминокислоты, связанную с а-углеродным атомом и не участвующую в образовании пептидной связи при синтезе белка. Почти все а-амино- и а-карбоксильные группы участвуют в образовании пептидных связей белковой молекулы, теряя при этом свои специфические для свободных аминокислот кислотно-основные свойства. Поэтому все разнообразие особенностей структуры и функции белковых молекул связано с химической природой и физико-химическими свойствами радикалов аминокислот. Именно благодаря им белки наделены рядом уникальных функций, не свойственных другим биополимерам, и обладают химической индивидуальностью.
Классификация аминокислот разработана на основе химического строения радикалов, хотя были предложены и другие принципы. Различают ароматические и алифатические аминокислоты, а также аминокислоты, содержащие серу или гидроксильные группы. Часто классификация основана на природе заряда аминокислоты. Если радикал нейтральный (такие аминокислоты содержат только одну амино- и одну карбоксильную группы), то они называются нейтральными аминокислотами. Если аминокислота содержит избыток амино- или карбоксильных групп, то она называется соответственно основной или кислой аминокислотой.
Современная рациональная классификация аминокислот основана на полярности радикалов (R-групп), т.е. способности их к взаимодействию с водой при физиологических значениях рН (близких к рН 7,0). Различают 5 классов аминокислот, содержащих следующие радикалы: 1) неполярные (гидрофобные); 2) полярные (гидрофильные); 3) ароматические (большей частью неполярные); 4) отрицательно заряженные и 5) положительно заряженные. В представленной классификации аминокислот (табл. 1.3) приведены наименования, сокращенные английские и русские обозначения и однобуквенные символы аминокислот, принятые в отечественной и иностранной литературе, а также значения изоэлектрической точки (рI) и молекулярной массы (М). Отдельно даются структурные формулы всех 20 аминокислот белковой молекулы.
Таблица 1.3. Классификация аминокислот, основанная на полярности радикалов
Аминокислоты |
Принятые сокращенные обозначения и однобуквенные символы |
М/рI |
Среднее содержание в белках, % |
||
англ. |
символ |
русск. |
|||
I. Неполярные R-группы Глицин |
Gly |
G |
Гли |
75/5,97 |
7,5 |
Аланин |
Ala |
A |
Ала |
89/6,02 |
9,0 |
Валин |
Val |
V |
Вал |
117/5,97 |
6,9 |
Лейцин |
Leu |
L |
Лей |
131/5,97 |
7,5 |
Изолейцин |
Ile |
I |
Иле |
131/5,97 |
4,6 |
Пролин |
Pro |
P |
Про |
115/6,10 |
4,6 |
II. Полярные, незаряженные R-группы Серин |
Ser |
S |
Сер |
105/5,68 |
7,1 |
Треонин |
Thr |
Т |
Тре |
119/6,53 |
6,0 |
Цистеин |
Cys |
C |
Цис |
121/5,02 |
2,8 |
Метионин |
Met |
M |
Мет |
149/5,75 |
1,7 |
Аспарагин |
Asn |
N |
Асн |
132/5,41 |
4,4 |
Глутамин |
Gln |
Q |
Глн |
146/5,65 |
3,9 |
III. Ароматические R- группы Фенилаланин |
Phe |
F |
Фен |
165/5,98 |
3,5 |
Тирозин |
Tyr |
Y |
Тир |
181/5,65 |
3,5 |
Триптофан |
Trp |
W |
Трп |
204/5,88 |
1,1 |
IV. Отрицательно заряженные R-группы Аспарагиновая кислота |
Asp |
D |
Асп |
133/2,97 |
5,5 |
Глутаминовая кислота |
Glu |
E |
Глу |
147/3,22 |
6,2 |
V. Положительно заряженные R-группы Лизин |
Lys |
К |
Лиз |
146/9,74 |
7,0 |
Аргинин |
Arg |
R |
Арг |
174/10,76 |
4,7 |
Гистидин |
His |
H |
Гис |
155/7,59 |
2,1 |
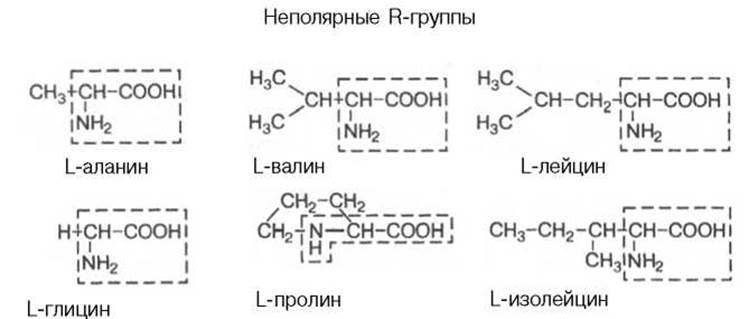

Перечисленные аминокислоты присутствуют в разных количественных соотношениях и последовательностях в тысячах белков, хотя отдельные индивидуальные белки не содержат полного набора всех этих аминокислот. Помимо наличия в большинстве природных белков 20 аминокислот, в некоторых белках обнаружены производные аминокислот *: оксипролин, оксилизин, дийодтирозин, фосфосерин и фосфотреонин (последние две аминокислоты представлены в главе 2):
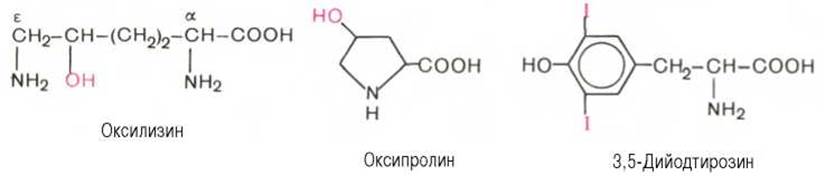
Первые две аминокислоты содержатся в белке соединительной ткани - коллагене, а дийодтирозин является основой структуры гормонов щитовидной железы. В мышечном белке миозине обнаружен также ε-N-метиллизин; в состав протромбина (белок свертывания крови) входит у-карбоксиглутаминовая кислота, а в глутатионпероксидазе открыт селеноцистеин, в котором ОН-группа серина заменена на селен (Se):

Помимо указанных, ряд а-аминокислот выполняет важные функции в обмене веществ, хотя и не входит в состав белков, в частности орнитин, цитруллин, гомосерин, гомоцистеин, цистеинсульфиновая кислота, диоксифенилаланин и др.