Биологическая химия - Березов Т. Т., Коровкин Б. Ф. 1998
Гормоны
Молекулярные механизмы передачи гормонального сигнала
Аденилатциклазная мессенджерная система
Наиболее изученным является аденилатциклазный путь передачи гормонального сигнала. В нем задействовано мимимум пять хорошо изученных белков: 1) рецептор гормона; 2) фермент аденилатциклаза, выполняющая функцию синтеза циклического АМФ (цАМФ); 3) G-белок, осуществляющий связь между аденилатциклазой и рецептором; 4) цАМФ-зависимая протеинкиназа, катализирующая фосфорилирование внутриклеточных ферментов или белков-мишеней, соответственно изменяя их активность; 5) фосфодиэстераза, которая вызывает распад цАМФ и тем самым прекращает (обрывает) действие сигнала (рис. 8.5).
Получены в чистом виде а- и ß-адренергические рецепторы из плазматических мембран клеток печени, мышц и жировой ткани. Показано, что связывание гормона с ß-адренергическим рецептором приводит к структурным изменениям внутриклеточного домена рецептора, что в свою очередь обеспечивает взаимодействие рецептора со вторым белком сигнального пути — ГТФ-связывающим.
ГТФ-связывающий белок — G-белок — представляет собой смесь 2 типов белков: активного Gs (от англ. stimulatory G) и ингибиторного Gi с мол. массой 80000—90000. В составе каждого из них имеется три разные субъединицы (а-, ß- и у-), т.е. это гетеротримеры. Показано, что ß-субъединицы Gsи Giидентичны (мол. масса 35000); в то же время а-субъединицы, являющиеся продуктами разных генов (мол. масса 45000 и 41000), оказались ответственными за проявление G-белком активаторной и ингибиторной активности соответственно. Гормонрецепторный комплекс сообщает G-белку способность не только легко обменивать эндогенный связанный ГДФ на ГТФ, но и переводить Gs-белок в активированное состояние, при этом активный G-белок диссоциирует в присутствии ионов Mg2+ на ß-, Y-субъединицы и комплекс а-субъединицы Gsв ГТФ-форме; этот активный комплекс затем перемещается к молекуле аденилатциклазы и активирует ее. Сам комплекс затем подвергается самоинактивации за счет энергии распада ГТФ и реассоциации ß- и у-субъединиц с образованием первоначальной ГДФ-формы Gs.

Рис. 8.5. Аденилатциклазный путь передачи гормонального сигнала.
Рец - рецептор; G - G-белок; АЦ - аденилатциклаза.
Аденилатциклаза представляет собой интегральный белок плазматических мембран, его активный центр ориентирован в сторону цитоплазмы и катализирует реакцию синтеза цАМФ из АТФ:
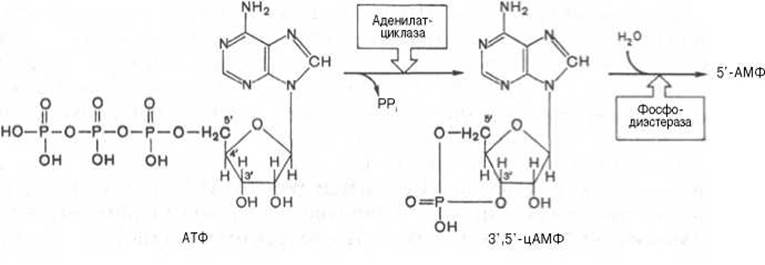
Каталитический компонент аденилатциклазы, выделенный из разных тканей животных, представлен одним полипептидом с мол. массой 120000— 150000; в отсутствие G-белков он практически неактивен; содержит две SH-группы, одна из которых вовлечена в сопряжение с Gі-белком, а вторая необходима для проявления каталитической активности. В молекуле фермента имеется несколько аллостерических центров, через которые осуществляется регуляция активности низкомолекулярными соединениями: ионами Mg2+, Mn2+и Са2+, аденозином и форсколином. Под действием фосфодиэстеразы цАМФ гидролизуется с образованием неактивного 5'-АМФ.
Протеинкиназа — это внутриклеточный фермент, через который цАМФ реализует свой эффект. Протеинкиназа может существовать в 2 формах. В отсутствие цАМФ Протеинкиназа представлена в виде тетрамерного комплекса, состоящего из двух каталитических (С2) и двух регуляторных (R2) субъединиц с мол. массами 49000 и 38000 соответственно; в этой форме фермент неактивен. В присутствии цАМФ протеинкиназный комплекс обратимо диссоциирует на одну R2-субъединицу и две свободные каталитические субъединицы С; последние обладают ферментативной активностью, катализируя фосфорилирование белков и ферментов, соответственно изменяя клеточную активность.
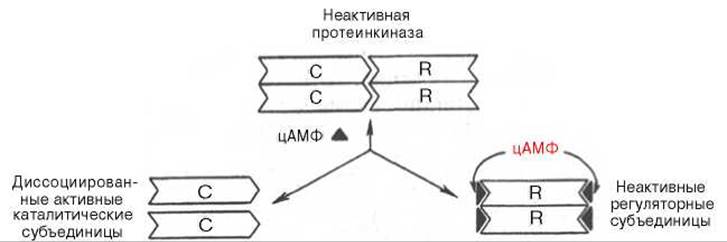
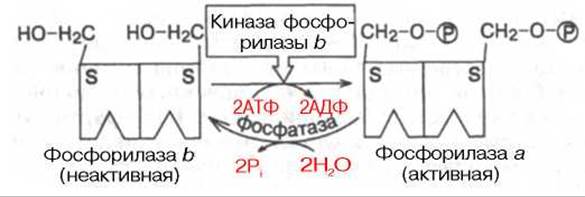
Рис. 8.6. Ковалентная регуляция гликогенфосфорилазы.
Следует отметить, что в клетках открыт большой класс цАМФ-зависимых протеинкиназ*, названных протеинкиназами А; они катализируют перенос фосфатной группы на ОН-группы серина и треонина (так называемые серин-треонин-киназы). Другой класс протеинкиназ, в частности активируемый инсулиновым рецептором (см. ранее), действует только на ОН-группу тирозина. Однако во всех случаях добавление высокозарядной и объемной фосфатной группы вызывает не только конформационные изменения фосфорилированных белков, но изменяет их активность или кинетические свойства.
Активность многих ферментов регулируется цАМФ-зависимым фосфорилированием, соответственно большинство гормонов белково-пептидной природы активирует этот процесс. Однако ряд гормонов оказывает тормозящий эффект на аденилатциклазу, соответственно снижая уровень цАМФ и фосфорилирование белков. В частности, гормон соматостатин, соединяясь со своим специфическим рецептором — ингибиторным G-белком (Gi, являющимся структурным гомологом Gs-белка (см. ранее), ингибирует аденилатциклазу и синтез цАМФ, т.е. вызывает эффект, прямо противоположный вызываемому адреналином и глюкагоном. В ряде органов простагландины (в частности, PGE1) также оказывают ингибиторный эффект на аденилатциклазу, хотя в том же органе (в зависимости от типа клеток) и тот же PGE1 может активировать синтез цАМФ.
Более подробно изучен механизм активирования и регуляции мышечной гликогенфосфорилазы, активирующей распад гликогена. Выделяют 2 формы: каталитически активную — фосфорилаза а и неактивную — фосфорилаза b. Обе фосфорилазы построены из двух идентичных субъединиц (мол. массой 94500), в каждой остаток серина в положении 14 подвергается процессу фосфорилирования—дефосфорилирования, соответственно активированию и инактивированию (рис. 8.6).
Под действием киназы фосфорилазы b, активность которой регулируется цАМФ-зависимой протеинкиназой, обе субъединицы молекулы неактивной формы фосфорилазы b подвергаются ковалентному фосфорилированию и превращаются в активную фосфорилазу а. Дефосфорилирование последней под действием специфической фосфатазы фосфорилазы а приводит к инактивации фермента и возврату в исходное состояние.
В мышечной ткани открыты 3 типа регуляции гликогенфосфорилазы. Первый тип — ковалентная регуляция, основанная на гормонзависимом фосфорилировании — дефосфорилировании субъединиц фосфорилазы (см. рис. 8.6).
* За открытие класса протеинкиназ и фосфатаз Э. Кребс (Edwin Krebs) и Э. Фишер (Edmund Fischer) в 1992 г. были удостоены Нобелевской премии.
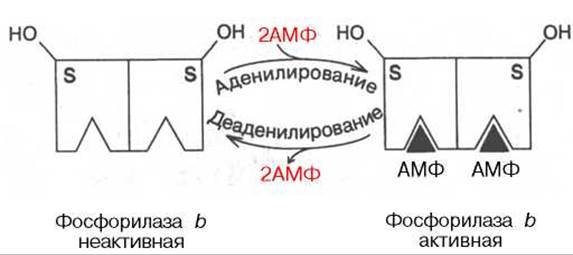
Рис. 8.7. Аллостерическая регуляция гликогенфосфорилазы.
Второй тип — аллостерическая регуляция. Она основана на реакциях аденилирования — деаденилирования субъединиц гликогенфосфорилазы b (соответственно активирование — инактивирование). Направление реакций определяется отношением концентраций АМФ и АТФ, присоединяющихся не к активному центру, а к аллостерическому центру каждой субъединицы (рис. 8.7).
В работающей мышце накопление АМФ, обусловленное тратой АТФ, вызывает аденилирование и активирование фосфорилазы b. В покое, наоборот, высокие концентрации АТФ, вытесняя АМФ, приводят к аллостерическому ингибированию этого фермента путем деаденилирования.
цАМФ и протеинкиназа играют центральную роль в гормональной регуляции синтеза и распада гликогена в печени (рис. 8.8). Подробно о химических превращениях гликогена см. в главе 10*.
Третий тип — кальциевая регуляция, основанная на аллостерическом активировании киназы фосфорилазы b ионами Са2+, концентрация которых повышается при мышечном сокращении, способствуя тем самым образованию активной фосфорилазы а.