Биологическая химия - Березов Т. Т., Коровкин Б. Ф. 1998
Химия белков
Физико-химические свойства белков
Молекулярная масса белков
Наиболее характерными физико-химическими свойствами белков являются высокая вязкость растворов, незначительная диффузия, способность к набуханию в больших пределах, оптическая активность, подвижность в электрическом поле, низкое осмотическое давление и высокое онкотическое давление, способность к поглощению УФ-лучей при 280 нм (это свойство, обусловленное наличием в белках ароматических аминокислот, используется для количественного определения белков).
Белки, как и аминокислоты, амфотерны благодаря наличию свободных NH2- и СООН-групп. Для них характерны все свойства кислот и оснований. В зависимости от реакции среды и соотношения кислых и основных аминокислот белки в растворе несут или отрицательный, или положительный заряд, перемещаясь к аноду или катоду. Это свойство используется при очистке белков методом электрофореза.
Белки относятся к высокомолекулярным соединениям, в состав которых входят сотни и даже тысячи аминокислотных остатков, объединенных в макромолекулярную структуру. Молекулярная масса белков колеблется от 6000 (нижний предел) до 1000000 и выше в зависимости от количества отдельных полипептидных цепей в составе единой молекулярной структуры белка. Такие полипептидные цепи получили название субъединиц. Их мол. масса варьирует в широких пределах — от 6000 до 100000 и более.
Аминокислотный состав и последовательность аминокислот выяснены для многих тысяч белков. В связи с этим стало возможным вычисление их молекулярной массы химическим путем с высокой точностью. Однако для огромного количества встречающихся в природе белков химическое строение не выяснено, поэтому основными методами определения молекулярной массы все еще остаются физико-химические методы (гравиметрические, осмометрические, вискозиметрические, электрофоретические, оптические и др.). На практике наиболее часто используются методы седиментационного анализа, гель-хроматография и гель-электрофорез. Определение молекулярной массы белков методами седиментационного анализа проводят в ультрацентрифугах*, в которых удается создать центробежные ускорения (g), превышающие в 200000 и более раз ускорение земного притяжения. Обычно вычисляют молекулярную массу по скорости седиментации молекул белка или седиментационному равновесию. По мере перемещения молекул от центра к периферии образуется резкая граница растворитель- белок (регистрируется автоматически). Оптические свойства растворителя и белка используются при определении скорости седиментации; последнюю выражают через константу седиментации s, которая зависит как от массы, так и от формы белковой частицы:
![]()
где v - скорость перемещения границы растворитель-белок, см/с; ω — угловая скорость ротора, рад/с; r — расстояние от центра ротора до середины ячейки с раствором белка, см. Константа седиментации имеет размерность времени (ее выражают в секундах). Величина константы седиментации, равная 1 ∙ 10-13 с, условно принята за единицу и названа сведбергом (S). Значения констант седиментации большинства белков лежат в пределах 1-50 S, хотя в ряде случаев эти значения превышают 100 S.
* Впервые ультрацентрифуга была сконструирована шведским ученым Т. Сведбергом. Прибор был снабжен оптической приставкой, способной периодически через равные промежутки времени фотографировать процесс осаждения (седиментации) белковых частиц.
Для вычисления молекулярной массы (М), помимо константы седиментации, необходимы дополнительные сведения о плотности растворителя и белка и другие согласно уравнению Сведберга:
![]()
где R — газовая постоянная, эрг/(моль ∙ град); Т — абсолютная температура (по шкале Кельвина); s — константа седиментации; р — плотность растворителя; v — парциальный удельный объем молекулы белка; D - коэффициент диффузии.
Определение молекулярной массы белков методом ультрацентрифугирования требует много времени и сложной и дорогостоящей аппаратуры. Поэтому в последние годы разработаны два более простых метода (гель-хроматография и электрофорез). При использовании гель-хроматографии в первую очередь требуется откалибровать колонку. Для этого через колонку с сефадексом пропускают несколько белков с известными молекулярными массами и строят график, откладывая значения логарифмов молекулярной массы против их элюционных объемов, которые находят, как показано на рис. 1.9.
Известно, что между логарифмом молекулярной массы белка, имеющего сферическую форму, и элюционным объемом существует прямая зависимость. Поэтому легко определить молекулярную массу исследуемого белка, зная его объем элюции. Второй разновидностью этого метода является тонкослойная гель-хроматография. Длина пробега белка (в миллиметрах) через тонкий слой сефадекса находится в логарифмической зависимости от молекулярной массы белка (рис. 1.10).
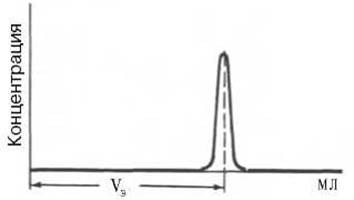
Рис. 1.9. Измерение объема элюции (Vэ).
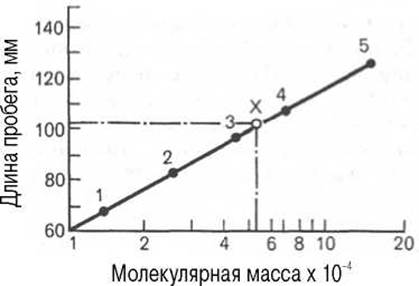
Рис. 1.10. Зависимость между длиной пробега белковых частиц при гель-хроматографии в тонком слое сефадекса Г-150 (сверхтонкого) и их молекулярными массами (в полулогарифмической системе координат).
1 - рибонуклеаза; 2 - химотрипсиноген; 3 - яичный альбумин; 4 - сывороточный альбумин; 5 - y-глобулин; Х - белок с неизвестной молекулярной массой.
Гель-хроматография, кроме простоты и быстроты, имеет дополнительное преимущество: не требуется выделять белок в чистом виде, так как примеси других белков не мешают определению, поскольку каждый из них проходит через колонку со свойственной ему скоростью, определяемой молекулярной массой. Это обстоятельство широко используется в энзимологии, когда оказывается возможным определение молекулярной массы даже очень небольшого количества фермента в присутствии других белков, не обладающих аналогичной каталитической активностью.
При использовании диск-электрофореза в полиакриламидном геле для определения молекулярной массы белков также строят график зависимости между логарифмом молекулярной массы калибровочных белков и подвижностью белковых частиц в полиакриламидном геле, а затем, определив подвижность исследуемого белка, по графику находят его массу (рис. 1.11). Электрофорез проводят в присутствии детергента додецилсульфата натрия, так как только в этом случае наблюдается прямая пропорциональная зависимость между молекулярной массой и подвижностью белков. Белки с четвертичной структурой при этих условиях распадаются на субъединицы, поэтому метод находит широкое применение для определения молекулярной массы субъединиц белка.

Рис. 1.11. Зависимость между молекулярной массой и относительной подвижностью белка при диск-электрофорезе в полиакриламидном геле в присутствии додецилсульфата натрия (в полулогарифмической системе координат).
1 - сывороточный альбумин; 2 - яичный альбумин; 3 - пепсин; 4 - химотрипсиноген; 5 - миоглобин; 6 - цитохром с; Х - белок с неизвестной молекулярной массой.
Недавно предложен новый масс-спектрометрический метод (так называемый лазерный десорбционно-ионизационный метод), позволяющий определять молекулярную массу небольших пептидов (вазопрессин, инсулин) и крупных биополимерных молекул и, кроме того, структуру биомолекул.