Биологическая химия - Березов Т. Т., Коровкин Б. Ф. 1998
Метаболизм углеводов
Цикл трикарбоновых кислот (цикл Кребса)
Цикл трикарбоновых кислот впервые был открыт английским биохимиком Г. Кребсом *.
Он первым постулировал значение данного цикла для полного сгорания пирувата, главным источником которого является гликолитическое превращение углеводов. В дальнейшем было показано, что цикл трикарбоновых кислот является тем центром, в котором сходятся практически все метаболические пути. Таким образом, цикл Кребса — общий конечный путь окисления ацетильных групп (в виде ацетил-КоА), в которые превращается в процессе катаболизма большая часть органических молекул, играющих роль «клеточного топлива»: углеводов, жирных кислот и аминокислот.
Образовавшийся в результате окислительного декарбоксилирования пирувата в митохондриях ацетил-КоА вступает в цикл Кребса. Данный цикл происходит в матриксе митохондрий и состоит из восьми последовательных реакций (рис. 10.9). Начинается цикл с присоединения ацетил-КоА к оксалоацетату и образования лимонной кислоты (цитрата). Затем лимонная кислота (шестиуглеродное соединение) путем ряда дегидрирований (отнятие водорода) и двух декарбоксилирований (отщепление СО2) теряет два углеродных атома и снова в цикле Кребса превращается в оксалоацетат (четырехуглеродное соединение), т.е. в результате полного оборота цикла одна молекула ацетил-КоА сгорает до СО2 и Н2О, а молекула оксалоацетата регенерируется. Рассмотрим все восемь последовательных реакций (этапов) цикла Кребса.
* За это выдающееся открытие Г. Кребс получил Нобелевскую премию в 1953 г. (совместно с Ф. Липманом). Цикл трикарбоновых кислот часто называют его именем - цикл Кребса (цикл лимонной кислоты Кребса).

Рис. 10.9. Цикл трикарбоновых кислот (цикл Кребса).
Первая реакция катализируется ферментом цитрат-синтазой, при этом ацетильная группа ацетил-КоА конденсируется с оксалоацетатом, в результате чего образуется лимонная кислота:
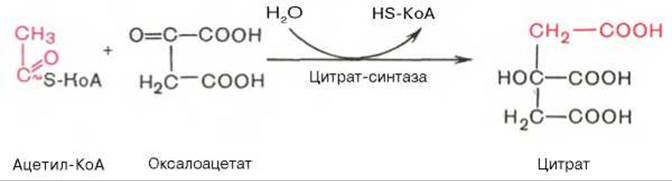
По-видимому, в данной реакции в качестве промежуточного продукта образуется связанный с ферментом цитрил-КоА. Затем последний самопроизвольно и необратимо гидролизуется с образованием цитрата и HS-KoA.
В результате второй реакции образовавшаяся лимонная кислота подвергается дегидратированию с образованием цис-аконитовой кислоты, которая, присоединяя молекулу воды, переходит в изолимонную кислоту (изоцитрат). Катализирует эти обратимые реакции гидратации—дегидратации фермент аконитатгидратаза (аконитаза). В результате происходит взаимоперемещение Н и ОН в молекуле цитрата:

Третья реакция, по-видимому, лимитирует скорость цикла Кребса. Изолимонная кислота дегидрируется в присутствии НАД-зависимой изоцитратдегидрогеназы*.

В ходе изоцитратдегидрогеназной реакции изолимонная кислота одновременно декарбоксилируется. НАД-зависимая изоцитратдегидрогеназа является аллостерическим ферментом, которому в качестве специфического активатора необходим АДФ. Кроме того, фермент для проявления своей активности нуждается в ионах Mg2+ или Мn2+.
Во время четвертой реакции происходит окислительное декарбоксилирование а-кетоглутаровой кислоты с образованием высокоэнергетического соединения сукцинил-КоА. Механизм этой реакции сходен с таковым реакции окислительного декарбоксилирования пирувата до ацетил-КоА, а-кетоглутаратдегидрогеназный комплекс напоминает по своей структуре пируватдегидрогеназный комплекс. Как в одном, так и в другом случае в реакции принимают участие 5 коферментов: ТПФ, амид липоевой кислоты, HS-KoA, ФАД и НАД+.

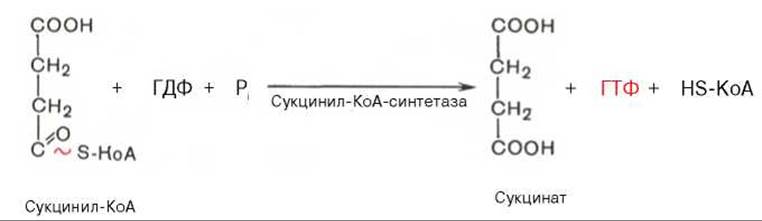
Пятая реакция катализируется ферментом сукцинил-КоА-синтетазой. В ходе этой реакции сукцинил-КоА при участии ГТФ и неорганического фосфата превращается в янтарную кислоту (сукцинат). Одновременно происходит образование высокоэргической фосфатной связи ГТФ** за счет высокоэргической тиоэфирной связи сукцинил-КоА:
* В митохондриях существует 2 типа изоцитратдегидрогеназ: НАД- и НАДФ-зависимый; первый тип встречается только в митохондриях, второй - как в митохондриях, так и в цитозоле.
** Образовавшийся ГТФ отдает затем свою концевую фосфатную группу на АДФ, вследствие чего образуется АТФ. Образование высокоэргического нуклеозидтрифосфата в ходе сукцинил-КоА-синтетазной реакции - еще один пример фосфорилирования на уровне субстрата (субстратное фосфорилирование).
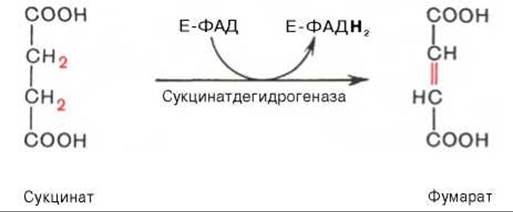
В результате шестой реакции сукцинат дегидрируется в фумаровую кислоту. Окисление сукцината катализируется сукцинатдегидрогеназой, в молекуле которой с белком прочно (ковалентно) связан кофермент ФАД. В свою очередь сукцинатдегидрогеназа прочно связана с внутренней митохондриальной мембраной:
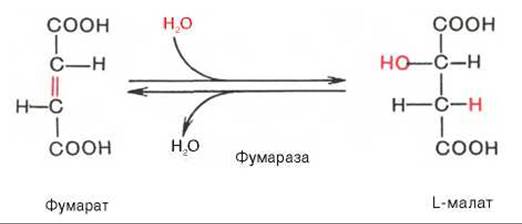
Седьмая реакция осуществляется под влиянием фермента фумаратгидратазы (фумаразы). Образовавшаяся при этом фумаровая кислота гидратируется, продуктом реакции является яблочная кислота (малат). Следует отметить, что фумаратгидратаза обладает стереоспецифичностью (см. главу 4) — в ходе реакции образуется L-яблочная кислота:
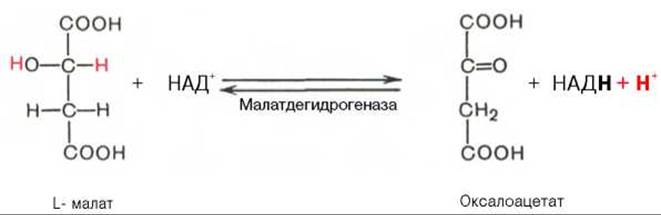
Наконец, в ходе восьмой реакции цикла трикарбоновых кислот под влиянием митохондриальной НАД-зависимой малатдегидрогеназы происходит окисление L-малата в оксалоацетат:
Как видно, за один оборот цикла, состоящего из восьми ферментативных реакций, происходит полное окисление («сгорание») одной молекулы ацетил-КоА. Для непрерывной работы цикла необходимо постоянное поступление в систему ацетил-КоА, а коферменты (НАД+ и ФАД), перешедшие в восстановленное состояние, должны снова и снова окисляться. Это окисление осуществляется в системе переносчиков электронов в дыхательной цепи (в цепи дыхательных ферментов), локализованной в мембране митохондрий. Образовавшийся ФАДН2 прочно связан с СДГ, поэтому он передает атомы водорода через KoQ. Освобождающаяся в результате окисления ацетил-КоА энергия в значительной мере сосредоточивается в макроэргических фосфатных связях АТФ. Из 4 пар атомов водорода 3 пары переносят НАДН на систему транспорта электронов; при этом в расчете на каждую пару в системе биологического окисления образуется 3 молекулы АТФ (в процессе сопряженного окислительного фосфорилирования), а всего, следовательно, 9 молекул АТФ (см. главу 9). Одна пара атомов от сукцинатдегидрогеназы-ФАДН2 попадает в систему транспорта электронов через KoQ, в результате образуется только 2 молекулы АТФ. В ходе цикла Кребса синтезируется также одна молекула ГТФ (субстратное фосфорилирование), что равносильно одной молекуле АТФ. Итак, при окислении одной молекулы ацетил-КоА в цикле Кребса и системе окислительного фосфорилирования может образоваться 12 молекул АТФ.
Если подсчитать полный энергетический эффект гликолитического расщепления глюкозы и последующего окисления двух образовавшихся молекул пирувата до СО2 и Н2О, то он окажется значительно большим.
Как отмечалось, одна молекула НАДН (3 молекулы АТФ)* образуется при окислительном декарбоксилировании пирувата в ацетил-КоА. При расщеплении одной молекулы глюкозы образуется 2 молекулы пирувата, а при окислении их до 2 молекул ацетил-КоА и последующих 2 оборотов цикла трикарбоновых кислот синтезируется 30 молекул АТФ (следовательно, окисление молекулы пирувата до СО2 и Н2О дает 15 молекул АТФ). К этому количеству надо добавить 2 молекулы АТФ, образующиеся при аэробном гликолизе, и 6 молекул АТФ, синтезирующихся за счет окисления 2 молекул внемитохондриального НАДН, которые образуются при окислении 2 молекул глицеральдегид-3-фосфата в дегидрогеназной реакции гликолиза. Следовательно, при расщеплении в тканях одной молекулы глюкозы по уравнению С6Н12О6 + 6О2 —> 6СО2 + 6Н2О синтезируется 38 молекул АТФ. Несомненно, что в энергетическом отношении полное расщепление глюкозы является более эффективным процессом, чем анаэробный гликолиз.
Необходимо отметить, что образовавшиеся в процессе превращения глицеральдегид-3-фосфата 2 молекулы НАДН в дальнейшем при окислении могут давать не 6 молекул АТФ, а только 4. Дело в том, что сами молекулы внемитохондриального НАДН не способны проникать через мембрану внутрь митохондрий. Однако отдаваемые ими электроны могут включаться в митохондриальную цепь биологического окисления с помощью так называемого глицеролфосфатного челночного механизма (рис. 10.10). Цитоплазматический НАДН сначала реагирует с цитоплазматическим дигидроксиацетонфосфатом, образуя глицерол-3-фосфат. Реакция катализируется НАД-зависимой цитоплазматической глицерол-3-фосфат-дегидрогеназой:
Дигидроксиацетонфосфат + НАДН + Н+ <=> Глицерол-3-фосфат + НАД+.
* Напомним, что при прохождении по цепи дыхательных ферментов восстановительные эквиваленты НАДН генерируют три высокоэнергетические фосфатные связи посредством образования АТФ из АДФ в процессе окислительного фосфорилирования (см. главу 9).
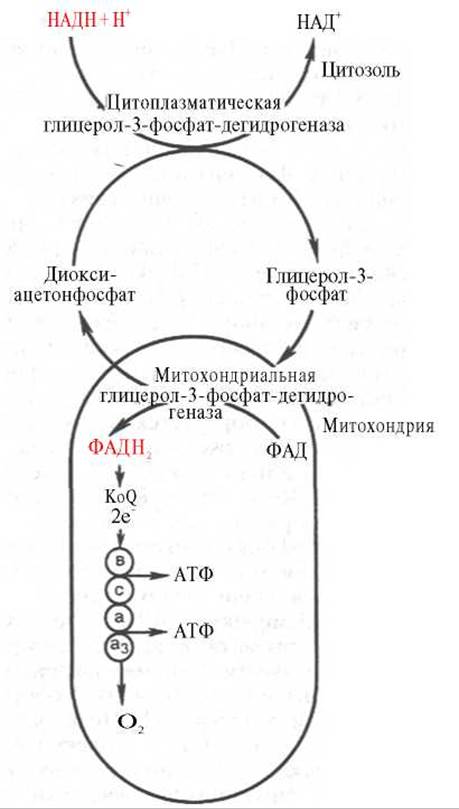
Рис. 10.10. Глицеролфосфатный челночный механизм. Объяснение в тексте.
Образовавшийся глицерол-3-фосфат легко проникает через митохондриальную мембрану. Внутри митохондрии другая (митохондриальная) глицерол-3-фосфат-дегидрогеназа (флавиновый фермент) снова окисляет глицерол-3-фосфат до диоксиацетонфосфата:
Глицерол-3-фосфат + ФАД <=> Диоксиацетонфосфат + ФАДН2.
Восстановленный флавопротеин (фермент-ФАДН2) вводит на уровне KoQ приобретенные им электроны в цепь биологического окисления и сопряженного с ним окислительного фосфорилирования, а диоксиацетонфосфат выходит из митохондрий в цитоплазму и может вновь взаимодействовать с цитоплазматическим НАДН + Н+. Таким образом, пара электронов (из одной молекулы цитоплазматического НАДН + Н), вводимая в дыхательную цепь с помощью глицеролфосфатного челночного механизма, дает не 3, а 2 АТФ.
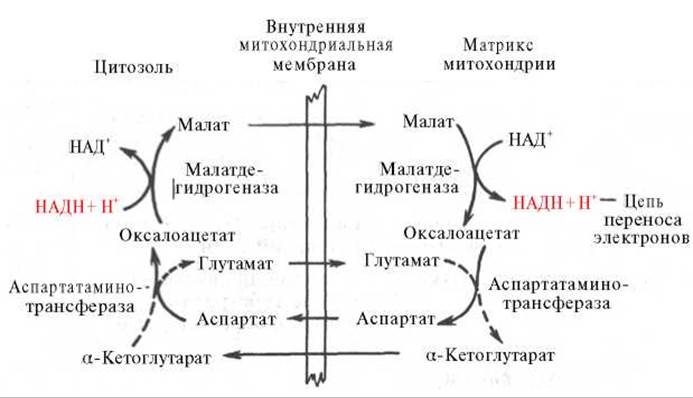
Рис. 10.11. Малат-аспартатная челночная система для переноса восстанавливающих эквивалентов от цитозольного НАДН в митохондриальный матрикс. Объяснение в тексте.
В дальнейшем было показано, что с помощью данного челночного механизма лишь в скелетных мышцах и мозге осуществляется перенос восстановленных эквивалентов от цитозольного НАДН + Н+ в митохондрии.
В клетках печени, почек и сердца действует более сложная малат-аспартатная челночная система. Действие такого челночного механизма становится возможным благодаря присутствию малатдегидрогеназы и аспартатаминотрансферазы как в цитозоле, так и в митохондриях.
Установлено, что от цитозольного НАДН + Н+ восстановленные эквиваленты сначала при участии фермента малатдегидрогеназы (рис. 10.11) переносятся на цитозольный оксалоацетат. В результате образуется малат, который с помощью системы, транспортирующей дикарбоновые кислоты, проходит через внутреннюю мембрану митохондрии в матрикс. Здесь малат окисляется в оксалоацетат, а матриксный НАД+ восстанавливается в НАДН + Н+, который может теперь передавать свои электроны в цепь дыхательных ферментов, локализованную на внутренней мембране митохондрии. В свою очередь образовавшийся оксалоацетат* в присутствии глутамата и фермента АсАТ вступает в реакцию трансаминирования. Образующиеся аспарат и а-кетоглутарат с помощью специальных транспортных систем способны проходить через мембрану митохондрий.
Транспортирование в цитозоле регенерирует оксалоацетат, что вызывает к действию следующий цикл. В целом процесс включает легкообратимые реакции, происходит без потребления энергии, «движущей силой» его является постоянное восстановление НАД+ в цитозоле глицеральдегид-3-фосфатом, образующимся при катаболизме глюкозы.
Итак, если функционирует малат-аспартатный механизм, то в результате полного окисления одной молекулы глюкозы может образоваться не 36, а 38 молекул АТФ (табл. 10.1).
* Образовавшийся оксалоацетат непосредственно не может возвратиться в цитозоль через мембрану.
Таблица 10.1. Образование высокоэргических фосфатных связей в ходе катаболизма глюкозы
Метаболический путь |
Фермент |
Место образования АТФ (точнее, высокоэргической связи) и сопряженный процесс |
Число АТФ, образовавшихся на 1 моль глюкозы |
Гликолиз |
Глицеральдегид-3-фосфатдегидрогеназа |
Окисление 2НАДН в дыхательной цепи |
6* |
Фосфоглицераткиназа |
Фосфорилирование на уровне субстрата (субстратное фосфорилирование) |
2 |
|
Пируваткиназа |
То же |
2 |
|
Итого... |
10 |
||
|
С учетом расходования АТФ в реакциях, катализируемых гексокиназой и фосфофруктокиназой |
-2 |
||
Итого... |
8 |
||
Окислительное декарбоксилирование пировиноградной кислоты |
Пируватдегидрогеназа (пируватдегидрогеназный комплекс) |
Окисление 2НАДН в дыхательной цепи |
6 |
Итого... |
6 |
||
Цикл лимонной кислоты (цикл Кребса) |
Изоцитратдегидрогеназа |
Окисление 2НАДН в дыхательной цепи |
6 |
а-Кетоглутаратдегидрогеназа |
То же |
6 |
|
Сукцинил-КоА-синтетаза (сукцинаттиокиназа) |
Фосфорилирование на уровне субстрата (субстратное фосфорилирование) |
2 |
|
Сукцинатдегидрогеназа |
Окисление 2 ФАДН2 в дыхательной цепи |
4 |
|
Малатдегидрогеназа |
Окисление 2НАДН в дыхательной цепи |
6 |
|
Итого... |
24 |
||
Всего |
на 1 моль глюкозы в |
аэробных условиях... |
38 АТФ |
* Считают, что НАДН, образовавшийся в ходе гликолиза, поступает в митохондрию с помощью малатного челночного механизма (см. с. 351). Если используется глицерофосфатный челночный механизм, то образуется только 2 АТФ на 1 моль НАДН и количество образовавшихся всего высокоэргических фосфатных связей будет не 38, а 36.
В табл. 10.1 приведены реакции, в которых происходит образование высокоэргических фосфатных связей в ходе катаболизма глюкозы, с указанием эффективности процесса в аэробных и анаэробных условиях.