Биологическая химия - Березов Т. Т., Коровкин Б. Ф. 1998
Обмен простых белков
Переваривание белков
Главными источниками белков для человека являются пищевые продукты животного и растительного происхождения. В табл. 12.4 представлены средние данные о содержании белка в основных пищевых продуктах. Главным образом животные (мясо, рыба, сыр) и только некоторые растительные (горох, соя) продукты богаты белками, в то время как наиболее распространенные растительные пищевые продукты содержат небольшие количества его.
Таблица 12.4. Содержание белка в некоторых пищевых продуктах
Продукт |
Содержание белка, % |
Продукт |
Содержание белка, % |
Мясо |
18-22 |
Гречневая крупа |
11 |
Рыба |
17-22 |
Пшено |
10 |
Сыр |
20-36 |
Орехи лесные |
12 |
Яйца |
13 |
» кедровые |
4 |
Молоко |
3,5 |
Картофель |
1,5-2 |
Хлеб ржаной |
7,8 |
Капуста |
1,1-1,6 |
Рис |
8 |
Морковь |
0,8-1,6 |
Горох |
26 |
Свекла |
1,6 |
Соя |
35 |
Яблоки |
0,3-0,4 |
Макароны |
9-13 |
Вишня |
1-1,1 |
Весь сложный процесс переваривания пищевых белков в пищеварительном тракте «настроен» таким образом, чтобы путем последовательного действия протеолитических ферментов лишить белки пищи видовой и тканевой специфичности и придать продуктам распада способность всасываться в кровь через стенку кишечника. Примерно 95—97% белков пищи всасывается в виде свободных аминокислот. Следовательно, ферментный аппарат пищеварительного тракта осуществляет поэтапное, строго избирательное расщепление пептидных связей белковой молекулы вплоть до конечных продуктов гидролиза белков — свободных аминокислот. Гидролиз заключается в разрыве пептидных связей —СО—NH— белковой молекулы.
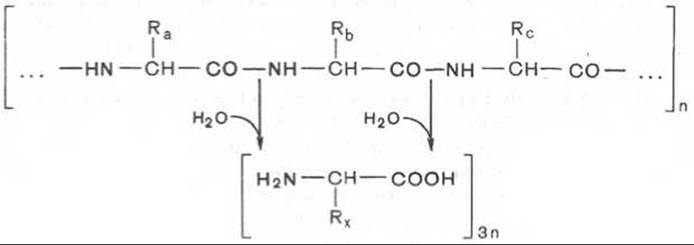
Протеолитические ферменты (протеиназы) обладают широкой специфичностью действия, определяемой как размером полипептида, так и структурой радикалов аминокислот, участвующих в образовании пептидной связи. Основные ферменты, катализирующие гидролитический распад пищевых белков и пептидов, приведены в табл. 12.5.
Следует подчеркнуть, что с пищей человек получает огромное разнообразие белков, однако все они подвергаются воздействию ограниченного числа протеиназ. Эти ферменты относятся к классу гидролаз (см. главу 4) и часто называются также пептидазами. Известны две группы пептидаз: экзопептидазы, катализирующие разрыв концевой пептидной связи с освобождением одной какой-либо концевой аминокислоты, и эндопептидазы, преимущественно гидролизующие пептидные связи внутри полипептидной цепи. Эндопептидазы обладают разной субстратной специфичностью действия, всецело определяемой природой радикалов аминокислот по соседству с разрываемой пептидной связью, поэтому белковая молекула распадается под действием разных эндопептидаз на строго определенное число пептидов, сравнительно легко идентифицируемых методами хроматографии и электрофореза (метод отпечатков пальцев). Это свойство эндопептидаз нашло широкое применение в исследовательской работе при выяснении первичной структуры индивидуальных белков.
Таблица 12.5. Протеолитические ферменты пищеварительного тракта
Источник |
Фермент |
Примечание |
Желудочный сок |
Пепсин |
Протеиназа (найден также в желудочном соке птиц, рептилий и рыб) |
» » |
Реннин |
Вызывает свертывание молока |
» » |
Гастриксин |
Пепсиноподобный фермент |
Панкреатический сок |
Трипсин |
Протеиназа |
» » |
Химотрипсин |
» |
» » |
Коллагеназа |
» |
» » |
Карбоксипептидаза |
Пептидаза |
» » |
Эластаза |
» |
Кишечный сок |
Аминопептидаза |
» |
» » |
Лейцинаминопептидаза |
» |
» » |
Аланинаминопептидаза |
» |
» » |
Энтеропептидаза |
Гликопротеин |
» » |
Трипептидазы |
Пептидазы |
» » |
Дипептидазы |
» |
» » |
Пролил-дипептидаза |
» |
» » |
Пролин-дипептидаза |
» |