Биологическая химия - Березов Т. Т., Коровкин Б. Ф. 1998
Обмен простых белков
Специфические пути обмена некоторых аминокислот
Обмен дикарбоновых аминокислот
Классическими работами советских ученых А.Е. Браунштейна и С.Р. Мардашева и американского биохимика А. Майстера доказана роль дикарбоновых аминокислот (глутаминовой и аспарагиновой кислот и их амидов — глутамина и аспарагина) в интеграции азотистого обмена в организме. Система дикарбоновых аминокислот, к которой относят также соответствующие а-кетокислоты, теснейшим образом связана не только с азотистым метаболизмом в целом, но и с обменом липидов и углеводов. Ранее отмечалась особая роль дикарбоновых аминокислот и ферментов, катализирующих их превращения, в перераспределении азота в организме, дезаминировании и синтезе природных аминокислот (реакции трансдезаминирования и трансреаминирования), в образовании конечных продуктов белкового обмена — синтезе мочевины.
Основные катаболические пути превращения дикарбоновых аминокислот и их амидов могут быть представлены в виде следующих реакций:
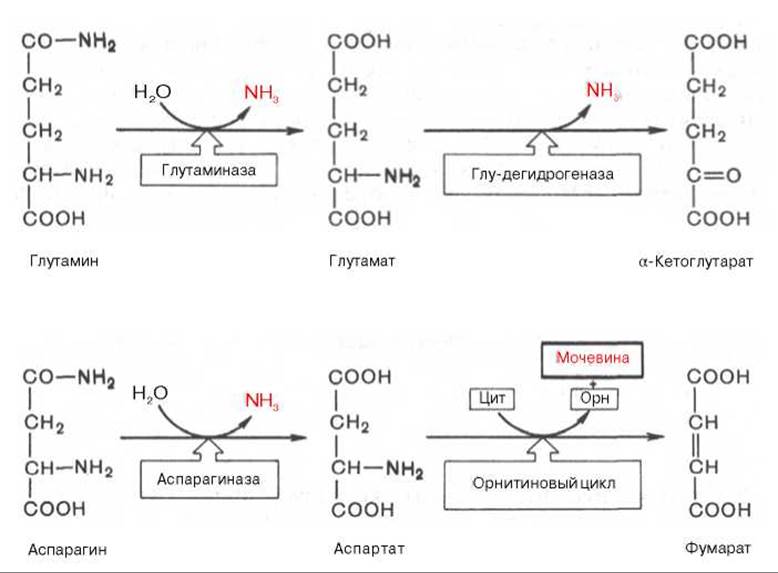
Аспарагиновая кислота принимает непосредственное участие в орнитиновом цикле мочевинообразования, в реакциях трансаминирования и биосинтезе углеводов (гликогенная аминокислота), карнозина и ансерина, пуриновых и пиримидиновых нуклеотидов (см. главу 14), а также в синтезе N-ацетиласпарагиновой кислоты в ткани мозга. Роль последней, содержащейся в довольно высоких концентрациях в ткани мозга млекопитающих, пока не выяснена.
Глутаминовая кислота, являющаяся гликогенной и заменимой аминокислотой для человека и животных, также включается в синтез ряда специфических метаболитов, в частности глутатиона и глутамина. Помимо участия в транспорте аммиака и регуляции кислотно-щелочного равновесия, глутамин — это незаменимый источник азота в ряде синтезов, в частности в биосинтезе пуриновых и пиримидиновых нуклеотидов, аминосахаров, в обезвреживании фенилуксусной кислоты (синтез фенилацетилглутамина) у человека и человекообразных обезьян, а также в синтезе витамина фолиевой кислоты (птероилглутаминовая кислота). На рис. 12.8 суммированы реакции синтеза ряда веществ, в которых амидный азот глутамина выполняет специфическую роль, незаменимую азотом других аминокислот*.
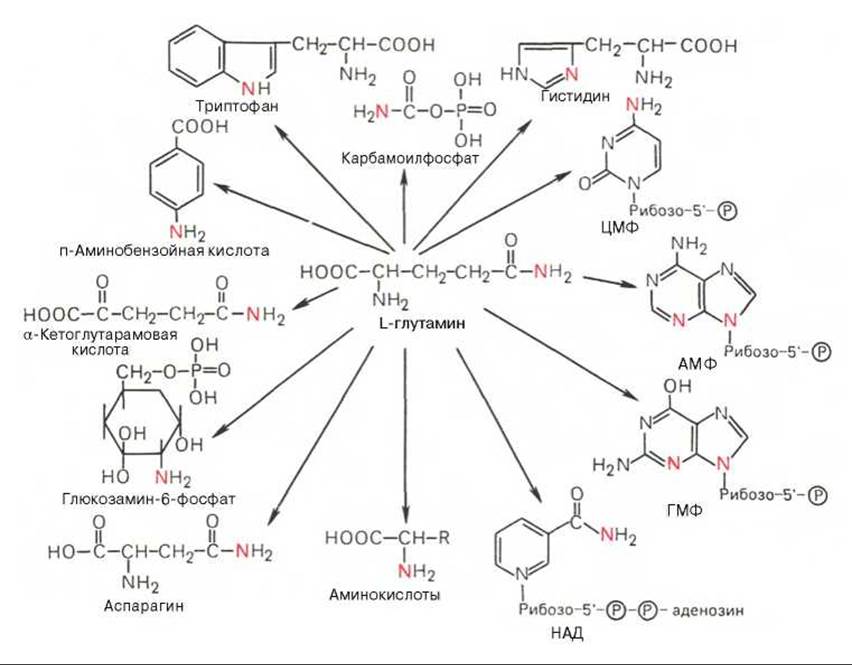
Рис. 12.8. Использование амидного азота глутамина для синтеза различных соединений в живых организмах.
Глутамин и аспарагин оказались, кроме того, эссенциальными факторами для роста некоторых нормальных и опухолевых клеток в культуре ткани; они не могут быть заменены ни друг другом, ни соответствующими дикарбоновыми аминокислотами. Это свидетельствует о том, что в условиях выращивания клеток в культуре ткани некоторые клетки теряют способность синтезировать эти амиды синтетазным или трансаминазным путем.
В лаборатории Майстера получены доказательства, что глутамин и аспарагин в животных тканях подвергаются сочетанному трансаминированию и дезамидированию под влиянием специфических трансаминаз амидов (глутаминтрансаминазы и аспарагинтрансаминазы) и неспецифической ω-амидазы:
* В указанных синтетазных реакциях участвует специфический класс ферментов - глутаминамидотрансферазы. Они содержат глутаминсвязывающий домен, содержащий консервативную АМК-последовательность и акцепторный домен с вариабельной областью для связывания второго субстрата. По своему механизму действия эти ферменты близки к глутаминазе (см. далее), однако последняя не нуждается во втором субстрате.
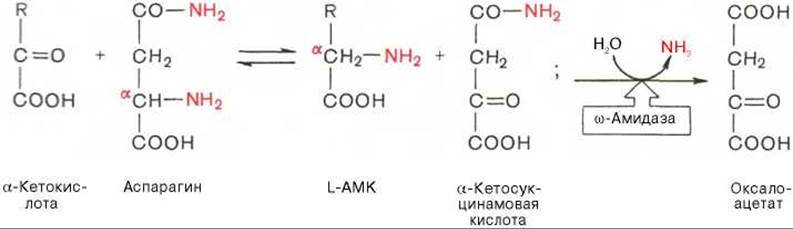
Таким образом, в реакции переноса участвует а-аминогруппа аспарагина, а не амидная группа, как предполагали раньше; в то же время амидная группа промежуточного соединения а-кетосукцинамовой кислоты в дальнейшем освобождается в процессе гидролиза в виде аммиака. Трансаминирование — обратимый процесс, поэтому лимитирующими факторами в синтезе аспарагина (и глутамина) являются ω-амиды оксалоацетата и а-кетоглутаровой кислоты, синтез которых в животных тканях пока не доказан.
Глутаминовая кислота является одним из немногих соединений, помимо глюкозы, которые служат энергетическим материалом для ткани мозга. Ранее была отмечена высокая активность в ткани мозга глутаматдекарбоксилазы, катализирующей превращение глутамата в у-аминомасляную кислоту (ГАМК). Дальнейшее последовательное окисление ГАМК включает трансаминирование с образованием полуальдегида янтарной кислоты, окисление в янтарную кислоту и, наконец, окисление через ЦТК.
В обеих реакциях (декарбоксилирование глутамата и трансаминирование ГАМК) участвует пиридоксальфосфат, который оказался более прочно связанным с ГАМК-трансаминазой. ГАМК оказывает тормозящий эффект на синаптическую передачу в ЦНС, поэтому судорожные явления, наблюдаемые при недостаточности витамина В6, могут быть связаны со снижением образования ГАМК в глутаматдекарбоксилазной реакции. У животных судороги могут быть вызваны также введением изониазида, который связывает альдегидную группу кофермента или антивитаминов В6, в частности метоксипиридоксина. ГАМК — естественно встречающийся «транквилизатор», поэтому одним из путей повышения ее концентрации в ЦНС является введение веществ, оказывающих тормозящее действие на ГАМК-трансаминазу, которая эффективно устраняет ГАМК.
В последние годы у бактерий и растений (но не в животных тканях) открыт совершенно новый путь синтеза глутаминовой кислоты из а-кето-глутаровой кислоты и глутамина. Этот путь, получивший название глутаматсинтазного цикла, включает две сопряженные с распадом АТФ необратимые реакции, ведущие к усвоению (ассимиляции) аммиака:
а) NH3 + Глутамат + АТФ —> Глутамин + АДФ + Рi
б) Глутамин + а-Кетоглутарат + НАДФН + Н+ —> 2Глутамат + НАДФ+
NH3 + а-Кетоглутарат + НАДФН + Н+ + АТФ —> Глутамат + НАДФ+ + АДФ + Рi
Первую стадию (а) катализирует глутаминсинтетаза, которая имеется в клетках животных, вторую (б) — глутаматсинтаза, открытая только у растений, грибов и микроорганизмов. Обе стадии могут быть представлены вместе с обратимо действующей глутаматдегидрогеназной реакцией (в) в виде следующей схемы:

Оказалось, что при низких концентрациях аммиака, характерных для растений и микроорганизмов, реакции протекают преимущественно по глутаматсинтазному циклу, а при высоких его концентрациях, свойственных тканям животных, — по глутаматдегидрогеназному пути; в обоих случаях синтезируется глутамат.
В сводной схеме обобщены главные интегративные пути превращения глутамина и глутаминовой кислоты и приведены названия ферментов, катализирующих эти реакции в тканях (рис. 12.9).
С метаболизмом глутаминовой кислоты связаны также пути обмена пролина и аргинина (см. рис. 12.9), хотя следует напомнить, что аргинин относится к частично незаменимым аминокислотам организма, особенно в молодом возрасте, когда его синтез из глутамата не может обеспечить потребности быстрого роста организма. Основным путем метаболизма аргинина является путь синтеза мочевины. Более специфичен и необратим путь превращения гистидина (также частично незаменимая для животных аминокислота) в глутаминовую кислоту. В этом превращении участвуют два хорошо изученных фермента — гистидинаммиаклиаза (гистидаза), катализирующая внутримолекулярное дезаминирование гистидина, и уроканиназа, которая катализирует разрыв имидазольного кольца уроканиновой кислоты с образованием имидазолилпропионовой кислоты; последняя через формиминоглутамат превращается в глутаминовую кислоту. Другие пути обмена гистидина (образование гистамина и окисление его под действием диаминоксидазы) были рассмотрены ранее.
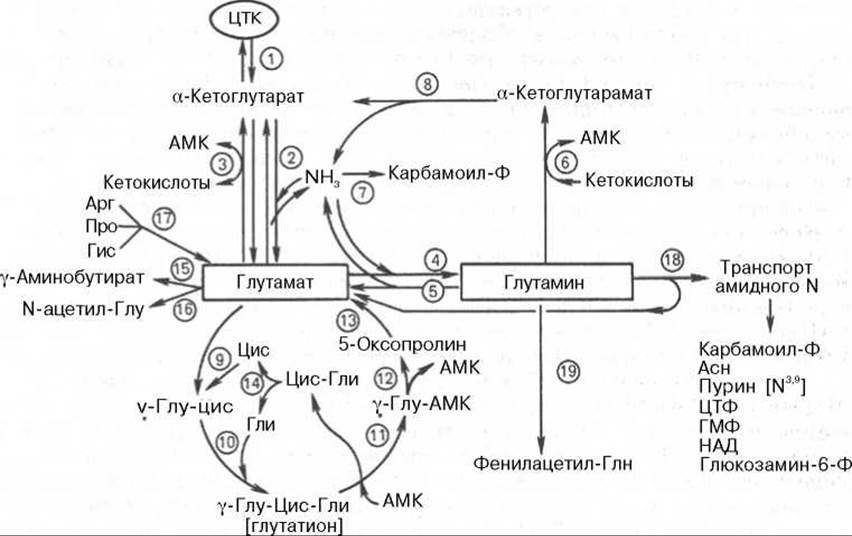
Рис. 12.9. Метаболические превращения глутамата и глутамина в тканях животных (схема по Майстеру).
1 - реакции цикла лимонной кислоты; 2 - глутаматдегидрогеназа; 3 - глутаматтрансаминаза; 4 - глутаминсинтетаза; 5 - глутаминаза; 6 - глутаминтрансаминаза; 7 - карбамоилфосфатсинтетаза (печень); 8 - ω-амидаза; 9 - у-глутамилцистеинсинтетаза; 10 - глутатионсинтетаза; 11 - у-глутамилтрансфераза; 12 - у-глутамилциклотрансфераза; 13 - 5-оксопролиназа; 14 - цистеинил-глициназа; 15 - глутаматдекарбоксилаза; 16 - глутамат-N-ацетилаза; 17 - ферменты, катализирующие распад этих аминокислот; 18 - амидотрансферазы глутамина; 19 - глутамин-фенилацетилтрансфераза.