Биологическая химия - Березов Т. Т., Коровкин Б. Ф. 1998
Биосинтез белка
Регуляция синтеза белка
Ингибиторы синтеза белка
Один из путей выяснения тонких молекулярных механизмов синтеза нуклеиновых кислот и белков в клетках — использование таких лекарственных препаратов, которые могли бы избирательно тормозить эти процессы у бактерий, не влияя на клетки организма человека. Некоторые препараты, действительно, оказывают такое избирательное действие, взаимодействуя с белками рибосом прокариот и выключая бактериальный синтез белка. Однако многие из них являются токсичными и для человека. В настоящее время в медицинской практике применяются многие антибиотики, часть из которых будет рассмотрена с целью выяснения молекулярного механизма их действия на ключевые химические реакции синтеза белка и нуклеиновых кислот.
Один из мощных ингибиторов белкового синтеза — пуромицин. Он представляет собой аналог концевого участка аминоацил-тРНК адениловой кислоты и поэтому легко взаимодействует с А-центром пептидил-тРНК с образованием пептидил-пуромицина*:
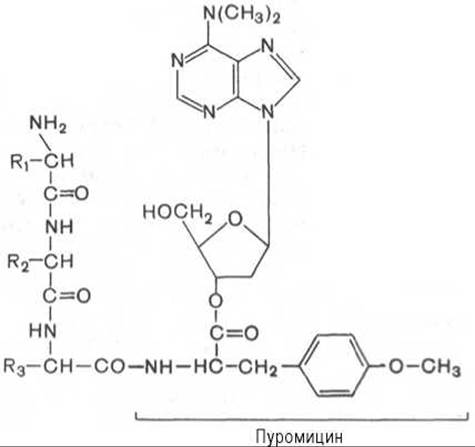
Пептидил-пуромицин не несет на себе триплета антикодона и поэтому тормозит элонгацию пептидной цепи, вызывая обрыв реакции, т.е. преждевременную терминацию синтеза белка. При помощи пуромицина было доказано, например, что гормональный эффект в ряде случаев зависит от синтеза белка de novo. Укажем также, что пуромицин оказывает тормозящее действие на синтез белка как у прокариот, так и у эукариот.
Белковый синтез тормозится актиномицином D, обладающим противоопухолевым эффектом, однако вследствие высокой токсичности препарат применяется редко. Он тормозит синтез всех типов клеточной РНК, особенно мРНК. Данное свойство объясняется тормозящим влиянием актиномицина D на ДНК-зависимую РНК-полимеразу, поскольку он связывается с остатками дезоксигуанозина цепи ДНК, выключая матричную функцию последней; это дает основание считать, что актиномицин D ингибирует транскрипцию ДНК.
Другим антибиотиком, также тормозящим синтез клеточной РНК, является используемый при лечении туберкулеза рифамицин. Этот препарат тормозит ДНК-зависимую РНК-полимеразу, связываясь с ферментом. Наиболее чувствительной к нему оказалась бактериальная РНК-полимераза. На организм животных этот антибиотик оказывает незначительное влияние. По механизму действия он резко отличается от актиномицина D. Следует указать, кроме того, на недавно открытое противовирусное действие рифамицина; в частности, он успешно используется при лечении трахомы, которая вызывается ДНК-содержащим вирусом. Это дает основание предположить, что данный антибиотик найдет применение в клинической онкологии при лечении опухолей, вызываемых вирусами.
* Пуромицин является структурным аналогом тирозинил-тРНК. Связываясь с аминоацильным центром рибосомы, он тормозит связывание новой аа-тРНК на стадии элонгации синтеза белка.
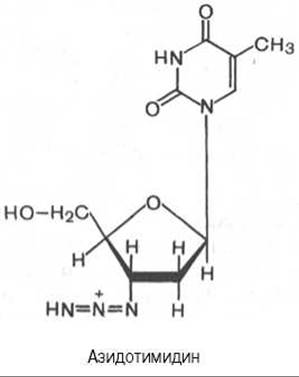
Одним из мощных ингибиторов синтеза вирусной РНК оказался азидотимидин (3'-азидо-2',3'-дидезокситимидин), синтезированный еще в 1964 г. в надежде на его противоопухолевый эффект. Было показано, что вирус иммунодефицита человека (ВИЧ) содержит РНК-й геном, в составе которого имеются как стандартные гены ретровирусов, так и необычные небольшие гены со множеством функций. Последние, в частности, подвержены мутациям с высокой скоростью вследствие низкой точности репликации, вызванной свойствами обратной транскриптазы. Эта вирусная обратная транскриптаза иммунодефицита человека оказалась наделенной значительно большим сродством к азидотимидину, чем к природному дезокситимидинтрифосфату (dТТФ). Азидотимидин конкурентно тормозит связывание dTTФ, вызывая тем самым терминацию (окончание) синтеза вирусной РНК.
Выяснены некоторые детали механизма действия ряда других антибиотиков, используемых при лечении тифозных инфекций. Так, хлорам-феникол оказывает ингибирующее влияние на пептидилтрансферазную реакцию (на стадии элонгации) синтеза белка в 70S рибосоме бактерий; на этот процесс в 80S рибосоме он не действует. Тормозит синтез белка в 80S рибосоме (без поражения процесса в 70S рибосоме) циклогексимид — специфический ингибитор транслоказы.
Весьма интересен молекулярный механизм действия дифтерийного токсина. Он оказался наделенным способностью катализировать реакцию АДФ-рибозилирования фактора элонгации эукариот (eEF-2), выключая тем самым его из участия в синтезе белка. Резистентность многих животных к дифтерийному токсину, вероятнее всего, обусловлена трудностью или полным отсутствием проникновения (транспорта) токсина через мембрану клеток.
Противотуберкулезные и антибактериальные антибиотики, в частности стрептомицин и неомицин, действуют на белоксинтезирующий аппарат чувствительных к ним штаммов бактерий. Было высказано предположение, что эти антибиотики обусловливают ошибки в трансляции мРНК, приводящие к нарушению соответствия между кодонами и включаемыми аминокислотами: например, кодон УУУ вместо фенилаланина начинает кодировать лейцин, в результате чего образуется аномальный белок, что приводит к гибели бактерий.
Широко применяемые в клинике тетрациклины также оказались ингибиторами синтеза белка в 70S рибосоме (меньше тормозится синтез в 80S рибосоме). Они легко проникают через клеточную мембрану. Считают, что тетрациклины тормозят связывание аминоацил-тРНК с аминоацильным центром в 50S рибосоме. Возможно, что тетрациклины химически связываются с этим центром, выключая тем самым одну из ведущих стадий процесса трансляции.
Пенициллины не являются истинными ингибиторами синтеза белка, однако их антибактериальный эффект связан с торможением синтеза гексапептидов, входящих в состав клеточной стенки. Механизм их синтеза отличается от рибосомного механизма синтеза белка. Эритромицин и олеандомицин тормозят активность транслоказы в процессе трансляции, подобно циклогексимиду, исключительно в 80S рибосомах, т.е. тормозят синтез белка в клетках животных.
Полученные к настоящему времени данные о механизме действия антибиотиков на синтез белка с учетом стадии и топографии процесса трансляции суммированы в табл. 14.2 (по Харперу с небольшими изменениями).
Таблица 14.2. Антибиотики — ингибиторы трансляции
|
Стадия трансляции |
Эукариоты |
Прокариоты |
|
цитоплазма |
митохондрия |
||
I. Инициация |
|||
Ауринтрикарбоновая кислота |
- |
- |
+ |
II. Элонгация |
|||
Амицетин |
? |
? |
+ |
Анизомицин |
- |
? |
+ |
Линкомицин |
- |
? |
+ |
Неомицин |
+ |
+ |
+ |
Пуромицин |
+ |
+ |
+ |
Спарсомицин |
+ |
+ |
+ |
Тетрациклины |
- |
+ |
+ |
Фузидовая кислота |
? |
? |
+ |
Хлорамфеникол |
- |
+ |
+ |
Циклогексимид |
+ |
- |
- |
III. Терминация |
|||
Амицетин |
? ? |
? |
+ |
Анизомицин |
? |
* |
|
Линкомицин |
? |
? |
+ |
Спарсомицин |
+ |
+ |
+ |
Стрептомицин |
+ |
+ |
+ |
Хлорамфеникол |
- |
- |
+ |
Эритромицин |
- |
+ |
+ |
Условные обозначения: + торможение; — отсутствие торможения; * стимулирование; ? неизвестно.
Следует еще раз подчеркнуть, что нарушение или выпадение любого звена, участвующего в синтезе белка, почти всегда приводит к развитию патологии, причем клинические проявления болезни будут определяться природой и функцией белка, синтез которого оказывается нарушенным (структурный или функциональный белок). Иногда синтезируются так называемые аномальные белки как результат действия мутагенных факторов и соответственно изменения генетического кода (например, гемоглобин при серповидно-клеточной анемии). Последствия этих нарушений могут выражаться в развитии самых разнообразных синдромов или заканчиваться летально.
Следует отметить, однако, что организм располагает мощными механизмами защиты. Подобные изменения генетического аппарата быстро распознаются специфическими ферментами — рестриктазами, измененные последовательности вырезаются и вновь замещаются соответствующими нуклеотидами при участии полимераз и лигаз.