Биологическая химия - Березов Т. Т., Коровкин Б. Ф. 1998
Кровь
Дыхательная функция крови
Перенос кислорода кровью
Сущность дыхательной функции крови состоит в доставке кислорода от легких к тканям и углекислого газа от тканей к легким (табл. 17.4).
Кровь осуществляет дыхательную функцию прежде всего благодаря наличию в ней гемоглобина. Физиологическая функция гемоглобина как переносчика кислорода основана на способности обратимо связывать кислород. Поэтому в легочных капиллярах происходит насыщение крови кислородом, а в тканевых капиллярах, где парциальное давление кислорода резко снижено, осуществляется отдача кислорода тканям.
Таблица 17.4. Состав вдыхаемого, альвеолярного и выдыхаемого воздуха (по Уайту и др., 1981)
|
Газ |
Вдыхаемый воздух |
Альвеолярный воздух |
Выдыхаемый воздух |
|||
Р (гПа) |
об. % |
Р (гПа) |
об. % |
Р (гПа) |
об. % |
|
O2 |
210,9 |
20,95 |
134,9 |
14,0 |
154,9 |
16,1 |
СО2 |
0,4 |
0,04 |
53,3 |
5,6 |
38,0 |
4,5 |
N2 |
795,3 |
79,0 |
762,4 |
80,0 |
757,7 |
79,2 |
H2O |
6,7 |
— |
62,7 |
— |
62,7 |
— |
Всего... |
1013,3 |
99,99 |
1013,3 |
99,6 |
1013,3 |
99,8 |
В состоянии покоя ткани и органы человека потребляют около 200 мл кислорода в минуту. При тяжелой физической работе количество потребляемого тканями кислорода возрастает в 10 раз и более (до 2—3 л/мин). Доставка от легких к тканям такого количества кислорода в виде газа, физически растворенного в плазме, невозможна вследствие малой растворимости кислорода в воде и плазме крови (табл. 17.5).
Таблица 17.5. Коэффициенты абсорбции (растворимости) вдыхаемых газов (в миллилитрах на 1 мл среды при давлении 1013,3 г Па - 760 мм рт. ст.)
|
Среда |
t°C |
Газ |
||
O2 |
СО2 |
N2 |
||
Вода |
0 |
0,049 |
1,71 |
0,024 |
20 |
0,031 |
0,87 |
0,016 |
|
Плазма |
40 |
0,023 |
0,53 |
0,012 |
38 |
0,024 |
0,51 |
0,012 |
|
Исходя из приведенных в табл. 17.5 данных, а также зная PO2 в артериальной крови — 107—120 гПа (80—90 мм рт. ст.), нетрудно видеть, что количество физически растворенного кислорода в плазме крови не может превышать 0,3 об. %. При расчете кислородной емкости крови этой величиной можно пренебречь.
Итак, функцию переносчика кислорода в организме выполняет гемоглобин. Напомним, что молекула гемоглобина построена из 4 субъединиц (полипептидных цепей), каждая из которых связана с гемом (см. главу 2). Следовательно, молекула гемоглобина имеет 4 гема, к которым может присоединяться кислород, при этом гемоглобин переходит в оксигемоглобин.
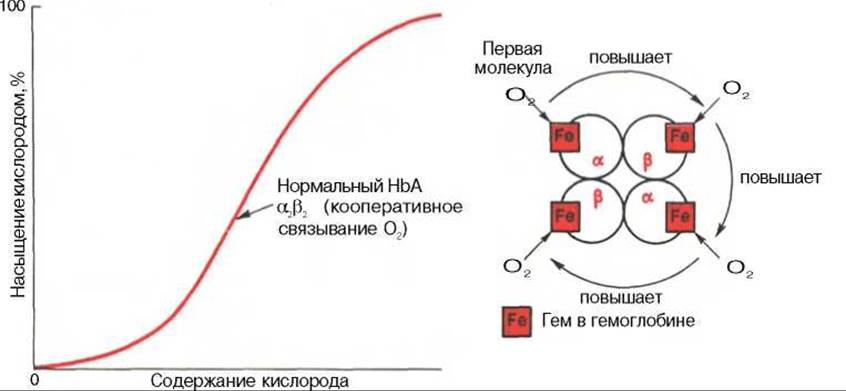
Рис. 17.6. Кривая насыщения гемоглобина кислородом. Объяснение в тексте.
Гемоглобин человека содержит 0,335% железа. Каждый грамм-атом железа (55,84 г) в составе гемоглобина при полном насыщении кислородом связывает 1 грамм-молекулу кислорода (22400 мл). Таким образом, 100 г гемоглобина могут связывать
![]()
а каждый грамм гемоглобина — 1,34 мл кислорода. Содержание гемоглобина в крови здорового человека составляет 13—16%, т.е. в 100 мл крови 13—16 г гемоглобина. При РО2 в артериальной крови 107—120 гПа гемоглобин насыщен кислородом на 96%. Следовательно, в этих условиях 100 мл крови содержит 19—20 об. % кислорода:
![]()
В венозной крови в состоянии покоя РО2 = 53,3 гПа, и в этих условиях гемоглобин насыщен кислородом лишь на 70-72%, т.е. содержание кислорода в 100 мл венозной крови не превышает
![]()
Артериовенозная разница по кислороду* будет около 6 об. %. Таким образом, за 1 мин ткани в состоянии покоя получают 200-240 мл кислорода (при условии, что минутный объем сердца в покое составляет 4 л).
Возрастание интенсивности окислительных процессов в тканях, например при усиленной мышечной работе всегда связано с более полным извлечением кислорода из крови. Кроме того, при физической работе резко увеличивается скорость кровотока. Зависимость между степенью насыщения гемоглобина кислородом и РО2, можно выразить в виде кривой насыщения гемоглобина кислородом, или кривой диссоциации оксигемоглобина, которая имеет S-образную форму и характеризует сродство гемоглобина к кислороду (рис. 17.6).
* Артериовенозная разница по кислороду в разных органах далеко не одинакова и зависит от уровня метаболизма органа. В миокарде она составляет 12, в мозге - 6, в пищеварительном тракте - 3, в почках - 1,5 об. %.
Характерная для гемоглобина S-образная кривая насыщения кислородом свидетельствует, что связывание первой молекулы кислорода одним из гемов гемоглобина облегчает связывание последующих молекул кислорода тремя другими оставшимися гемами. Долгое время механизм, лежащий в основе этого эффекта, оставался загадкой, так как, по данным рентгеноструктурного анализа, 4 гема в молекуле гемоглобина довольно далеко отстоят друг от друга и вряд ли могут оказывать взаимное влияние. В последнее время принято следующее объяснение происхождения S-образной кривой. Считают, что тетрамерная молекула гемоглобина способна обратимо распадаться на две половинки, каждая из которых содержит одну a-цепь и одну ß-цепь:
![]()
При взаимодействии молекулы кислорода с одним из четырех гемов гемоглобина кислород присоединяется к одной из половинок молекулы гемоглобина (допустим, к a-цепи этой половинки). Как только такое присоединение произойдет, a-полипептидная цепь претерпевает конформационные изменения, которые передаются на тесно связанную с ней ß-цепь; последняя также подвергается конформационным сдвигам. ß-Цепь присоединяет кислород, имея уже большее сродство к нему. Таким путем связывание одной молекулы кислорода благоприятствует связыванию второй молекулы (так называемое кооперативное взаимодействие).
После насыщения кислородом одной половины молекулы гемоглобина возникает новое, внутреннее, напряженное состояние молекулы гемоглобина, которое вынуждает и вторую половину гемоглобина изменить конформацию. Теперь еще две молекулы кислорода, по-видимому, по очереди связываются со второй половинкой* молекулы гемоглобина, образуя оксигемоглобин.
S-образная форма кривой насыщения гемоглобина кислородом имеет большое физиологическое значение. При такой форме кривой обеспечивается возможность насыщения крови кислородом при изменении РО2 в довольно широких пределах. Например, дыхательная функция крови существенно не нарушается при снижении РО2 в альвеолярном воздухе со 133,3 до 80—93,3 гПа. Поэтому подъем на высоту до 3,0—3,5 км над уровнем моря не сопровождается развитием выраженной гипоксемии.
Численно сродство гемоглобина к кислороду принято выражать величиной Р50 — парциальное напряжение кислорода, при котором 50% гемоглобина связано с кислородом (рН 7,4 температура 37°С). Нормальная величина Р50 около 34,67 гПа (см. рис. 17.6). Смещение кривой насыщения гемоглобина кислородом вправо означает уменьшение способности гемоглобина связывать кислород и, следовательно, сопровождается повышением Р50. Напротив, смещение кривой влево свидетельствует о повышенном сродстве гемоглобина к кислороду, величина Р50 снижена.
Ход кривой насыщения гемоглобина кислородом или диссоциации оксигемоглобина зависит от ряда факторов. Сродство гемоглобина к кислороду в первую очередь связано с рН. Чем ниже рН, тем меньше способность гемоглобина связывать кислород и тем выше Р50. В тканевых капиллярах рН ниже (поступает большое количество СО2), в связи с чем гемоглобин легко отдает кислород. В легких СО2 выделяется, рН повышается и гемоглобин активно присоединяет кислород.
* Термин «субъединица» не вполне однозначен в применении к молекуле гемоглобина, так как она содержит четыре структурных элемента (две a-цепи и две ß-цепи), но имеет при этом только две функциональные субъединицы, а именно две aß-половинки.
Способность гемоглобина связывать кислород зависит также от температуры. Чем выше температура (в тканях температура выше, чем в легких), тем меньше сродство гемоглобина к кислороду. Напротив, снижение температуры вызывает обратные явления.
Количество гемоглобина в крови, а также в какой-то мере его способность связывать кислород (характер кривой диссоциации оксигемоглобина) несколько меняются с возрастом. Например, у новорожденных содержание гемоглобина доходит до 20—21% (вместо обычных для взрослого 13—16%). У человека имеется несколько гемоглобинов, которые образуются в различном количестве в разные стадии онтогенеза и различаются по своему сродству к кислороду.
Рассмотрим нарушения дыхательной функции крови при некоторых патологических состояниях.