Биологическая химия - Березов Т. Т., Коровкин Б. Ф. 1998
Химия липидов
Жирные кислоты
Жирные кислоты — алифатические карбоновые кислоты — в организме могут находиться в свободном состоянии (следовые количества в клетках и тканях) либо выполнять роль строительных блоков для большинства классов липидов*.
В природе обнаружено свыше 200 жирных кислот, однако в тканях человека и животных в составе простых и сложных липидов найдено около 70 жирных кислот, причем более половины из них в следовых количествах. Практически значительное распространение имеют немногим более 20 жирных кислот. Все они содержат четное число углеродных атомов, главным образом от 12 до 24. Среди них преобладают кислоты, имеющие С16 и С18 (пальмитиновая, стеариновая, олеиновая и линолевая). Нумерацию углеродных атомов в жирно-кислотной цепи начинают с атома углерода карбоксильной группы. Примерно 3/4 всех жирных кислот являются непредельными (ненасыщенными), т.е. содержат двойные связи. Ненасыщенные жирные кислоты человека и животных, участвующие в построении липидов, обычно содержат двойную связь между (9-м и 10-м атомами углеводородов); дополнительные двойные связи чаще бывают на участке между 11-м атомом углерода и метильным концом цепи. Своеобразие двойных связей природных ненасыщенных жирных кислот заключается в том, что они всегда отделены двумя простыми связями, т.е. между ними всегда имеется хотя бы одна метиленовая группа (—СН=СН— —СН2—СН=СН—). Подобные двойные связи обозначают как «изолированные».
* В природе значительно чаще встречаются длинноцепочечные жирные кислоты с числом углеродных атомов больше двенадцати, часто их называют - «высшие жирные кислоты».
Систематическое название жирной кислоты чаще всего образуется путем добавления к названию углеводорода окончания -овая. Насыщенные кислоты при этом имеют окончание -ановая (например, октановая кислота — систематическое название, каприловая кислота — тривиальное название), а ненасыщенные кислоты — еновая (например, октадеценовая кислота — систематическое название, олеиновая кислота — тривиальное название) (табл. 6.1; 6.2).
Таблица 6.1. Некоторые физиологически важные насыщенные жирные кислоты
Число атомов С |
Тривиальное название |
Систематическое название |
Химическая формула соединения |
6 |
Капроновая |
Гексановая |
СН3—(СН2)4—СООН |
8 |
Каприловая |
Октановая |
СН3—(СН2)6—СООН |
10 |
Каприновая |
Декановая |
СН3—(СН2)8—СООН |
12 |
Лауриновая |
Додекановая |
СН3—(СН2)10—СООН |
14 |
Миристиновая |
Тетрадекановая |
СН3—(СН2)12—СООН |
16 |
Пальмитиновая |
Гексадекановая |
СН3—(СН2)14—СООН |
18 |
Стеариновая |
Октадекановая |
СН3—(СН2)16—СООН |
20 |
Арахиновая |
Эйкозановая |
СН3—(СН2)18—СООН |
22 |
Бегеновая |
Докозановая |
СН3—(СН2)20—СООН |
24 |
Лигноцериновая |
Тетракозановая |
СН3—(СН2)22—СООН |
В соответствии с систематической номенклатурой количество и положение двойных связей в ненасыщенных жирных кислотах часто обозначают с помощью цифровых символов: например, олеиновую кислоту как 18:1;9, линолевую кислоту как 18:2;9,12, где первая цифра — число углеродных атомов, вторая — число двойных связей, а следующие цифры — номера ближайших к карбоксилу углеродных атомов, вовлеченных в образование двойной связи.
В специальной литературе жирные кислоты часто изображают в виде зигзагообразной вытянутой линии, отражающей жесткость валентного угла атомов углерода в 111° для насыщенной и в 123° — для двойной связи. Однако такая конформация является условной и справедлива только для случая, когда жирная кислота находится в кристаллическом состоянии. В растворах жирно-кислотная цепь может образовывать бесчисленное количество конформаций вплоть до клубка, в котором имеются и линейные участки различной длины в зависимости от числа двойных связей. Клубки могут слипаться между собой, образуя так называемые мицеллы. В последних отрицательно заряженные карбоксильные группы жирных кислот обращены к водной фазе, а неполярные углеводородные цепи спрятаны внутри мицеллярной структуры. Такие мицеллы имеют суммарный отрицательный заряд и в растворе остаются суспендированными благодаря взаимному отталкиванию.
Известно также, что при наличии двойной связи в жирнокислотной цепи вращение углеродных атомов относительно друг друга ограничено. Это обеспечивает существование ненасыщенных жирных кислот в виде геометрических изомеров (рис. 6.1), причем природные ненасыщенные жирные кислоты имеют цис-конфигурацию и крайне редко транс-конфигурации. Считают, что жирной кислоте с несколькими двойными связями цис-конфигурация придает углеводородной цепи изогнутый и укороченный вид. По этой причине молекулы этих кислот занимают больший объем, а при образовании кристаллов упаковываются не так плотно, как транс-изомеры. Вследствие этого цис-изомеры имеют более низкую температуру плавления (олеиновая кислота, например, при комнатной температуре находится в жидком состоянии, тогда как элаидиновая — в кристаллическом). Цис- конфигурация делает ненасыщенную кислоту менее стабильной и более подверженной катаболизму.
Таблица 6.2. Некоторые физиологически важные ненасыщенные жирные кислоты
Число атомов С |
Тривиальное название |
Систематическое название, включая местонахождение двойных связей |
Химическая формула соединения |
|
Моноеновые кислоты |
|||
16 |
Пальмитиновая |
9-гексадеценовая |
СН3—(СН2)5—СН= =СН—(СН2)7—СООН |
18 |
Олеиновая |
9-октадеценовая |
СН3—(СН2)7—СН= =СН—(СН2)7—СООН СН3—(СН2)7—СН= =СН—(СН)11—СООН |
22 |
Эруковая |
13-докозеновая |
|
18 |
Линолевая |
Диеновые кислоты 9,12-октадекадиеновая |
СН3—(СН2)4—СН= =СН—СН2—СН= =СН—(СН2)7—СООН |
18 |
Линоленовая |
Триеновые кислоты 9,12,15-октадекатриеновая |
СН3—СН2—СН= =СН—СН2—СН= =СН—СН2—СН= =СН—(СН2)7—СООН |
20 |
Арахидоновая |
Тетраеновые кислоты 5,8,11,14-эйкозатетраеновая |
СН3—(СН2)4—СН= =СН—СН2—СН= =СН—СН2—СН= =СН—СН2—СН== =СН—(СН2)3—СООН |
22 |
Клупанодоновая |
Пентаеновые кислоты 7,10,13,16,19-докозапентаеновая |
СН3—СН2—СН= =СН—СН2—СН= =СН—СН2—СН= =СН—СН2—СН= =СН—СН2—СН= =СН—(СН2)5—СООН |
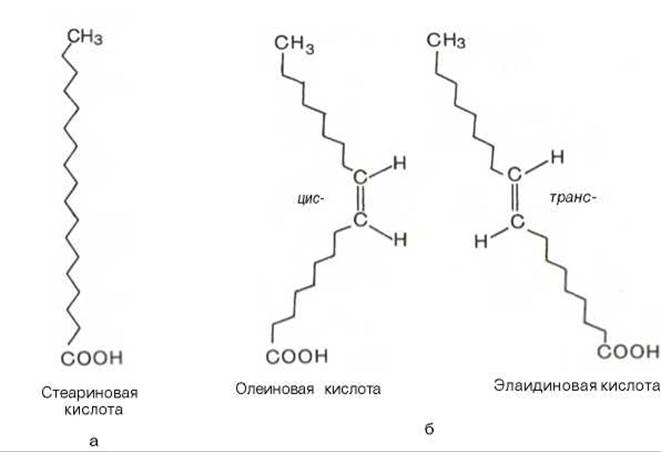
Рис. 6.1. Конфигурация 18-углеродных насыщенных (а) и мононенасыщенных (б) жирных кислот.