БИОХИМИЯ - В. В. Емельянов - 2016
РАЗДЕЛ 4. ОБМЕН ЛИПИДОВ
4.1. Биологическая роль липидов
Липиды представляют собой разнородную по химическому строению группу природных органических соединений, плохо растворимых в воде и хорошо растворимых в неполярных растворителях. Они играют важную роль в жизнедеятельности клетки:
- являются важнейшим компонентом биологических мембран, состояние которых определяет метаболизм клетки;
- обеспечивают запас питательных веществ;
- выполняют энергетическую функцию (при окислении 1 г липидов выделяется 9,3 ккал);
- осуществляют регуляторную и теплоизолирующую функции.
В липидах человека обнаруживается большое разнообразие жирных кислот. Источниками жирных кислот организма служат липиды пищи и синтез жирных кислот из углеводов. Основные пути превращения жирных кислот приведены на следующей схеме:
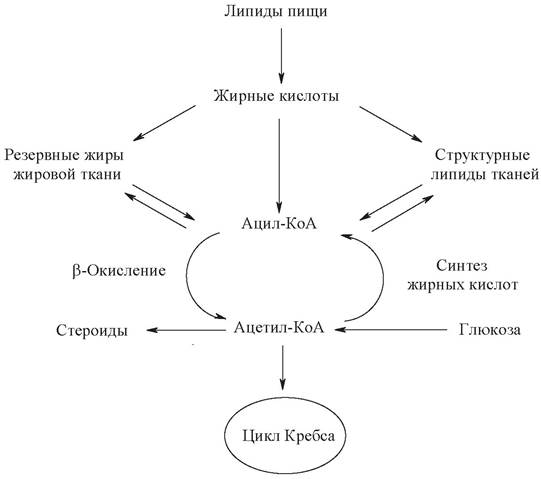
Расходуются жирные кислоты в основном по трем направлениям:
- включаются в состав резервных жиров;
- включаются в состав сложных липидов;
- окисляются до диоксида углерода и воды с извлечением энергии для синтеза АТФ.
4.2. Переваривание липидов
Основная масса липидов пищи представлена триацилглицеридами (жирами). Потребность в жирах составляет 50-100 г/сутки в зависимости от характера питания и энергетических затрат. Переваривание липидов происходит главным образом в тонкой кишке под действием ферментов липаз. В ротовой полости и желудке эти процессы не идут. Липаза расщепляет триацилглицериды в среде, близкой к нейтральной, поэтому она практически неактивна в желудке из-за низких значений рН. В12-перстной кишке пища подвергается воздействию желчи и сока поджелудочной кислоты. В 12-перстную кишку тонкого отдела кишечника с соком поджелудочной железы также поступает липаза в виде неактивной формы - пролипазы. С желчью туда же поступают желчные кислоты, под действием которых липаза активируется. На первом этапе происходит процесс эмульгирования липидов с участием желчных кислот, которые поступают в кишечник в составе желчи. Желчные кислоты ориентируются на каплях жира, что приводит к уменьшению поверхностного натяжения и дроблению их на более мелкие:
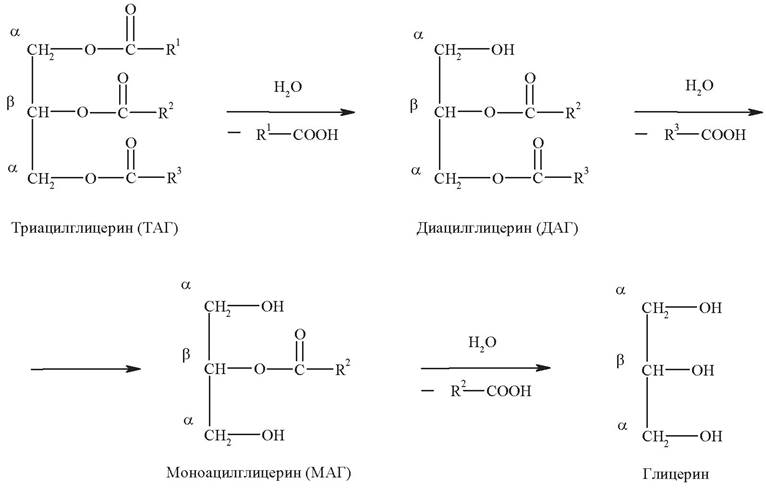
На поверхности таких мелких капель адсорбируется липаза и гидролизует эфирные связи в молекулах триацилглицеридов. В результате от глицерина отщепляются поочередно остатки жирных кислот. Высвобождающиеся жирные кислоты усиливают эмульгирование жиров. Желчные кислоты образуют комплекс с жирными кислотами и моноацилглицеринами, который легко проникает в клетки слизистой оболочки кишечника. В толще слизистой желчные кислоты отщепляются от жирных кислот и с портальным кровотоком поступают обратно в печень, где вновь включаются в состав желчи.
Основные продукты переваривания - жирные кислоты, β-моноацил-глицерины и частично свободный глицерин - всасываются стенкой тонкой кишки, и там происходит образование тех жиров, которые свойственны организму человека (ресинтез жиров):
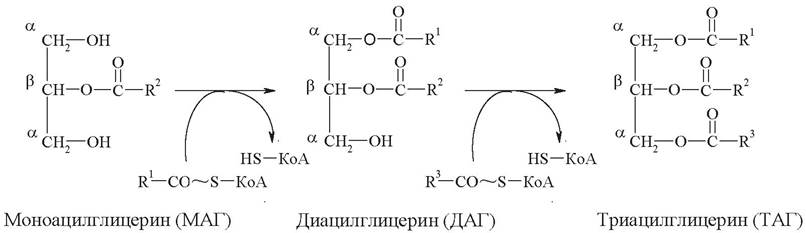
Новосинтезированные триацилглицерины, фосфолипиды и другие всосавшиеся липиды покидают клетки слизистой, попадая сначала в лимфу, а с током лимфы - в кровь. Поскольку эти вещества нерастворимы в водной среде, то они переносятся в комплексе с белками, образуя липопротеиды (табл. 6). В кишечнике ресинтезированные триацилглицерины включаются в состав хиломикронов. Ядро этих частиц составляют триацилглицерины и эфиры холестерина, оболочку - комплекс из фосфолипидов, белков и свободного холестерина. В составе хиломикронов экзогенные жиры доставляются в органы и ткани. Потребление экзогенных жиров тканями обеспечивает фермент липопротеинлипаза. Этот фермент локализуется в эндотелии сосудов и катализирует реакцию гидролиза триацилглицеринов в составе хиломикронов до глицерина и жирных кислот. В результате действия липопротеинлипазы хиломикроны уменьшаются в размерах и превращаются в так называемые ремнантные (остаточные) хиломикроны, которые захватываются из кровотока печенью, где они распадаются окончательно.
Таблица 6. Липопротеины крови человека
Липопротеины |
Плотность, г/мл |
Молекулярная масса |
Диаметр, нм |
Концентрация в крови, г/л |
Основной компонент |
Место синтеза |
Функция |
Хиломикроны |
0,95 |
1-10 млрд |
30-500 |
1-2 |
Триацилглицерины |
Тонкая кишка |
Транспорт ТГ из кишки в ткани |
ЛПОНП (пре-β) |
0,95-1,00 |
5-100 млн |
30-75 |
1-1,5 |
Триацилглицерины |
Печень |
Транспорт ТГ из печени в ткани |
ЛПНП (β) |
1,00-1,06 |
2-4 млн |
20-25 |
2-4 |
Холестерин |
Кровь |
Транспорт холестерина в ткани |
ЛПВП (α) |
1,06-1,21 |
200-400 тыс. |
10-15 |
1-3 |
Белок и фосфолипиды |
Печень |
Транспорт холестерина из тканей в печень |
Основными потребителями жирных кислот являются жировая и мышечная ткани, которые используют жирные кислоты как энергетическое топливо или строительный материал.
4.3. Депонирование жиров
Жиры, как и гликоген, являются формами депонирования энергии, причем жиры - более эффективные источники энергии. При голодании запасы жира у человека истощаются за 5-7 недель, тогда как гликоген полностью расходуются примерно за сутки. Если поступление жира превышает потребности организма в энергии, то жир депонируется в специализированных клетках жировой ткани - адипоцитах. Если же количество поступающих углеводов больше, чем необходимо для депонирования в виде гликогена, то часть глюкозы тоже превращается в жиры.
Таким образом, жиры в жировой ткани накапливаются в результате двух процессов:
- синтеза из жирных кислот, образующихся в результате липолиза триглицеридов в составе хиломикронов и липопротеинов очень низкой плотности ферментом липопротеинлипазой;
- синтеза из глюкозы, при метаболизме которой в клетках жировой ткани образуются глицеролфосфат и жирные кислоты.
4.4. Окисление жирных кислот
Жирные кислоты играют важную роль в качестве источника энергии в организме. Главный путь окисления жирных кислот - β-окисление, названное так, потому что окислению подвергается β-углеродный атом остатка жирной кислоты.
β -Окисление протекает в митохондриях клетки, а жирная кислота поступает из кровотока в цитозоль, где активируется путем присоединения КоА к ЖК с образованием ацил-КоА:
![]()
Мембрана митохондрий непроницаема для ЖК даже в активированной форме, поэтому ацил-КоА соединяется со специальным переносчиком карнитином. Образуется ацилкарнитин, который проникает в митохондрии, где вновь распадается на карнитин и ацил-КоА.
Собственно, процесс P-окисления (цикл Кноопа - Линена) - спиральный метаболический путь, каждый оборот которого приводит к укорачиванию остатка жирной кислоты на 2 атома углерода, включает 4 стадии (рис. 20):
1. Окисление - дегидрирование ацил-КоА до дегидроацил-КоА с участием ФАД-зависимой дегидрогеназы;
2. Гидратация - присоединение к дегидроацил-КоА воды в β-положении с образованием гидрооксиацил-КоА при участии гидратазы;
3. Окисление - дегидрирование гидрооксиацил-КоА до β-кетоацил-КоА при участии НАД-зависимой дегидрогеназы;
4. Тиолиз - расщепление тиосвязи при участии тиолазы с образованием ацил- КоА и ацетил-КоА.
Рис. 20. β-Окисление жирных кислот
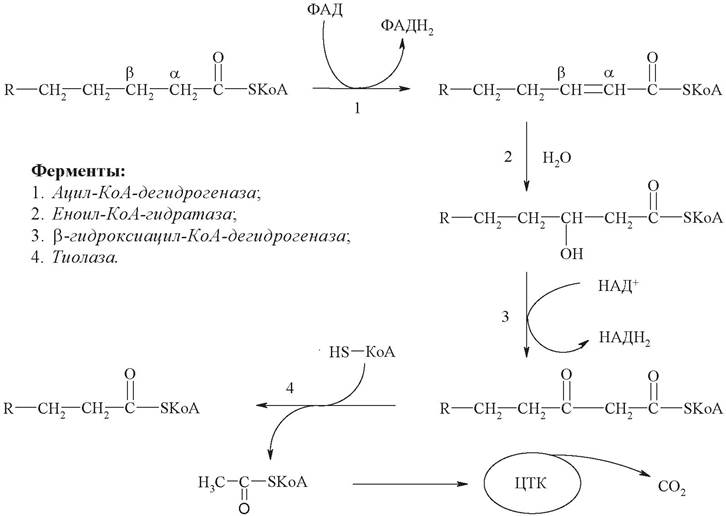
В результате четырех последовательных реакций β-окисления происходит отщепление двухуглеродного фрагмента и перенос его на кофермент А с образованием ацетил-КоА, который затем может включаться в цикл Кребса для полного окисления. Укороченная ацильная цепь (ацил-КоА) вновь вступает в цикл β-окисления, начиная с реакции, катализируемой ацил-КоА-дегидрогеназой.
Ниже показано окисление пальмитиновой кислоты:

Окисление пальмитиновой кислоты (С16) происходит путем последовательного удаления двухуглеродных фрагментов с карбоксильного конца жирной кислоты, в результате 7 циклов β-окисления образуется 8 молекул ацетил-КоА.
4.5. Энергетический выход β-окисления жирных кислот
Данный выход зависит от длины углеводородной цепи. Чтобы подсчитать энергетический выход β-окисления конкретной жирной кислоты, надо знать количество циклов β-окисления и количество молекул ацетил-КоА.
В каждом цикле β-окисления ацил-КоА укорачивается на 2 атома углерода и образуется 1 молекула ацетил-КоА. Поэтому число образующихся молекул ацетил- КоА равно половине числа атомов углерода в ацил-КоА. Окисление каждой молекулы ацетил-КоА в цикле трикарбоновых кислот обеспечивает синтез 12 молекул АТФ. В каждом цикле β-окисления образуется 1 молекула ФАДН2 и 1 молекула НАДН2, при окислении которых в дыхательной цепи синтезируется соответственно 2 и 3 молекулы АТФ (всего 5 молекул). В последнем цикле β-окисления образуется сразу 2 молекулы ацетил-КоА. Поэтому для полного превращения остатка жирной кислоты в ацетил-КоА необходимо на единицу меньше циклов β-окисления, чем половинное число атомов углерода в ацил-КоА.
Например, у пальмитиновой кислоты (С16) происходит 7 циклов β-окисления, в результате которых образуется 8 молекул ацетил-КоА, 7 молекул ФАДН2 и 7 молекул НАДН2. Следовательно, выход АТФ составляет 35 АТФ в результате р-окисления и 96 АТФ цитратного цикла, что составляет в сумме 131 молекулу АТФ. Учитывая тот факт, что одна молекула АТФ затрачивается на активацию жирной кислоты, суммарный выход АТФ составляет 130 молекул.
4.6. Биосинтез жирных кислот
Наряду с окислением жирных кислот в клетках функционирует процесс их синтеза. Основным местом синтеза жирных кислот является цитозоль, в отличие от β-окисления, которое происходит в митохондриях.
Непосредственным предшественником жирных кислот служит малонил-КоА. Это соединение синтезируются путем присоединения углекислого газа к ацетил-КоА, который поступает из митохондрий. Основным продуктом синтеза является пальмитиновая кислота. Центральную роль в синтезе жирных кислот играет фермент пальмитатсинтетаза (синтетаза жирных кислот), который катализирует серию реакций. Суммарное уравнение синтеза пальмитиновой кислоты включает 7 циклов:
Ацетил-КоА + 7 Малонил-КоА + 14 НАДФН2 —> Пальмитат + 8 HS-КоА + 7 СО2 + 14 НАДФ+ +7 Н2О.
Пальмитиновая кислота служит предшественником других жирных кислот организма. Удлинение углеродной цепи происходит за счет дополнительного присоединения ацетил-КоА или малонил-КоА, при помощи других ферментов, имеющихся как в цитозоле, так и в митохондриях. Так, присоединение к пальмитиновой кислоте ацетил-КоА и последующее восстановление p-карбонильной группы приводит к образованию стеариновой кислоты. Большинство непредельных жирных кислот образуется путем дегидрирования насыщенных кислот. Пути образования некоторых жирных кислот представлены на схеме:
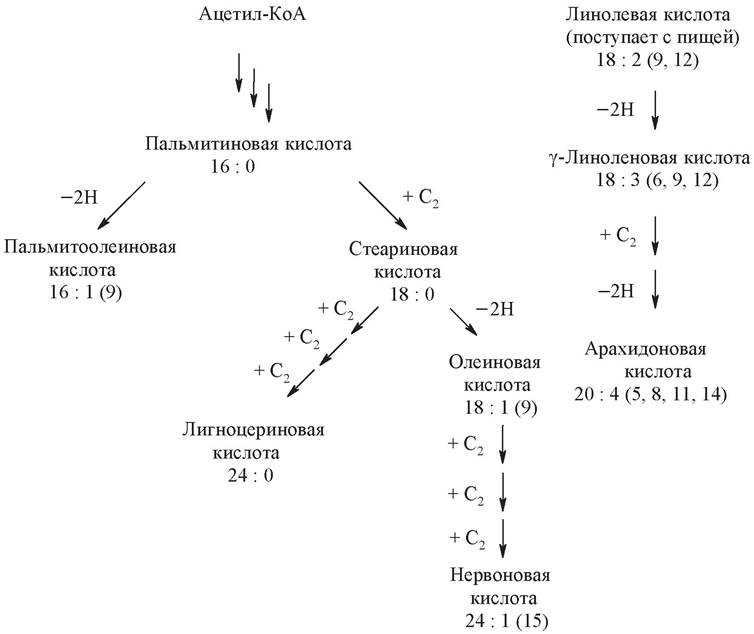
Человек и животные не способны синтезировать из пальмитиновой жирные кислоты с двумя и более двойными связями. Поэтому линолевая, линоленовая и арахидоновая (при отсутствии линолевой) кислоты являются незаменимыми и должны обязательно поступать с пищей.
4.7. Биосинтез триглицеридов, фосфолипидов и холестерина
Триглицериды синтезируются на основе глицеролфосфата и ацил-КоА. На первом этапе присоединяется два ацильных фрагмента, а затем под действием фосфатазы теряется остаток фосфата и присоединяется третий ацил.
Синтез фосфолипидов происходит также из глицеролфосфата и жирных кислот, но требует дополнительно этаноламина, холина, серина или инозитола для образования полярной «головы» молекулы.
Холестерин (холестерол) синтезируется из ацетил-КоА в цитозоле клетки: 80 % - в печени, 10 % - в клетках кишечника и 5 % - в клетках кожи. Скорость синтеза холестерина зависит от количества экзогенного, т. е. поступающего с пищей, холестерина. При поступлении 2-3 г холестерина в сутки синтез эндогенного холестерина прекращается.
Из холестерола в печени образуются желчные кислоты, необходимые для переваривания липидов. В коже из холестерола синтезируется витамин Д3 - регулятор кальций-фосфорного обмена. Холестерол - субстрат для синтеза стероидных гормонов: в коре надпочечников из него образуются минерало- и глюкокортикоиды, в половых железах - андрогены, эстрогены, гестагены.
4.8. Синтез и распад кетоновых тел
В условиях голодания, длительной физической нагрузки и нарушения утилизации глюкозы клетками (вследствие дефицита инсулина при сахарном диабете) основным источником энергии становятся жирные кислоты, образующиеся при гидролизе триглицеридов жировой ткани. Жирные кислоты подвергаются β-окислению с образованием больших количеств ацетил-КоА во всех органах, кроме мозга. Оксалоацетат, необходимый для включения ацетил-КоА в ЦТК, не образуется из жирных кислот, поэтому избыток ацетил-КоА не может быстро окислиться в ЦТК. Печень обладает уникальной способностью синтезировать из больших количеств ацетил-КоА кетоновые тела.
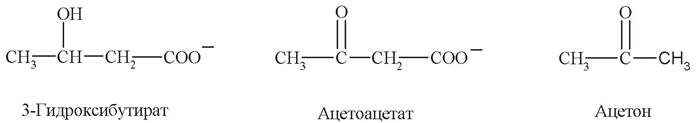
К кетоновым телам относят три соединения близкой структуры - ацетоацетат, 3-гидроксибутират (β-гидроксибутират) и ацетон:
Их синтез начинается с взаимодействия двух молекул ацетил-КоА, которые под действием фермента тиолазы образуют ацетоацетил-КоА. С ацетоацетил- КоА взаимодействует третья молекула ацетил-КоА, давая 3-гидрокси-3-метил- глутарил-КоА (ГМГ-КоА). Далее ГМГ-КоА-лиаза катализирует расщепление ГМГ-КоА на свободный ацетоацетат и ацетил-КоА:
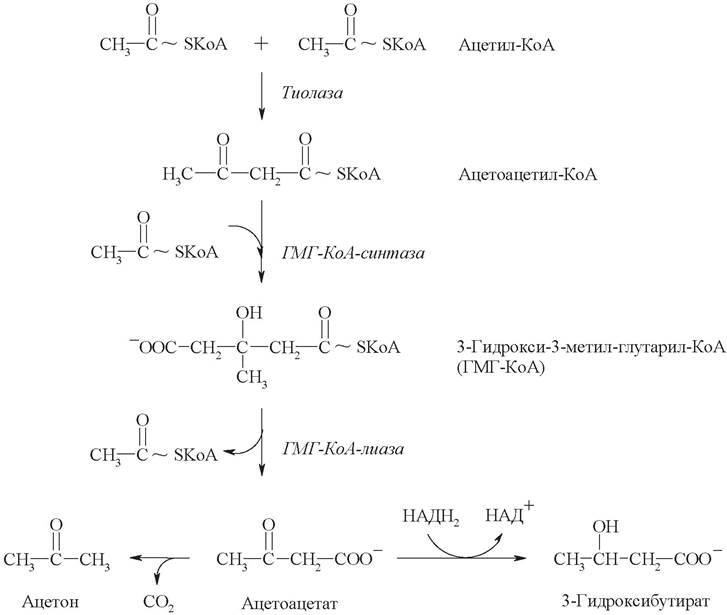
Образующийся в реакции ацетоацетат может выделяться в кровь или восстанавливаться в 3-гидроксибутират. В условиях активного β-окисления создается высокая концентрация НАДН2, что способствует восстановлению большей части ацетоацетата, в результате чего 3-гидроксибутират становится основным кетоновым телом в крови.
При высокой концентрации ацетоацетата часть его может необратимо декарбоксилироваться с образованием ацетона. Ацетон не утилизируется тканями и выделяется с выдыхаемым воздухом, мочой и потом, помогая организму избавиться от избытка кетоновых тел.
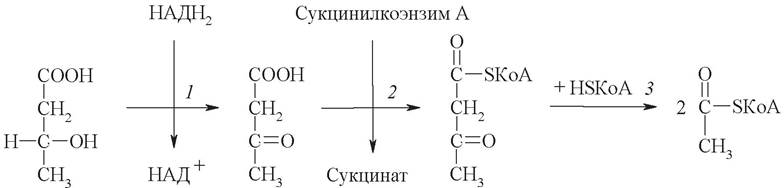
Реакции утилизации кетоновых тел примерно совпадают с обратным направлением реакций их синтеза. В цитозоле клетки 3-гидроксибутират окисляется, образующийся ацетоацетат проникает в митохондрии, где активируется за счет сукцинил-КоА:
Ацетоацетат + Сукцинл-КоА —> Ацетоацетат-КоА + Сукцинат.
Данная реакция протекает под действием фермента сукцинил-КоА-ацетоаце- таттрансферазы. Этого фермента нет в печени, поэтому печень не использует кетоновые тела как источники энергии, а производит их «на экспорт». Активированный ацетоацетат далее превращается в ацетил-КоА, который сгорает в ЦТК:
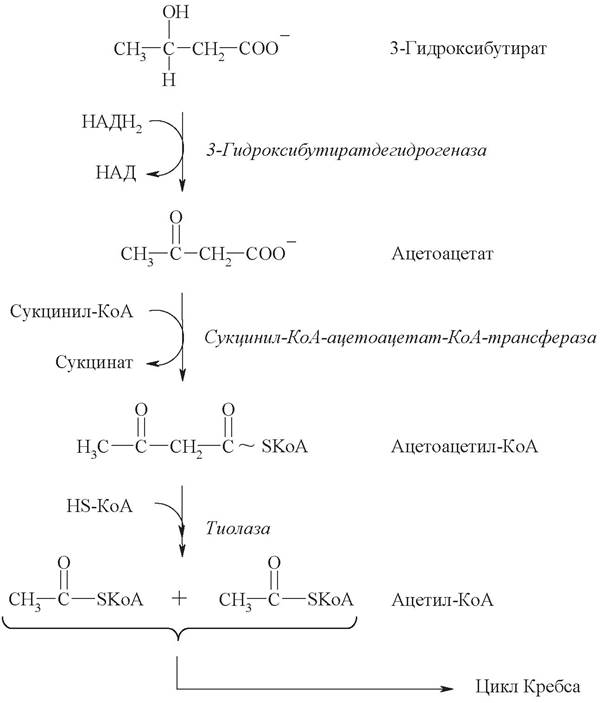
Биологическая роль кетоновых тел заключается в том, что эти молекулы (3-гидроксибутират и ацетоацетат) представляют собой альтернативный источник энергии для клеток при дефиците глюкозы, выгодно отличаясь от жирных кислот малыми размерами и хорошей растворимостью в воде. В результате при голодании кетоновые тела могут служить источниками энергии даже для нервной ткани, которая не способна утилизировать жирные кислоты из крови. Однако 3-гидроксибутират и ацетоацетат являются кислотами и при высокой концентрации снижают рН крови (развитие ацидоза). Ацидоз нарушает жизнедеятельность организма и может привести к смерти.
Вопросы для проверки усвоения материала
1. Липиды: определение, классификация, биологические функции. Жирные кислоты: важнейшие представители, зависимость физико-химических свойств от длины и насыщенности радикала, биологические функции. Триглицериды и фосфолипиды: строение, зависимость физико-химических свойств от состава, биологическое значение. Холестерин: строение, биологическое значение.
2. Биологические мембраны: состав (липидные, углеводные и белковые компоненты) и функции. Жидкостно-мозаичная модель мембран. Транспорт веществ через мембраны. Липопротеиды: понятие, общий план строения липопротеидов крови, особенности состава и функции отдельных классов.
3. Пути обмена ацетилкоэнзима А в клетке: синтез и распад жирных кислот, кетоновых тел, синтез холестерина, катаболизм кетогенных аминокислот, сущность и биологическое значение.
4. β-окисление жирных кислот: этапы, ферменты, регуляция. Энергетический баланс окисления жирных кислот и триглицеридов. Биосинтез жирных кислот, этапы, регуляция, биологическое значение. Синтез и распад триглицеридов и фосфолипидов. Связь обмена липидов с циклом Кребса, обменом углеводов и аминокислот. Роль гормонов и нервной системы в регуляции липидного обмена.
Письменное домашнее задание
Обязательное
1. В составе триглицеридов жировой ткани человека преобладает олеиновая кислота. Напишите структурную формулу триглицерида 1,3-диолео-2-стеарина. Составьте схему его полного катаболизма до СО2 и Н2О, рассчитайте энергетический баланс этого процесса.
2. Напишите структурную формулу фосфолипида пальмитоиллиноленоилфосфатидилхолина. Покажите, каким образом этот фосфолипид может принимать участие в построении биологических мембран и липопротеинов крови. Как называются фосфолипиды, содержащие аминоспирт холин?
3. Молекула фосфолипида, описанного в предыдущей задаче, находится в составе частицы липопротеина высокой плотности (ЛПВП). Под действием фермента лецитин: холестеринацилтрансферазы (ЛХАТ) остаток линоленовой кислоты переносится из молекулы фосфолипида на гидроксигруппу холестерина, а фосфолипид превращается в лизолецитин. Напишите структурные формулы холестерина, его эфира холестеринлиноленоата и образовавшегося лизолецитина. Как изменится растворимость этих липидов в воде в результате реакции? Изменится ли положение указанных молекул в составе частицы ЛПВП?
4. К культуре клеток печени добавили пальмитиновую кислоту, меченую радиоактивным углеродом 14С по первому атому. Через некоторое время введенная активность была обнаружена в выделяющемся углекислом газе. Опыт повторили с предварительной обработкой гепатоцитов инсулином: радиоактивный СО2 не выделялся, введенная активность сосредоточилась в цитозоле гепатоцитов. Объясните наблюдаемые закономерности, зная пути метаболизма липидов в печени. В каких еще веществах могла быть обнаружена радиоактивная метка?
Дополнительное
1. Большинство триглицеридов молока содержит короткоцепочечные жирные кислоты с четным числом атомов углерода: каприловую (С8), каприновую (С10), лауриновую (С12). Приведите схему полного катаболизма триглицерида трилаурина до СО2 и Н2О, рассчитайте энергетический баланс этого процесса.
2. Напишите структурную формулу фосфолипида стеароиларахидоноилфосфатидилсерина и покажите его участие в построении биологических мембран. Может ли быть построен липидный бислой мембраны только из молекул данного фосфолипида? Какие классы биологически активных соединений могут синтезироваться из продуктов гидролиза этого фосфолипида?
Типовой вариант тестового контроля по теме «Обмен липидов»
Инструкция: при отсутствии дополнительных указаний в вопросе теста выберите один верный вариант ответа.
1. Как называется соединение следующего строения:
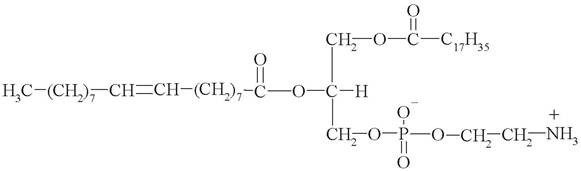
а) стеароиллинолеилфосфатидилэтаноламин;
б) пальмитоилолеилфосфатидилхолин;
в) стеароилолеоилфосфатидилэтаноламин;
г) пальмитоилолеоилфосфатидилэтаноламин;
д) стеароилолеилфосфатидилхолин.
2. Выберите классы липидов, входящих в состав биологических мембран:
а) жирные кислоты и триглицериды;
б) триглицериды и фосфолипиды;
в) фосфолипиды и свободный холестерин;
г) холестерин и его эфиры;
д) жирные кислоты и свободный холестерин.
3. Глюкоза транспортируется через мембрану в клетку по градиенту концентрации с использованием белка-переносчика без затраты энергии АТФ. Такой тип транспорта называется:
а) активный транспорт;
б) вторично активный транспорт;
в) простая диффузия;
г) облегченная диффузия;
д) экзоцитоз.
4. Какую химическую реакцию можно использовать для доказательства ненасыщенности растительного масла:
а) омыление;
б) гидролиз;
в) этерификация;
г) галогенирование;
д) пероксидное окисление.
5. Сколько циклов β-окисления необходимо для полного катаболизма линолевой кислоты:
а) 7;
б) 8;
в) 9;
г) 17;
д) 18.
6. Выберите название фермента, катализирующего следующую реакцию цикла Кноопа - Линена:
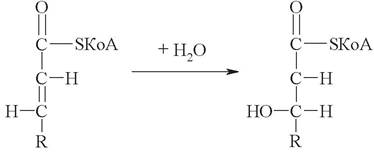
а) ацилкоэнзим А : гидролигаза;
б) еноилкоэнзим А : гидролиаза;
в) ацилкоэнзим А : гидролаза;
г) ацилкоэнзим А : Н2О оксидоредуктаза;
д) еноилкоэнзим А : гидролаза.
7. Какой класс липопротеинов формируется в крови и предназначен для транспорта холестерина в клетки:
а) ЛПОНП;
б) ЛПНП;
в) ЛПВП;
г) ХМ.
8. В каких метаболических процессах может быть использован ацетилкоэнзим А:
а) синтез холестерина, жирных кислот и кетоновых тел;
б) синтез заменимых аминокислот, глюкозы и липидов;
в) синтез ацетилхолина, жирных кислот и глюкозы;
г) синтез холестерина, заменимых аминокислот и кетоновых тел;
д) синтез жирных кислот, ацетилхолина и глюкозы.
9. Вставьте пропущенные слова (3 ответа) в предложение: «При голодании уровень инсулина в крови ..., что приводит к распаду ... жировой ткани и ... концентрации неэтерифицированных жирных кислот в крови».
10. Напишите названия и номера классов ферментов (6 ответов), катализирующих реакции 1, 2 и 3: