БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 16. ОНКОГЕНЕЗ
Опухоли представляют собой группу генных болезней, характеризующихся неконтролируемой клеточной пролиферацией. По способности к распространению в организме их делят на 2 группы: доброкачественные, или локальные, не обладающие способностью прорастать в соседние ткани; злокачественные, способные к разрастанию (инвазии) в определённых тканях и перемещению в другие части тела, давая начало вторичным опухолям (метастазам).
Описано более 100 различных видов рака, хотя 5 из них дают более 50% от всех диагностируемых случаев заболевания. Это — рак лёгкого, молочной железы, толстой и прямой кишки, простаты, матки и яичников (рис. 16-1).
Рис. 16-1. Смертность от разных видов рака среди мужчин и женщин.

Опухоли классифицируют также в зависимости от тканей и типов клеток, из которых они возникли: карциномы — опухоли из клеток эктодермы и эндодермы; саркомы — из клеток мезодермы; гемобластозы (лейкозы и лимфомы) — из камбиальной клетки кроветворной и лимфатической ткани.
После заболеваний ССС рак как причина смертности населения занимает второе место. У человека наиболее изученными причинами рака являются радиация, химические канцерогены и вирусы.
Исследования вирусов как возможной причины онкологических болезней привели к созданию онкогенной теории, которая позволила дать объяснение механизму, с помощью которого различные агенты вызывают превращение нормальной клетки в опухолевую.
I. Физические, химические и биологические агенты, вызывающие возникновение опухолей
Около 80% случаев рака у людей — результат воздействия факторов окружающей среды, под которыми понимают стиль жизни, пищевые продукты, заболевания, увеличивающие риск развития опухолей, и наследственные изменения в геноме.
Агенты, стимулирующие возникновение опухолей (канцерогены), можно разделить на три большие группы: излучения, химические соединения и вирусы.
А. Излучения
Установлено, что УФО, х- и y-лучи оказывают мутагенное и канцерогенное действие. Они повреждают ДНК несколькими способами. Под воздействием излучений из полинуклеотидных цепей могут удаляться азотистые основания и образовываться апуринизированные или апиримидинизированные участки, могут появляться одно- и двухцепочечные разрывы или сшивки. УФО вызывает образование тиминовых димеров (см. раздел 4). Наряду с прямым воздействием х- и y-излучения индуцируют образование в тканях свободных радикалов (O22-, ОН-, ОН•, O2 и др.), воздействие которых на ДНК и другие макромолекулы повреждает генетический аппарат и нарушает матричный синтез в клетке.
Так, в Австралии и Новой Зеландии, где высока интенсивность УФО солнечных лучей, у части населения возникают карциномы и меланомы. Отмечено увеличение случаев заболевания лейкозами у жителей Японии после взрыва на их территории атомных бомб. Учащение случаев рака лёгких наблюдают у шахтёров, работающих с радиоактивными рудами.
Б. Химический канцерогенез
Канцерогенным действием обладает огромное количество различных по химическому строению веществ, основные группы которых представлены в табл. 16-1.
Таблица 16-1. Основные химические канцерогены
Группы веществ |
Представители групп |
Полициклические ароматические углеводороды |
Бензопирен, диметилбензантрацен |
Ароматические амины |
2-Ацетиламинофлуорен, N-метил-4-аминоазобензол |
Нитрозамины |
Диметилнитрозамин, диэтилнитрозамин |
Алкилирующие агенты |
Циклофосфамид, диэтилстильбэстрол |
Природные вещества |
Дактиномицин, афлатоксин В1 |
Неорганические вещества |
Хром, бериллий, асбест, свинец, кадмий |
В печени большинство из этих веществ проканцерогены — соединения, не взаимодействующие с генетическим аппаратом клеток. После дополнительной метаболической модификации они превращаются в канцерогены, способные реагировать с молекулами нуклеиновых кислот и белков, нарушать работу регуляторных механизмов клеток и вызывать рост опухолей. Трансформация клеток под действием канцерогенов получила название химического канцерогенеза.
Установлено, что ферменты детоксикации, участвующие в метаболизме проканцерогенов, обнаруживают поразительный полиморфизм. Отдельные изоформы этих белков имеют низкую активность. У индивидуумов с такими вариантами ферментов проканцерогены медленнее подвергаются метаболическим превращениям и выводятся из организма, не успевая превратиться в активные канцерогены. С этим явлением связаны разная чувствительность людей к канцерогенам табачного дыма и предрасположенность курильщиков к раку лёгкого.
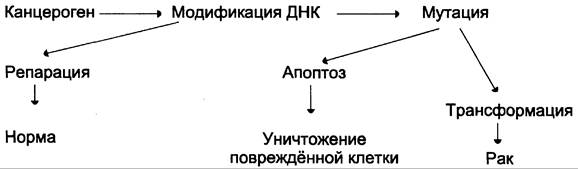
В покоящихся клетках ДНК двухспиральна, и азотистые основания защищены от воздействия повреждающих агентов. Однако в ходе репликации полинуклеотидные цепи очень чувствительны к канцерогенам, и клетки, получившие повреждения, могут иметь разную судьбу (рис. 16-2).
Рис. 16-2. Последствия повреждения ДНК клетки канцерогенами.
Полициклические ароматические углеводороды (ПАУ) входят в состав продуктов неполного сгорания каменного угля и нефти, продуктов пиролиза масел и веществ, найденных в жжёном мясе, а также образуются при курении табака. Они могут связываться с пуриновыми основаниями (особенно гуанином) только после ферментативной активации монооксигеназами (см. раздел 12), работающими при участии различных изоформ цитохрома Р450. Эти ферменты катализируют образование эпоксидов, которые превращаются в диолы с помощью эпоксидгидролазы. Первичные или вторичные эпоксиды, обладая высокой реакционной способностью, могут взаимодействовать с нуклеофильными группами в молекуле ДНК (рис. 16-3).
Рис. 16-3. Образование канцерогенов из ПАУ под действием ферментов детоксикации ксенобиотиков. А и Б — два разных метаболических пути, по которым может превращаться бензо(а)пирен. Путь Б приводит к образованию нереакционноспособного продукта, а путь А превращает бензо(а)пирен в канцероген, способный связываться с остатками гуанина и аденина в молекуле ДНК.

ПАУ стали первыми соединениями, канцерогенность которых была доказана экспериментально в начале XX века, когда из каменноугольной смолы были выделены бензантрацен, бензо(а)- пирен, 7,12-диметилбензантрацен и другие соединения, содержащие конденсированные ароматические кольца. Наблюдения, связывающие контакты людей с определёнными веществами, и развитие рака были описаны значительно раньше. Так, ещё в 1775 г. появилось сообщение о том, что у трубочистов Лондона особенно часто встречается рак мошонки, и было сделано предположение о том, что это объясняется их постоянным контактом с каменноугольной смолой и сажей. Почти в то же время была обнаружена взаимосвязь между употреблением нюхательного табака и раком носа, курением и раком губ или лёгких.
Ароматические амины. К ароматическим аминам относят вещества, использующиеся в производстве анилиновых красителей и резиновой промышленности. Контакт с ними приводит к развитию у рабочих, занятых в указанных производствах, рака мочевого пузыря. Одним из представителей этой группы является 2-нафтиламин, химическая модификация которого происходит главным образом в печени (рис. 16-4).
Рис. 16-4. Метаболизм 2-нафтиламина.
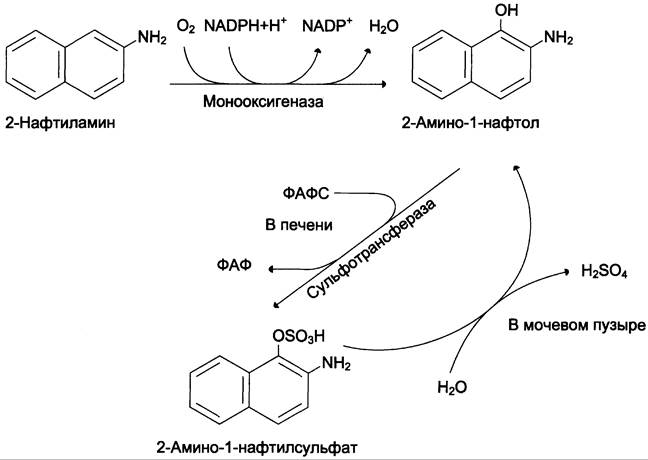
Канцероген 2-амино-1-нафтол образуется в ходе гидроксилирования 2-нафтиламина. Однако в печени он быстро взаимодействует с ФАФС, превращаясь в нейтральный продукт, который выводится с мочой. В мочевом пузыре часть конъюгатов расщепляется гидролазами, присутствующими в незначительных количествах в моче. Вновь образуется 2-амино-1 -нафтол — канцероген, который при повторяющихся контактах человека с нафтиламином вызывает развитие рака мочевого пузыря.
Нитрозамины появляются в организме в результате взаимодействия вторичных алифатических аминов с нитритами. Вторичные амины и нитриты являются постоянными компонентами пищи, поэтому нитрозамины синтезируются при запекании мяса, рыбы. Одно время нитриты широко применялись как консерванты мяса и рыбы, образуются они также в зелёных растениях.
Метаболизм нитрозаминов микросомальной системой окисления приводит к образованию иона метилдиазония, который способен метилировать ДНК клеток, индуцируя возникновение злокачественных опухолей лёгких, желудка, пищевода, печени и почек (рис. 16-5).
Рис. 16-5. Метилирование ДНК продуктами метаболизма нитрозаминов: диметилнитрозамина и N-метилнитрозомочевины.
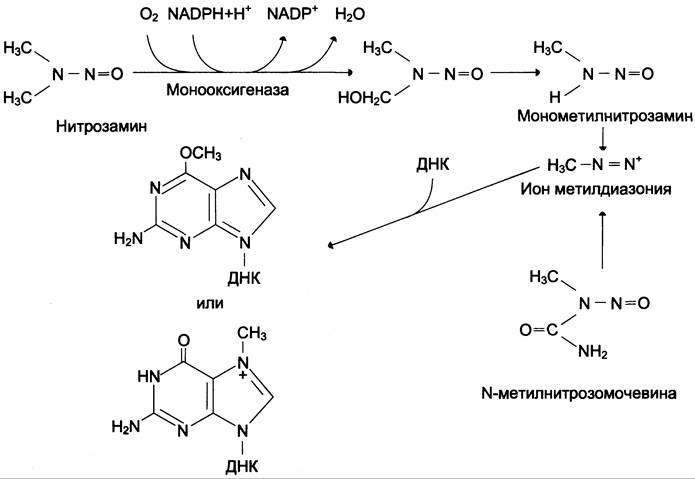
Основным продуктом взаимодействия нитрозаминов с ДНК клетки является N7-метилгуанин-ДНК, но наибольшей канцерогенностью обладает минорный продукт этого взаимодействия — O6-метилированный гуанин-ДНК.
Алкилирующие и ацилирующие агенты, взаимодействуя с нуклеофильными амино- и гидроксильными группами ДНК, могут повреждать структуру генов и индуцировать образование опухолей. Такие соединения, как винилхлорид, используемый в производстве пластмасс и упаковочных материалов, некоторые лекарства, применяемые в лечении опухолей или как иммуносупрессоры (циклофосфамид, бисульфан, диэтилстильбэстрол), можно рассматривать как факторы риска. Лекарственные препараты этой группы соединений способны вызывать вторичные опухоли у небольшого процента больных.
В. ДНК- и РНК- содержащие вирусы
Данные о роли вирусов в развитии опухолей были получены в начале XX столетия. Так, в 1908 г. лейкоз у кур удалось вызвать под действием бесклеточного экстракта из опухолевых клеток, а в 1910 г. Р. Раус описал первый онкогенный вирус, способный инициировать саркому у кур. В 1968 г. российским учёным Л. А. Зильбером была сформулирована вирусно-генетическая теория возникновения опухолей под действием онкогенных вирусов. Хотя вирусный канцерогенез первоначально был описан только у птиц и животных, но в последнее время получены данные об участии вирусов в развитии некоторых опухолей у человека. Так, ДНК-содержащий вирус Эпштейна—Барр вызывает развитие лимфомы Бёркитта, ДНК вируса папилломы — развитие рака кожи и гениталий, РНК-содержащий вирус иммунодефицита человека — возникновение сарком.
ДНК-содержащие вирусы частично, а иногда полностью встраиваются в клеточный геном человека, экспрессируют вирусные гены, в результате чего образующиеся в ядре белки нарушают регуляцию клеточного цикла. К ДНК-содержащим онковирусам, помимо упомянутых выше, относят вирус герпеса, аденовирус, папова-вирус, вирус ветряной оспы. Как правило, эти вирусы вызывают инфекционные болезни и лишь в одном из миллиона случаев — злокачественную трансформацию. С другой стороны, ДНК-содержащий вирус гепатита В, является причиной рака печени, от которого в мире умирает ежегодно около 500 000 человек. При этом инфицирование пациентов происходит, как правило, за 20 —25 лет до возникновения опухоли.
РНК-содержащие вирусы, попадая в клетки человека, синтезируют ДНК с помощью обратной транскриптазы и частично или полностью включают её в геном эукариотов в виде провируса (латентного вируса).
В 1976 г. с помощью техники рекомбинантных ДНК для вируса саркомы Рауса была расшифрована структура генома (рис. 16-6). Наряду с тремя обычно встречающимися у всех вирусов генами был обнаружен ген, ответственный за злокачественную трансформацию. Он назван src-онкогеном, так как выделен из клеток саркомы. Показано, что, когда src-ген встраивается в геном нормальных клеток, растущих в культуре, то они теряют способность к контактному торможению и приобретают все свойства трансформированных клеток.
Рис. 16-6. Структура генома вируса саркомы Рауса. LTR — длинные концевые повторы (от англ. long terminal repeats), содержащие промоторы, к которым присоединяется РНК-полимераза; gаg, pol, env — гены, кодирующие вирусные белки; src — ген, кодирующий тирозиновую протеинкиназу (тир-ПК) с молекулярной массой 60 кД (рр60), которая вызывает нарушение контактного торможения (прекращения деления клеток при возникновении физического контакта между ними) и трансформацию клеток. Обратная транскриптаза — фермент, который синтезирует ДНК на матрице РНК. Благодаря активности этого фермента генетический материал вируса в клетках хозяина превращается в двухцепочечную кольцевую ДНК и может включаться в геном человека.

Г. Наследственная предрасположенность
Наследственные изменения в геноме играют важную роль в канцерогенезе. Так, у детей предрасположенность к ретинобластоме (злокачественная опухоль сетчатки глаза) наследуется как аутосомно-доминантный признак, и примерно 40% случаев заболевания имеют семейный характер. Также наследуется предрасположенность к множественному полипозу толстой кишки, и практически во всех случаях в зрелом возрасте у пациентов образуются аденокарциномы.
Нестабильность хромосомной ДНК может быть связана с дефектом ферментов репарации. Это нарушение встречается у пациентов с пигментной ксеродермой, которая часто сопровождается развитием карциномы кожи на участках, подверженных действию УФО.