БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 2. ЭНЗИМОЛОГИЯ
III. Кофакторы и коферменты
Большинство ферментов для проявления ферментативной активности нуждается в низкомолекулярных органических соединениях небелковой природы (коферментах) и/или в ионах металлов (кофакторах).
Термин «кофермент» был введён в начале XX века и обозначал часть некоторых ферментов, которая легко отделялась от белковой молекулы фермента и удалялась через полупроницаемую мембрану при диализе. Несколько позже было выяснено, что большинство ферментов состоит из термолабильной белковой части и термостабильного небелкового фактора — кофермента. Белковая часть получила название «апофермент», который в отсутствие кофермента не обладает каталитической активностью. Кофермент с белковой молекулой (апоферментом) формируют молекулу холофермента, обладающую каталитической активностью.
А. Кофакторы
Более 25% всех ферментов для проявления полной каталитической активности нуждается в ионах металлов. Рассмотрим роль кофакторов в ферментативном катализе.
1. Роль металлов в присоединении субстрата в активном центре фермента
Ионы металла выполняют функцию стабилизаторов молекулы субстрата, активного центра фермента и конформации белковой молекулы фермента, а именно третичной и четвертичной структур.
Ионы металлов — стабилизаторы молекулы субстрата
Для некоторых ферментов субстратом служит комплекс превращаемого вещества с ионом металла. Например, для большинства киназ в качестве одного из субстратов выступает не молекула АТФ, а комплекс Mg2+-АТФ. В этом случае ион Мg2+ не взаимодействует непосредственно с ферментом, а участвует в стабилизации молекулы АТФ и нейтрализации отрицательного заряда субстрата, что облегчает его присоединение к активному центру фермента (см. схему).
Схема
Схематично роль кофактора при взаимодействии фермента и субстрата можно представить, как комплекс Е-S-Ме, где Е — фермент, S — субстрат, Ме — ион металла.
В качестве примера можно привести расположение субстратов в активном центре гексокиназы (рис. 2-3).
Гексокиназа катализирует перенос концевого, y-фосфатного остатка молекулы АТФ на глюкозу с образованием глюкозо-6-фосфата:
Рис. 2-3. Участие ионов магния в присоединении субстрата в активном центре гексокиназы. В активном центре гексокиназы есть участки связывания для молекулы глюкозы и комплекса Мg2+-АТФ. В результате ферментативной реакции происходит перенос концевого, y-фосфатного остатка молекулы АТФ на глюкозу с образованием глюкозо-6-фосфата.

Ион Мg2+ участвует в присоединении и «правильной» ориентации молекулы АТФ в активном центре фермента, ослабляя фосфоэфирную связь и облегчая перенос фосфата на глюкозу.
Ионы металла — стабилизаторы активного центра фермента
В некоторых случаях ионы металла служат «мостиком» между ферментом и субстратом. Они выполняют функцию стабилизаторов активного центра, облегчая присоединение к нему субстрата и протекание химической реакции. В ряде случаев ион металла может способствовать присоединению кофермента. Перечисленные выше функции выполняют такие металлы, как Мg2+, Мn2+, Zn2+, Со2+, Мо2+. В отсутствие металла эти ферменты активностью не обладают. Такие ферменты получили название «металлоэнзимы». Схематично данный процесс взаимодействия фермента, субстрата и металла можно представить следующим образом:
Е-Ме-S
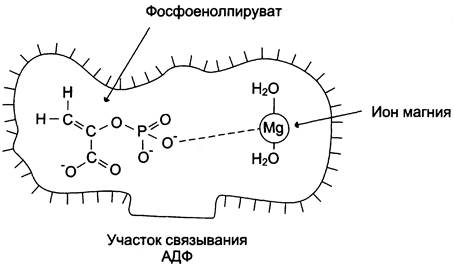
К металлоэнзимам относят, например, фермент пируват киназу (рис. 2-4), катализирующий реакцию:
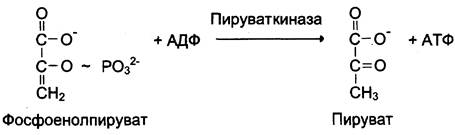
Рис. 2-4. Участие ионов магния в присоединении субстрата в активном центре пируваткиназы. Активный центр пируваткиназы имеет участки связывания для фосфоеноппирувата и АДФ. Мg2+участвует в стабилизации активного центра, что облегчает присоединение фосфоеноппирувата. В ходе ферментативной реакции образуется пируват и АТФ.
2. Роль металлов в стабилизации третичной и четвертичной структуры фермента
Ионы металлов обеспечивают сохранение вторичной, третичной, четвертичной структуры молекулы фермента. Такие ферменты в отсутствие ионов металлов способны к химическому катализу, однако они нестабильны. Их активность снижается и даже полностью исчезает при небольших изменениях pH, температуры и других незначительных изменениях внешнего окружения. Таким образом, ионы металлов выполняют функцию стабилизаторов оптимальной конформации белковой молекулы.
Иногда в стабилизации вторичной и третичной структуры принимают участие ионы щёлочноземельных металлов. Так, для поддержания третичной конформации пируваткиназы необходимы ионы К+.
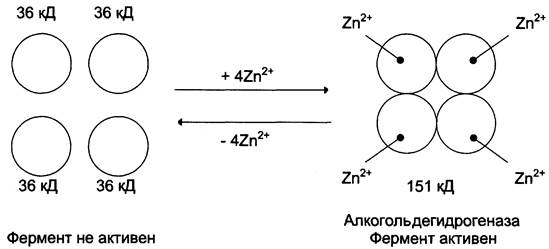
Для стабилизации четвертичной структуры алкогольдегидрогеназы, катализирующей реакцию окисления этанола, необходимы ионы цинка. Алкогольдегидрогеназа состоит из 4 субъединиц с молекулярной массой 151 кД. В состав фермента входят 4 атома Zn2+. Удаление Zn2+ приводит к потере активности фермента за счёт диссоциации на 4 неактивные субъединицы с молекулярной массой 36 кД (рис. 2-5).
Рис. 2-5. Роль ионов цинка в стабилизации четвертичной структуры алкогольдегидрогеназы.
3. Роль металлов в ферментативном катализе
Не менее важную роль отводят ионам металлов в осуществлении ферментативного катализа.
Участие в электрофильном катализе
Наиболее часто эту функцию выполняют ионы металлов с переменной валентностью, имеющие свободную d-орбиталь и выступающие в качестве электрофилов. Это, в первую очередь, такие металлы, как Zn2+, Fе2+, Мn2+, Сu2+. Ионы щелочноземельных металлов, такие как Na+ и К+, не обладают этим свойством. В качестве примера можно рассмотреть функционирование фермента карбоангидразы. Карбоангидраза — цинксодержащий фермент, катализирующий реакцию образования угольной кислоты:
CO2 + H2O <-> H2CO3.
Ион Zn2+ в результате электрофильной атаки участвует в образовании Н+ и ОН- ионов из молекулы воды:

Протон и гидроксильная группа последовательно присоединяются к диоксиду углерода с образованием угольной кислоты (см. схему А).
В ходе электрофильного катализа ионы металлов часто участвуют в стабилизации промежуточных соединений.
Участие в окислительно-восстановительных реакциях
Ионы металлов с переменной валентностью могут также участвовать в переносе электронов. Например, в цитохромах (гемсодержащих белках) ион железа способен присоединять и отдавать один электрон:

Благодаря этому свойству цитохромы участвуют в окислительно-восстановительных реакциях.
Другой пример участия ионов металлов в окислительно-восстановительных реакциях — работа фермента дофамингидроксилазы, катализирующего реакцию образования норадреналина при участии витамина С (см. схему Б).

За окислительно-восстановительные свойства у дофамингидроксилазы отвечает ион меди (рис. 2-6).
Рис. 2-6. Участие иона меди в активации молекулы кислорода при функционировании дофамингидроксилазы. 1 - восстановление Сu2+, входящего в состав активного центра дофамингидроксилазы, до Сu+ с помощью аскорбиновой кислоты; 2 - взаимодействие Сu+ с кислородом с образованием перекисного соединения; 3 - перенос гидроксильной группы на молекулу дофамина с образованием норадреналина.

Фермент, содержащий ион Сu2+, не вступает в реакцию с молекулой кислорода. При восстановлении Сu2+ до Сu+ с помощью аскорбиновой кислоты образуется ион меди, способный взаимодействовать с кислородом с образованием перекисного соединения. Далее гидроксильная группа переносится на молекулу дофамина с образованием норадреналина.
4. Роль металлов в регуляции активности ферментов
Иногда ионы металлов выступают в роли регуляторных молекул. Например, ионы Са2+ служат активаторами фермента протеинкиназы С, катализирующего реакции фосфорилирования белков (см. раздел 5). Ионы Са2+ также изменяют активность ряда кальций-кальмодулинзависимых ферментов (см. подраздел V).
Б. Коферменты
Как уже было сказано, для проявления каталитической активности большинству ферментов необходимо наличие кофермента. Исключение составляют гидролитические ферменты (например, протеазы, липазы, рибонуклеаза), выполняющие свою функцию в отсутствие кофермента.
Кофермент, локализуясь в каталитическом участке активного центра, принимает непосредственное участие в химической реакции, выступая в качестве акцептора и донора химических группировок, атомов, электронов. Кофермент может быть связан с белковой частью молекулы ковалентными и нековалентными связями. В первом случае он называется простетической группой (например, FAD, FMN, биотин, липоевая кислота). Вместе с тем известны примеры, когда кофермент присоединяется к ферменту нековалентными связями настолько прочно, что не диссоциирует от белковой молекулы, например, тиаминдифосфат.
Во втором случае кофермент взаимодействует с ферментом только на время химической реакции и может рассматриваться в качестве второго субстрата. Примеры — NАD+, NАDР+.
Апофермент обеспечивает специфичность действия и отвечает за выбор типа химического превращения субстрата. Один и тот же кофермент, взаимодействуя с различными апоферментами, может участвовать в разных химических превращениях субстрата. Например, пиридоксальфосфат в зависимости от того, с каким апоферментом взаимодействует, участвует в реакциях трансаминирования или декарбоксилирования аминокислот.
Химическая природа коферментов, их функции в ферментативных реакциях чрезвычайно разнообразны. Традиционно к коферментам относят производные витаминов, хотя помимо них есть значительный класс небелковых соединений, принимающих участие в проявлении каталитической функции ферментов.
К коферментам относят следующие соединения:
✵ производные витаминов;
✵ гемы, входящие в состав цитохромов, каталазы, пероксидазы, гуанилатциклазы, NO- синтазы и являющиеся простетической группой ферментов;
✵ нуклеотиды — доноры и акцепторы остатка фосфорной кислоты;
✵ убихинон, или кофермент Q, участвующий в переносе электронов и протонов в ЦПЭ;
✵ фосфоаденозилфосфосульфат, участвующий в переносе сульфата;
✵ S-аденозилметионин (SAM) — донор метальной группы;
✵ глутатион, участвующий в окислительновосстановительных реакциях.
Строение и функции этих коферментов подробно рассмотрены в соответствующих разделах учебника.
В. Мультисубстратные реакции
Большинство ферментов катализирует реакции, в которых участвует более чем один субстрат. В случае если кофермент не является простетической группой, его также можно рассматривать как ещё один субстрат. Следовательно, участников ферментативной реакции может быть несколько: непосредственно фермент, несколько субстратов и кофермент.
В этих случаях механизм ферментативной реакции, как правило, может идти по одному из двух путей: по механизму «пинг-понг» (механизму двойного замещения) или последовательному. Рассмотрим оба механизма.
1. Механизм «пинг-понг»
Схематично механизм «пинг-понг» может быть представлен следующим образом:

Субстрат А, взаимодействуя с ферментом (Е), превращается в продукт (Р1). Фермент остаётся в результате этого преобразования не в нативной форме, а в изменённой (Е') в результате модификации кофермента. Далее к активному центру Е' присоединяется субстрат В, подвергающийся преобразованию в продукт (Р2) с высвобождением нативной формы фермента (Е).
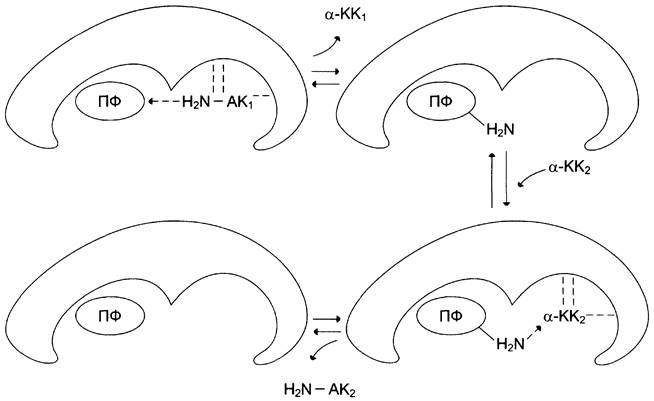
Хороший пример механизма «пинг-понг» — реакции трансаминирования с участием ферментов аминотрансфераз (кофермент пиридоксальфосфат). Аминотрансферазы, открытые отечественным учёным А. Е. Браунштейном, катализируют обратимые реакции переноса аминогруппы с аминокислоты на кетокислоту. Механизм «пинг-понг» данной реакции схематично представлен на рис. 2-7.
Рис. 2-7. События в активном центре аминотрансферазы как пример механизма «пинг-понг». Кофермент пиридоксальфосфат (ПФ), связанный с ферментом, принимает α-аминогруппу от первой аминокислоты (АК1) которая при этом превращается в α-кетокислоту 1 (КК1) и высвобождается из активного центра фермента. Далее в активный центр фермента присоединяется α-кетокислота 2 (КК2), которая забирает аминогруппу от кофермента и превращается в α-аминокислоту (АК2).
Другой пример механизма «пинг-понг» — реакции дегидрирования с участием кофермента FAD (флавинадениндинуклеотид) или FMN (флавинмононуклеотид), которые прочно связаны с ферментом и, следовательно, не могут рассматриваться в качестве второго субстрата.
Схематично структура этих коферментов и соответствующие им химические формулы представлены на рис. 2-8.
Рис. 2-8. Структура (А) и химическое строение (Б) коферментов FMN и FAD.

FMN и FAD участвуют в окислительно-восстановительных реакциях, акцептируя 2 е- и 2 Н+ в изоаллаксазиновом кольце (см. схему ниже).

Схему реакции дегидрирования (как пример механизма «пинг-понг» с участием коферментов FMN и FAD) можно представить в следующем виде:

где АН2 — донор водорода, окисляемый субстрат 1; А — окисленная форма субстрата 1; В — акцептор водорода — субстрат 2; ВН2 — восстановленная форма субстрата 2; Е (FAD), Е (FADH2) — окисленная и восстановленная формы кофермента FAD, входящего в состав фермента Е.
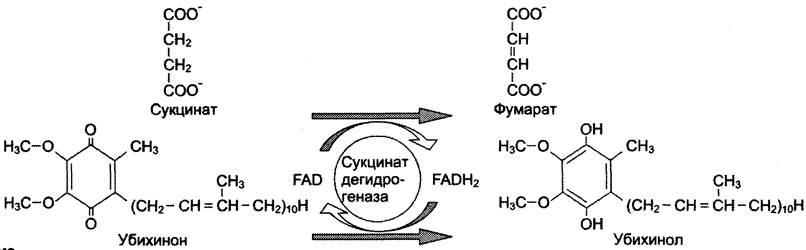
В качестве примера FAD-зависимой реакции можно привести сукцинатдегидрогеназную реакцию. В этой реакции в качестве второго субстрата участвует убихинон — один из посредников ЦПЭ (см. схему).
2. Последовательный механизм
В случае последовательного механизма для протекания ферментной реакции требуется одновременно взаимодействие двух субстратов. В этом случае возможно присоединение субстратов двумя различными путями:
Механизм упорядоченного взаимодействия субстрата с активным центром фермента:

Первым в активный центр фермента присоединяется субстрат А, облегчая присоединение субстрата В. После химической модификации также наблюдают определённый порядок высвобождения продуктов реакции.
Механизм случайного взаимодействия субстрата с активным центром фермента:
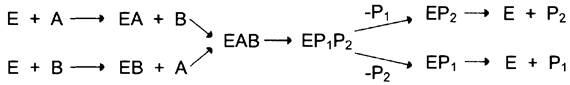
Приоритетности за взаимодействие субстратов А и В в активном центре фермента нет (каждый субстрат имеет свой центр связывания в активном центре). Также нет строгой закономерности высвобождения продуктов реакции.
Примером последовательного упорядоченного механизма может быть реакция дегидрирования с участием коферментов NАD+, NАDР+.
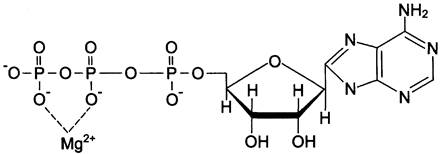
Схематично структура и химические формулы этих коферментов представлены на рис. 2-9.
Рис. 2-9. Структура (А) и химическое строение (Б) коферментов NAD+ и NАDР+.
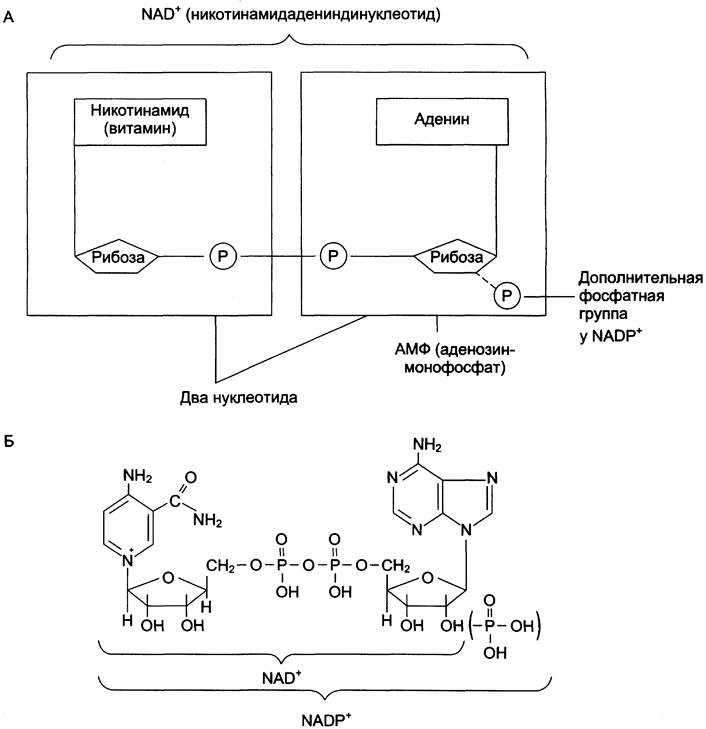
Оба кофермента функционируют как посредники переноса двух электронов и одного протона от донора к акцептору, другого протона — в среду (см. схему А).
Донор и акцептор не обязательно участвуют в одном метаболическом пути. Другими словами, восстановленная форма этих нуклеотидов действует как общий пул электронов, образованный в результате окислительных реакций, и может быть использована в различных восстановительных реакциях. Такие реакции называют сопряжёнными (см. схему Б).
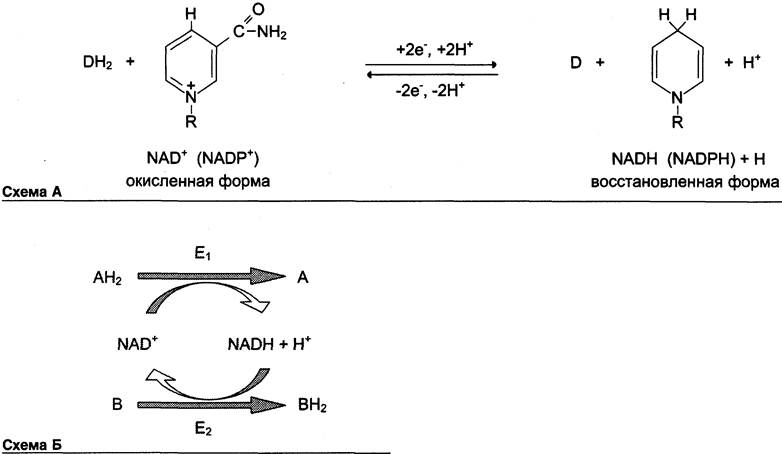
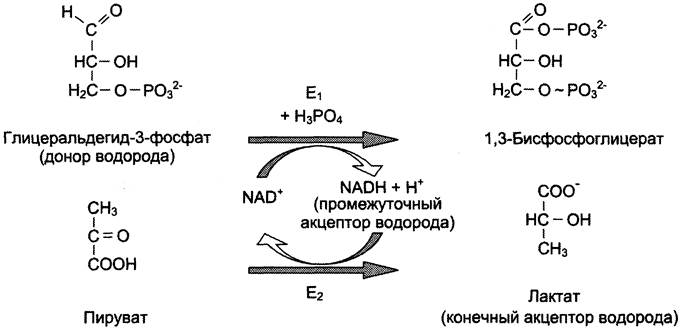
где АН2 — донор водорода, восстановленная форма субстрата 1; А — окисленная форма субстрата 1; В — акцептор водорода — второй субстрат; ВН2 — восстановленная форма субстрата 2; NAD+, NADH — окисленная и восстановленная формы кофермента; Е1 и Е2 — ферменты.
Две ферментативные реакции, катализируемые ферментами Е1 и Е2, сопряжены друг с другом посредством кофермента NAD+, служащего в каждом из этих случаев субстратом. Для первого фермента субстратом служит окисленная форма NAD, в качестве второго субстрата выступает донор водорода — пример последовательных реакций, продуктом — восстановленная форма NAD, для фермента Е2 — наоборот.
В качестве примера можно рассмотреть следующие сопряжённые реакции (см. схему), где Е1 — глицеральдегидфосфат дегидрогеназа; Е2 — лактатдегцдрогеназа.
схема