БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 2. ЭНЗИМОЛОГИЯ
IX. Применение ферментов в медицине
Ферментные препараты широко используют в медицине. Ферменты в медицинской практике находят применение в качестве диагностических (энзимодиагностика) и терапевтических (энзимотерапия) средств. В этом разделе мы остановимся на основных принципах энзимо- диагностики и энзимотерапии.
Кроме того, ферменты используют в качестве специфических реактивов для определения ряда веществ. Так, глюкозооксидазу применяют для количественного определения глюкозы в моче и крови. Фермент уреазу используют для определения содержания количества мочевины в крови и моче. С помощью различных дегидрогеназ обнаруживают соответствующие субстраты, например, пируват, лактат, этиловый спирт и др.
А. Энзимодиагностика
Энзимодиагностика заключается в постановке диагноза заболевания (или синдрома) на основе определения активности ферментов в биологических жидкостях человека. Принципы эн- зимодиагностики основаны на следующих позициях:
✵ при повреждении клеток в крови или других биологических жидкостях (например, в моче) увеличивается концентрация внутриклеточных ферментов повреждённых клеток;
✵ количество высвобождаемого фермента достаточно для его обнаружения;
✵ активность ферментов в биологических жидкостях, обнаруживаемых при повреждении клеток, стабильна в течение достаточно длительного времени и отличается от нормальных значений;
✵ ряд ферментов имеет преимущественную или абсолютную локализацию в определённых органах (органоспецифичность);
✵ существуют различия во внутриклеточной локализации ряда ферментов.
1. Причины, приводящие к увеличению количества ферментов в крови
Ферменты плазмы крови можно разделить на 2 группы. Первая, относительно небольшая группа ферментов активно секретируется в плазму крови определёнными органами. Например, печень синтезирует неактивные предшественники ферментов свёртывающей системы крови. Ко второй относят большую группу ферментов, высвобождающихся из клеток во время их нормального функционирования. Обычно эти ферменты выполняют свою функцию внутри клетки и не имеют физиологического значения в плазме крови. У здорового человека активность этих ферментов в плазме низкая и достаточно постоянная, так как постоянно соотношение скоростей высвобождения их из клеток и скоростей разрушения.
При многих заболеваниях происходит повреждение клеток, и их содержимое, в том числе и ферменты, высвобождаются в кровь. К причинам, вызывающим высвобождение внутриклеточного содержимого в кровь, относят нарушение проницаемости мембраны клеток (при воспалительных процессах) или нарушение целостности клеток (при некрозе). Определение в крови активности ряда ферментов хорошо налажено в биохимических лабораториях, что используют для диагностики заболеваний сердца, печени, скелетной мускулатуры и других тканей. Уровень активности ферментов в плазме коррелирует со степенью повреждения клеток.
Для энзимодиагностики имеют большое значение знания о субклеточной локализации ферментов. Так, появление в плазме крови ферментов, имеющих только цитозольную локализацию, свидетельствует о воспалительном процессе; при обнаружении митохондриальных или ядерных ферментов можно говорить о более глубоких повреждениях клетки, например, о некрозе.
Однако повышение концентрации ферментов не всегда связано с повреждением тканей. При избыточной клеточной пролиферации, например, при онкопролиферативных процессах, при повышенной скорости синтеза некоторых ферментов в клетках или при нарушенном клиренсе (способности выводиться почками) наблюдают повышение концентрации в крови определённых ферментов. Врачам следует учитывать, что нормальные значения активности ферментов в крови детей и беременных женщин отличаются от показателей, характерных для взрослых здоровых людей.
2. Изоферменты
Ферменты, катализирующие одну и ту же химическую реакцию, но отличающиеся по первичной структуре белка, называют изоферментами, или изоэнзимами. Они катализируют один и тот же тип реакции с принципиально одинаковым механизмом, но отличаются друг от друга кинетическими параметрами, условиями активации, особенностями связи апофермента и кофермента.
Природа появления изоферментов разнообразна, но чаще всего обусловлена различиями в структуре генов, кодирующих эти изоферменты. Следовательно, изоферменты различаются по первичной структуре белковой молекулы и, соответственно, по физико-химическим свойствам. На различиях в физико-химических свойствах основаны методы определения изоферментов.
По своей структуре изоферменты в основном являются олигомерными белками. Причём та или иная ткань преимущественно синтезирует определённые виды протомеров. В результате определённой комбинации этих протомеров формируются ферменты с различной структурой — изомерные формы. Обнаружение определённых изоферментных форм ферментов позволяет использовать их для диагностики заболеваний.
Изоформы лактатдегидрогеназы. Фермент лактатдегидрогеназа (ЛДГ) катализирует обратимую реакцию окисления лактата (молочной кислоты) до пирувата (пировиноградной кислоты) (см. раздел 7).

Лактатдегидрогеназа — олигомерный белок с молекулярной массой 134 000 Д, состоящий из 4 субъединиц 2 типов: М (от англ. muscle — мышца) и Н (от англ. heart — сердце). Комбинация этих субъединиц лежит в основе формирования 5 изоформ лактатдегидрогеназы (рис. 2-35, А). ЛДГ1 и ЛДГ2 наиболее активны в сердечной мышце и почках, ЛДГ4 и ЛДГ5 — в скелетных мышцах и печени. В остальных тканях имеются различные формы этого фермента.
✵ Изоформы ЛДГ отличаются электрофоретической подвижностью, что позволяет устанавливать тканевую принадлежность изоформ ЛДГ (рис. 2-35, Б).
Рис. 2-35. Изоформы лактатдегидрогеназы. А — строение различных изоформ ЛДГ; Б — распределение на электрофорег- рамме и относительные количества изоформ ЛДГ в различных органах; В — содержание изоформ ЛДГ в плазме крови в норме и при патологии (электрофореграммы — слева и фотометрическое сканирование — справа).

✵ Появление в эволюции различных изоформ ЛДГ обусловлено особенностями окислительного метаболизма тканей. Изоферменты ЛДГ4 и ЛДГ5 (М-типы ЛДГ) работают эффективно в анаэробных условиях, ЛДГ1 и ЛДГ2 (Н-типы) — в аэробных, когда пируват быстро окисляется до СO2 и Н2O, а не восстанавливается до молочной кислоты.
✵ При ряде заболеваний исследуют активность ЛДГ в плазме крови. В норме активность ЛДГ составляет 170 — 520 ЕД/л. Повышение активности наблюдают при острых поражениях сердца, печени, почек, а также при мегалобластных и гемолитических анемиях. Однако это указывает на повреждение лишь одной из перечисленных тканей.
✵ Для постановки диагноза необходимо исследование изоформ ЛДГ в плазме крови методом электрофореза. На рис. 2-35, В представлены электрофореграммы плазмы крови здорового человека, больного инфарктом миокарда и больного гепатитом. Выявление в плазме крови тканеспецифических изоформ ЛДГ используют в качестве диагностического теста повреждения данной ткани.
Изоформы креатинкиназы. Креатинкиназа (КК) катализирует реакцию образования креатинфосфата:
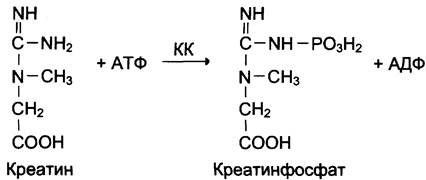
Молекула КК — димер, состоящий из субъединиц двух типов: М (от англ. muscle — мышца) и В (от англ. brain — мозг). Из этих субъединиц образуются 3 изофермента — ВВ, МВ, ММ. Изофермент ВВ находится преимущественно в головном мозге, ММ — в скелетных мышцах и МВ — в сердечной мышце. Изоформы КК имеют разную электрофоретическую подвижность (рис. 2-36).
Рис. 2-36. Структура и электрофоретическая подвижность различных изоформ креатинкиназы.
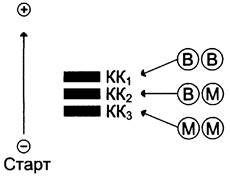
Активность КК в норме не должна превышать 90 МЕ/л. Определение активности КК в плазме крови имеет диагностическое значение при инфаркте миокарда (происходит повышение уровня МВ-изоформы). Количество изоформы ММ может повышаться при травмах и повреждениях скелетных мышц. Изоформа ВВ не может проникнуть через гематоэнцефалический барьер, поэтому в крови практически не определяется даже при инсультах и диагностического значения не имеет.
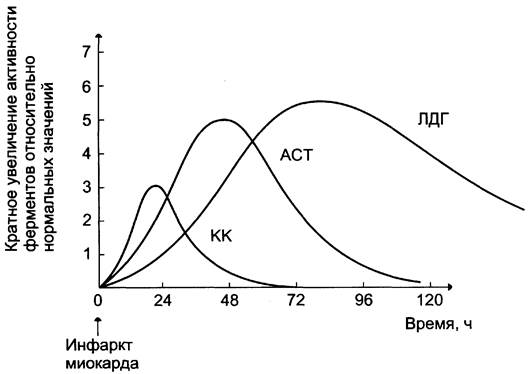
Рис. 2-37. Изменение активности ферментов в плазме крови при инфаркте миокарда.
3. Энзимодиагностика при инфаркте миокарда
Примерно 30% больных инфарктом миокарда имеют атипичную клиническую картину этого заболевания. Поэтому необходимо проводить дополнительные методы исследования для подтверждения повреждения сердечной мышцы.
При инфаркте миокарда наблюдают достоверные изменения в крови активности ферментов КК, ЛДГ и аспартатаминотрансферазы — ACT, которые зависят от времени, прошедшего от начала развития инфаркта и от зоны тканевого повреждения. Типичную кривую изменения активности этих ферментов можно видеть на рис. 2-37. После закупорки (окклюзии) коронарного сосуда в крови вначале отмечают повышение активности КК изоформы МВ, однако фермент быстро удаляется из кровотока. Обнаружение повышенной активности КК в плазме крови — основной энзимодиагностический критерий инфаркта миокарда. Если у пациента с загрудинными болями не обнаружено изменения в активности КК, диагноз инфаркта миокарда маловероятен.
Дополнительным подтверждением диагноза инфаркта миокарда служит обнаружение активностей ферментов ACT и ЛДГ в крови больных. Динамика изменений этих активностей также представлена на этом рисунке. Активность ACT в норме составляет 5 — 40 МЕ/л. При инфаркте миокарда активность ACT повышается через 4 — 6 ч; максимум активности наблюдают в течение 2 — 3 дней. Уровень ЛДГ также увеличивается в плазме крови через несколько часов после закупорки кровеносного сосуда; максимум активности наблюдают на 3 — 4-й день, затем наступает постепенная нормализация активности. Уровень повышения активности ЛДГ коррелирует с размерами повреждения сердечной мышцы.
Б. Применение ферментов в качестве лекарственных средств
Использование ферментов в качестве терапевтических средств имеет много ограничений вследствие их высокой иммуногенности. Тем не менее энзимотерапию активно развивают в следующих направлениях:
✵ заместительная терапия — использование ферментов в случае их недостаточности;
✵ элементы комплексной терапии — применение ферментов в сочетании с другой терапией.
Заместительная энзимотерапия эффективна при желудочно-кишечных заболеваниях, связанных с недостаточностью секреции пищеварительных соков. Например, пепсин используют при ахилии, гипо- и анацидных гастритах. Дефицит панкреатических ферментов также в значительной степени может быть компенсирован приёмом внутрь препаратов, содержащих основные ферменты поджелудочной железы (фестал, энзистал, мезим-форте и др.).
В качестве дополнительных терапевтических средств ферменты используют при ряде заболеваний. Протеолитические ферменты (трипсин, химотрипсин) применяют при местном воздействии для обработки гнойных ран с целью расщепления белков погибших клеток, для удаления сгустков крови или вязких секретов при воспалительных заболеваниях дыхательных путей. Ферментные препараты рибонуклеазу и дезоксирибонуклеазу используют в качестве противовирусных препаратов при лечении аденовирусных конъюнктивитов, герпетических кератитов.
Ферментные препараты стали широко применять при тромбозах и тромбоэмболиях. С этой целью используют препараты фибринолизина, стрептолиазы, стрептодеказы, урокиназы.
Фермент гиалуронидазу (лидазу), катализирующий расщепление гиалуроновой кислоты, используют подкожно и внутримышечно для рассасывания контрактур рубцов после ожогов и операций (гиалуроновая кислота образует сшивки в соединительной ткани) (см. раздел 8).
Ферментные препараты используют при онкологических заболеваниях. Аспарагиназа, катализирующая реакцию катаболизма аспарагина, нашла применение для лечения лейкозов:
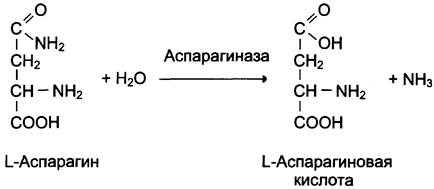
Предпосылкой антилейкемического действия аспарагиназы послужило обнаружение в лейкозных клетках дефектного фермента аспарагин- синтетазы, катализирующего реакцию синтеза аспарагина (см. схему ниже).
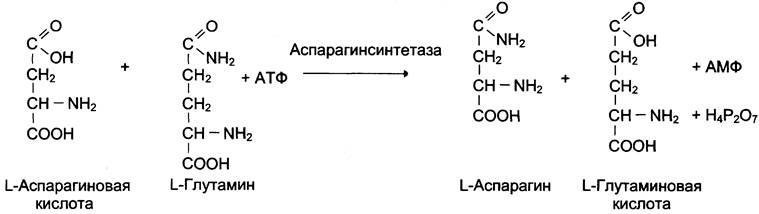
Лейкозные клетки не могут синтезировать аспарагин и получают его из плазмы крови. Если имеющийся в плазме аспарагин разрушать введением аспарагиназы, то в лейкозных клетках наступит дефицит аспарагина и в результате — нарушение метаболизма клетки.