БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 6. ЭНЕРГЕТИЧЕСКИЙ ОБМЕН
III. Заключительный этап катаболизма — основной источник доноров водорода для ЦПЭ
Углеводы, жирные кислоты и большинство аминокислот окисляются в конечном счёте через цикл лимонной кислоты до СО2 и Н2О. Прежде, чем эти вещества вовлекаются в заключительный этап катаболизма, их углеродный скелет превращается в двухуглеродный фрагмент в форме ацетил-КоА (рис. 6-19). Именно в этой форме большая часть «топливных» молекул включается в цикл лимонной кислоты.
Рис. 6-19. Катаболизм основных пищевых веществ. 1 — 3 — пищеварение; 4 — 8 — специфические пути катаболизма; 9 — 10 — заключительный (общий путь) катаболизма; 11 — ЦПЭ; 12 — окислительное фосфорилирование.
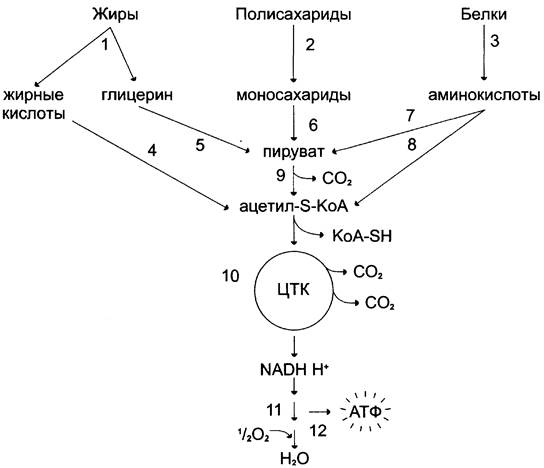
Ацетил-КоА образуется в специфических реакциях катаболизма жирных кислот и некоторых аминокислот (см. разделы 8 и 9). Однако главным источником ацетил-КоА служит пировиноградная кислота, образующаяся в реакциях катаболизма глюкозы и некоторых аминокислот (см. разделы 7, 9).
Превращение пирувата в ацетил-КоА происходит при участии набора ферментов, структурно объединённых в пируватдегидрогеназный комплекс (ПДК). Ацетильный остаток — ацетил-КоА далее окисляется в цикле лимонной кислоты до СO2 и Н2O. В этих реакциях окисления принимают участие NAD- и FAD-зависимые дегидрогеназы, поставляющие электроны и протоны в ЦПЭ, по которой они передаются на O2.
А. Окислительное декарбоксилирование пирувата
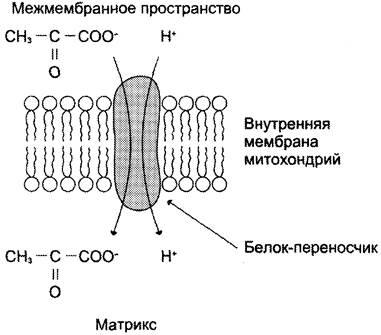
Окислительное декарбоксилирование пирувата происходит в матриксе митохондрий. Транспорт пирувата в митохондриальный матрикс через внутреннюю мембрану митохондрий осуществляется при участии специального белка-переносчика по механизму симпорта с Н+ (рис. 6-20).
Рис. 6-20. Транспорт пирувата через митохондриальную мембрану.
Превращение пирувата в ацетил-КоА описывают следующим суммарным уравнением:
СН3-СО-СООН + NAD+ + HSКоА —> СН3-СО ~ SКоА + NADH + Н+ + СO2.
В ходе этой реакции происходит окислительное декарбоксилирование пирувата, в результате которого карбоксильная группа удаляется в виде СO2, а ацетильная группа включается в состав ацетил-КоА. Один атом водорода оказывается в составе NАDН, а другой в виде Н+ поступает в среду. Реакция необратима, поскольку ∆G°′ = -33,5 кДж/моль.
1. Строение пируватдегидрогеназного комплекса
Процесс окислительного декарбоксилирования пирувата катализирует сложноорганизованный пируватдегидрогеназный комплекс. В пируватдегидрогеназный комплекс (ПДК) входят 3 фермента: пируватдекарбоксилаза (Е1), дигидролипоилтрансацетилаза (Е2) и дигидролипоилдегидрогеназа (Е3), а также 5 коферментов: тиаминдифосфат (ТДФ), липоевая кислота, FAD, NAD+ и КоА. Кроме того, в состав комплекса входят регуляторные субъединицы: протеинкиназа и фосфопротеинфосфатаза (табл. 6-5).
Таблица 6-5. Пируватдегидрогеназный комплекс (ПДК) млекопитающих
Фермент |
Число мономеров |
Кофермент |
Витамин |
|
1. Пируватдекарбоксилаза (пируватдегидрогеназа) |
E1 |
120 (30 тетрамеров) |
ТДФ |
B1 |
2. Дигидролипоилтранс- ацетилаза |
Е2 |
180 (60 тримеров) |
Липоамид КоА |
Липоевая кислота (ЛК) Пантотеновая кислота |
3. Дигидро- липоилдегидрогеназа |
Е3 |
12 (6 димеров) |
FAD NAD+ |
В2 РР |
Все эти ферменты и коферменты объединены в мультиферментную систему, содержащую разные количества каждого из ферментов и имеющую молекулярную массу более 6 x 106.
В центре комплекса располагается дигидролипоилтрансацетилаза (Е2), образуя его ядро. К дигидролипоилтрансацетилазе присоединены молекулы: пируватдекарбоксилазы (Е1) и дигидролипоилдегидрогеназы (Е3).
Пируватдекарбоксилаза содержит прочно связанный с белковой частью ТДФ, а дигидролипоилдегидрогеназа — FAD.
Липоиллизиновые группы центрального фермента (Е2) функционируют как поворотные «кронштейны», переносящие атомы водорода и ацетильные группы от одной ферментной молекулы комплекса к другой.
2. Окислительное декарбоксилирование пирувата
Превращение пирувата в ацетил-КоА включает 5 стадий (рис. 6-21).
Рис. 6-21. Последовательность реакций, катализируемых ПДК. I — Е1 катализирует декарбоксилирование пирувата и перенос С2-фрагмента на ТДФ; II — Е2 катализирует окисление гидроксиэтильной группы и перенос С2-фрагмента на липоевую кислоту (ЛК); III — ацетилированная дигидролипоилтрансацетилаза взаимодействует с КоА с образованием восстановленной формы пипоевой кислоты и ацетип-КоА; IV — окисленная форма трансацетипазы регенерируется при участии Е3; V — окисленная форма Е3регенерируется при участии NAD+.
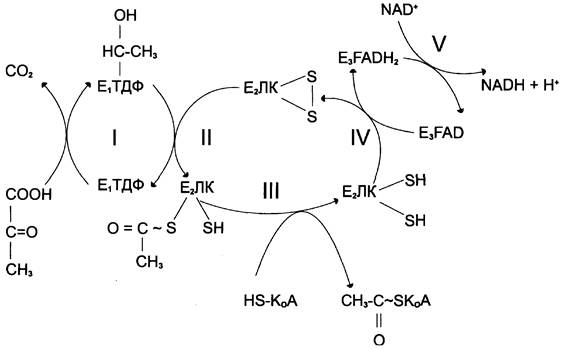
Стадия I. На этой стадии пируват соединяется с ТДФ в составе Е1 и подвергается декарбоксилированию.
Пируват + Е1-ТДФ —> Гидроксиэтил-ТДФ + СО2
В результате этой реакции образуется производное ТДФ с гидроксиэтильной группой при тиазоловом кольце (рис. 6-22).
Рис. 6-22. Тиаминдифосфат (ТДФ) и гидроксиэтил-ТДФ. Рабочей частью ТДФ служит тиазоловое кольцо, к которому присоединяется продукт декарбоксилирования пирувата — гидроксиэтил.

Стадия II. Дигидролипоилтрансацетилаза (Е2) катализирует перенос атома водорода и ацетильной группы от ТДФ на окисленную форму липоиллизиновых групп с образованием ацетилтииоэфира липоевой кислоты (рис. 6-21).
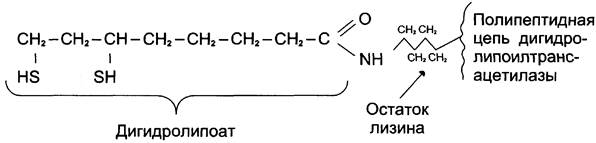
Стадия III. На стадии III КоА взаимодействует с ацетильным производным Е2, в результате чего образуются ацетил-КоА и полностью восстановленный липоильный остаток, простетическая группа Е2 (рис. 6-23).
Рис. 6-23. Липоевая кислота в составе дигидролипоилтрансацетилазы (Е2). Липоевая кислота или липоильная группа могут существовать в окисленной (дисульфидной ЛК-SS) и восстановленной (ЛК-(SН)2) формах. В составе дигидролипоилтрансацетилазы липоевая кислота связана с белком через остаток лизина амидной связью. Липоевая кислота играет роль витамина или фактора роста у некоторых микроорганизмов, тогда как высшие животные способны её синтезировать.
Стадия IV. На стадии IV дигидролипоилдегидрогеназа (Е3) катализирует перенос атомов водорода от восстановленных липоильных групп на FAD — простетическую группу фермента Е3.
Стадия V. На стадии V восстановленный FADH2 передаёт водород на NAD+ с образованием NADH.
Пируватдегидрогеназный комплекс характеризуется большим отрицательным окислительно-восстановительным потенциалом, который обеспечивает наряду с восстановлением кофермента (NADH) образование высокоэнергетической тиоэфирной связи в ацетил-КоА.
Структурное объединение 3 видов ферментов создаёт возможности для координации отдельных этапов сложной ферментативной реакции. Все промежуточные продукты реакции окислительного декарбоксилирования пирувата прочно связаны с комплексом, что увеличивает суммарную скорость процесса и сводит к минимуму побочные реакции.
Пируватдегидрогеназный комплекс, как и все белки, участвующие в реакциях ЦТК, кодируется ядерной ДНК. Транспорт субъединиц ПДК в митохондрии происходит сложным путём за счёт энергии АТФ или трансмембранного электрохимического потенциала при участии белков теплового шока, или шаперонов (см. раздел 1), предотвращающих их преждевременный фолдинг до поступления в митохондриальный матрикс или внутреннюю мембрану митохондрий.
3. Связь окислительного декарбоксилирования пирувата с ЦПЭ
Окислительное декарбоксилирование пирувата сопровождается образованием NАDН, поставляющим электроны в дыхательную цепь и обеспечивающим синтез 3 молей АТФ на 1 моль пирувата путём окислительного фосфорилирования.
Так как отношения АДФ/АТФ и NАDН/NАD+ в клетке относительно постоянны, ускорение утилизации АТФ приводит к повышению концентрации АДФ и ускорению окисления МАЛИ в дыхательной цепи. Повышение концентрации NАD+, в свою очередь, стимулирует окислительное декарбоксилирование пирувата. Напротив, повышение концентрации АТФ и NАDН снижает скорость этого процесса. Таким образом, изменения отношений АДФ/АТФ и NАDН/ NАD+ — важнейшие сигналы, отражающие энергетические потребности клетки и регулирующие скорость окислительного декарбоксилирования пирувата. Каталитическая активность пируват- дегидрогеназного комплекса снижается, когда в клетках имеется достаточно «топлива» в виде жирных кислот и ацетил-КоА.
Б. Цикл лимонной кислоты
Цикл лимонной кислоты (цитратный цикл, цикл Кребса, цикл трикарбоновых кислот, ЦТК) — заключительный этап катаболизма, в котором углерод ацетильного остатка ацетил-КоА окисляется до 2 молекул СO2. Атомы водорода, освобождающиеся в окислительно-восстановительных реакциях, доставляются в ЦПЭ при участии NAD- и FAD-зависимых дегидрогеназ, в результате чего происходят синтез воды и окислительное фосфорилирование АДФ. Связь между атомами углерода в ацетил- КоА устойчива к окислению. В условиях организма окисление ацетильного остатка происходит в несколько этапов, образующих циклический процесс из 8 реакций (рис. 6-24).
1. Последовательность реакций цитратного цикла
Образование цитрата
В реакции образования цитрата углеродный атом метильной группы ацетил-КоА связывается с карбонильной группой оксалоацетата (рис. 6-24); одновременно расщепляется тиоэфирная связь и освобождается коэнзим A (∆G°′ = -37,6 кДж/моль).
Равновесие реакции в клетке сильно сдвинуто вправо, о чём свидетельствует отрицательная величина стандартной свободной энергии. Реакция сопровождается потерей большого количества энергии в виде теплоты. Катализирует реакцию цитратсинтаза, фермент, локализованный в матриксе митохондрий.
Превращение цитрата в изоцитрат
Вторая реакция цитратного цикла — обратимое превращение цитрата в изоцитрат (рис. 6-24). Фермент, катализирующий эту реакцию, назван аконитазой по промежуточному продукту, цис-аконитовой кислоте, которая предположительно образуется в реакции. Однако это соединение не обнаруживается в свободном виде, так как не отделяется от активного центра фермента до завершения реакции.
Окислительное декарбоксилирование изоцитрата
Эту реакцию катализирует изоцитратдегидрогеназа. Существуют 2 формы изоцитратдегидрогеназы: одна содержит в качестве кофермента NAD+, вторая — NADP+. NAD-зависимый фермент локализован в митохондриях и участвует в ЦТК; (NADP-зависимый фермент, присутствующий и в митохондриях, и в цитоплазме, играет иную метаболическую роль). В результате действия этого фермента на изоцитрат образуется α-кетоглутарат (см. рис. 6-24).
Реакция, катализируемая NAD-зависимой изоцитратдегидрогеназой, — самая медленная реакция цитратного цикла. АДФ — аллостерический активатор фермента.
Окислительное декарбоксилирование α-кетоглутарата
В этой реакции α-кетоглутарат подвергается окислительному декарбоксилированию с образованием в качестве конечных продуктов сукцинил-КоА, СO2 и NADH + Н+. В результате этой реакции образуется сукцинил-КоА (см. рис. 6-24).
Рис. 6-24. Общая схема цитратного цикла. Цифры 1-8 обозначают реакции цитратного цикла. Цикл начинается с того, что ацетильный остаток конденсируется с оксалоацетатом, в результате чего образуется шестиуглеродное соединение — цитрат. На образование цитрата в каждом обороте цикла расходуется одна молекула оксалоацетата; в результате завершения цикла происходит регенерация оксалоацетата. Таким образом, одна молекула оксалоацетата может многократно использоваться для окисления ацетильных остатков.
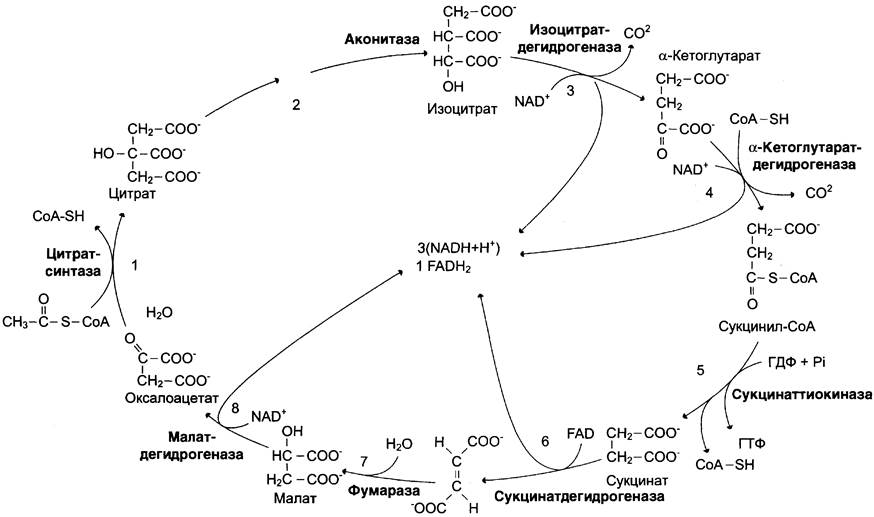
Реакцию катализирует α-кетоглутаратдегидрогеназный комплекс, который по структуре и функциям сходен с пируватдегидрогеназным комплексом (ПДК). Подобно ПДК, он состоит из 3 ферментов: α-кетоглутаратдекарбоксилазы, дигидролипоилтранссукцинилазы и дигидролипоилдегидрогеназы. Кроме того, в этот ферментный комплекс входят 5 коферментов: тиаминдифосфат, кофермент А, ли- поевая кислота, NAD+ и FAD. Существенное отличие этой ферментной системы от ПДК — то, что она не имеет сложного механизма регуляции, какой характерен для ПДК. В частности, в этом комплексе отсутствуют регуляторные субъединицы. Равновесие реакции окислительного декарбоксилирования α-кетоглутарата сильно сдвинуто в сторону образования сукцинил-КоА, и её можно считать однонаправленной.
Превращение сукцинил-КоА в сукцинат
Сукцинил-КоА — высокоэнергетическое соединение. Изменение свободной энергии гидролиза этого тиоэфира составляет ∆G°′ = -35,7 кДж/моль. В митохондриях разрыв тиоэфирной связи сукцинил-КоА сопряжён с реакцией фосфорилирования гуанозиндифосфата (ГДФ) до гуанозинтрифосфата (ГТФ).
Сукцинил-КоА —> Сукцинат (∆G° = -10,36 кДж/моль).
Эту сопряжённую реакцию (см. рис. 6-24) катализирует сукцинаттиокиназа. Промежуточный этап реакции — фосфорилирование молекулы фермента по одному из гистидиновых остатков активного центра. Затем остаток фосфорной кислоты присоединяется к ГДФ с образованием ГТФ.
С ГТФ концевая фосфатная группа может переноситься на АДФ с образованием АТФ; эту обратимую реакцию катализирует нуклеозид- дифосфаткиназа.
ГТФ + АДФ <-> ГДФ + АТФ.
Образование высокоэнергетической фосфо- ангидридной связи за счёт энергии субстрата (сукцинил-КоА) — пример субстратного фосфорилирования.
Дегидрирование сукцината
Образовавшийся на предыдущем этапе сукцинат превращается в фумарат под действием сукцинатдегидрогеназы (см. рис. 6-24). Этот фермент — флавопротеин, молекула которого содержит прочно связанный кофермент FAD.
Сукцинат дегидрогеназа прочно связана с внутренней митохондриальной мембраной. Она состоит из 2 субъединиц, одна из которых связана с FAD. Кроме того, обе субъединицы содержат железосерные центры; одна — Fe2S2, а другая — Fe4S4. В железосерных центрах атомы железа меняют свою валентность, участвуя в транспорте электронов.
Образование малата из фумарата
Образование малата происходит при участии фермента фумаратгидратазы (см. рис. 6-24). Этот фермент более известен как фумараза.
Фумараза — олигомерный белок, состоящий из 4 идентичных полипептидных цепей. Он расположен в матриксе митохондрий. Фумаразу относят к ферментам с абсолютной субстратной специфичностью: она катализирует гидратацию только трансформы фумарата.
Дегидрирование малата
В заключительной стадии цитратного цикла малат дегидрируется с образованием оксалоа- цетата (см. рис. 6-24). Реакцию катализирует NAD-зависимая малатдегидрогеназа, содержащаяся в матриксе митохондрий.
Равновесие малатдегидрогеназной реакции сильно сдвинуто влево. Тем не менее, в интактных клетках эта реакция идёт слева направо, потому что продукт реакции, оксалоацетат, активно используется в цитратсинтазной реакции. В цитозоле содержится изоформа малат- дегидрогеназы, также NАD-зависимая, но не принимающая участие в цитратном цикле. Обе изоформы малатдегидрогеназы — димеры.
2. Общая характеристика и энергетическое значение цитратного цикла
Образованием оксалоацетата завершается один оборот цитратного цикла. В одном обороте цикла лимонной кислоты в 2 реакциях декарбоксилирования (превращение изоцитрата в α-кетоглутарат и α-кетоглутарата в сукцинил-КоА) происходит образование 2 молекул СO2. В 4 реакциях цитратного цикла происходит дегидрирование с образованием восстановленных коферментов: 3 молекул NАDН + Н+ и 1 молекулы FАDН2 в составе сукцинатдегидрогеназы.
Наконец, на один оборот цикла затрачивается 2 молекулы воды: одна — на стадии образования цитрата, вторая — на стадии гидратации фумарата.
Восстановленные коферменты (3 молекулы NАDН и 1 молекула FАDН2), образованные в цикле лимонной кислоты, отдают электроны в ЦПЭ на кислород — конечный акцептор электронов. Восстановленный кислород взаимодействует с протонами с образованием воды.
На каждую молекулу NАDН при образовании молекулы воды в процессе тканевого дыхания синтезируются 3 молекулы АТФ, а на каждую молекулу FАDН2 — 2 молекулы АТФ (рис. 6-25).
Рис. 6-25. Схема взаимосвязи общего пути катаболизма и ЦПЭ.

Таким образом, каждый оборот цикла лимонной кислоты сопровождается синтезом 11 молекул АТФ путём окислительного фосфорилирования. Одна молекула АТФ образуется путём субстратного фосфорилирования.
В итоге на каждый ацетильный остаток, включённый в цитратный цикл, образуется 12 молекул АТФ.
3. Регуляция общего пути катаболизма
Скорость синтеза АТФ строго соответствует энергетическим потребностям клетки. Это достигается согласованной регуляцией всех этапов заключительного пути катаболизма, включающего превращение пирувата в ацетил-КоА, цитратный цикл и ЦПЭ. В большинстве тканей, где главная функция общего пути катаболизма — обеспечение клетки энергией, важную роль в регуляции играет дыхательный контроль.
Увеличение скорости утилизации АТФ для совершения различных видов работы увеличивает концентрацию АДФ, что ускоряет окисление NADH в ЦПЭ и, следовательно, повышает скорость реакций, катализируемых NAD-зави- симыми дегидрогеназами. Окисление пирувата и ацетил-КоА может происходить только в том случае, если электроны и протоны от NADH и FADH2 поступают в ЦПЭ. Таким образом, отношения АДФ/АТФ и NADH/NAD+ — главные модуляторы скорости реакций общего пути катаболизма (ОПК).
Как известно, скорость метаболических путей, которые должны обеспечивать постоянный уровень конечных продуктов, таких, как АТФ, регулируется на уровне реакций, катализируемых регуляторными ферментами. На заключительном этапе катаболизма наиболее важные регуляторные ферменты — пируватдегидрогеназный комплекс, цитратсинтаза, изоцитратдегидрогеназа и α-кетоглутаратдегидрогеназный комплекс.
Регуляция пируватдегидрогеназного комплекса. Регуляция на уровне ПДК имеет важное значение для обеспечения цитратного цикла «топливными» молекулами ацетил-КоА.
Образование ацетил-КоА из пирувата — необратимый ключевой этап метаболизма. Животные не способны к превращению ацетил-КоА в глюкозу. Активность пируватдегидрогеназного комплекса регулируется различными способами: доступностью субстратов, ингибированием продуктами реакции, аллостерически и путём ковалентной модификации.
Ковалентная модификация ПДК осуществляется фосфорилированием и дефосфорилированием. В состав ПДК входят 2 регуляторных субъединицы. Одна из них, киназа ПДК, фосфорилирует ПДК в определённых участках по остаткам серина. При фосфорилировании ПДК инактивируется. Другая регуляторная субъединица, фосфатаза, дефосфорилирует фермент, превращая его в активную форму (рис. 6-26).
Рис. 6-26. Регуляция пируватдегидрогеназного комплекса. ПДК аллостерически активируется АДФ, NАD+, КоА, Са2+ и пируватом; ацетил-КоА, NАDН и АТФ активируют киназу и ингибируют ПДК. Фосфатаза активируется Са2+.

При повышении концентрации АДФ ПДК находится в нефосфорилированной активной форме. Этот эффект усиливается в некоторых клетках при повышении концентрации внутриклеточного Са2+, который активирует фосфатазу ПДК. Такой механизм активации ПДК особенно важен в мышцах и жировой ткани.
Продукты пируватдегидрогеназной реакции (ацетил-КоА и NАDН) аллостерически активируют киназу ПДК. Активированная киназа фосфорилирует и инактивирует ПДК. Таким образом, при накоплении NADH и ацетил-КоА тормозится превращение пирувата в ацетил- КоА. Такая ситуация создаётся, например, в печени при голодании: из жировых депо в печень поступают жирные кислоты, из которых образуется ацетил-КоА. В присутствии высокомолекулярных жирных кислот ингибирование ПДК усиливается. Пируват при этом не окисляется и может быть использован для синтеза глюкозы (см. раздел 7).
Пируват аллостерически активирует нефос- форилированную форму ПДК, действуя согласованно с другими субстратами — NAD+ и КоА. Активация ПДК происходит также под влиянием инсулина. Один из эффектов инсулина — повышение концентрации внутримитохондри- ального Са2+. При повышении концентрации Са2+ ПДК активируется (см. рис. 6-26). Этот механизм особенно важен в жировой ткани, где ацетил-КоА необходим для синтеза жирных кислот (см. раздел 8). В клетках миокарда ПДК активируется адреналином, однако это влияние адреналина не связано с изменением концентрации цАМФ.
Регуляция цитратного цикла. В большинстве случаев скорость реакций в метаболических циклах определяется их начальными реакциями. В ЦТК важнейшая регуляторная реакция — образование цитрата из оксалоацетата и ацетил- КоА, катализируемая цитратсинтазой. Эта реакция ускоряется при повышении концентрации оксалоацетата — субстрата реакции и тормозится продуктом реакции — цитратом. Когда отношение NADH/NAD+ снижается, скорость окисления малата в оксалоацетат возрастает. Повышение концентрации оксалоацетата ускоряет цитратсинтазную реакцию. Скорость реакции снижается при повышении концентрации АТФ, сукцинил-КоА и длинноцепочечных жирных кислот. Однако точный механизм влияния этих метаболитов на цитратсинтазу недостаточно ясен (рис. 6-27).
Рис. 6-27. Регуляция общего пути катаболизма. 1 — ПДК активируется пируватом, NAD+, КоА; ингибируется NADH и ацетил- КоА; 2 — цитратсинтаза (реакция ускоряется при повышении концентрации оксалоацетата и замедляется при повышении концентрации цитрата, NADH, АТФ и сукцинил-КоА); 3 — изоцитратдегидрогеназа аллостерически активируется АДФ, ионами кальция, ингибируется NADH; 4 — α-кетоглутаратдегидрогеназный комплекс ингибируется NADH, АТФ и сукцинил-КоА, а активируется ионами кальция.

Изоцитратдегидрогеназа, олигомерный фермент, состоит из 8 субъединиц. Присоединение изоцитрата к первой субъединице вызывает кооперативное изменение конформации других, увеличивая скорость присоединения субстрата. Фермент аллостерически активируется АДФ и Са2+, которые присоединяются к ферменту в разных аллостерических центрах. В присутствии АДФ конформация всех субъединиц меняется таким образом, что связывание изоцитрата происходит значительно быстрее. Таким образом, при концентрации изоцитрата, которая существует в митохондриальном матриксе, небольшие изменения концентрации АДФ могут вызвать значительное изменение скорости реакции. Увеличение активности изоцитратдегидрогеназы снижает концентрацию цитрата, что, в свою очередь, уменьшает ингибирование цитратсинтазы продуктом реакции. При повышении концентрации NADH активность фермента снижается.
α- Кетоглутаратдегидрогеназный комплекс, имеющий сходное строение с пируватдегидрогеназным, в отличие от последнего, не имеет в своём составе регуляторных субъединиц. Главный механизм регуляции α-кетоглутаратдегидрогеназного комплекса — ингибирование реакции NADH и сукцинил-КоА.
α-Кетоглутаратдегидрогеназный комплекс, как и изоцитратдегидрогеназа, активируется Са2+, а при повышении концентрации АТФ скорости обеих реакций снижаются.
В регуляции цитратного цикла существует множество дополнительных механизмов, обеспечивающих необходимый уровень метаболитов и их участие в других метаболических путях.
Компартментализация ферментов, участвующих в реакциях окислительного декарбоксилирования пирувата и цикла лимонной кислоты, играет важную роль в регуляции этих процессов.
Внутренняя мембрана митохондрий непроницаема для анионов и катионов, в том числе и для промежуточных продуктов цитратного цикла, которые могут быть перенесены через мембрану только при участии специальных белков. Поэтому ферменты цитратного цикла имеют больше возможностей для взаимодействия с продуктами предыдущих реакций, чем в случае свободного удаления этих продуктов из митохондрий.
Доступность субстратов возрастает также в результате образования ферментных комплексов. Малатдегидрогеназа и цитратсинтаза образуют непрочные комплексы, в которых цитратсинтаза может использовать оксалоацетат, непосредственно образующийся малатдегидрогеназой.
В ПДК и α-кетоглутаратдегидрогеназном комплексе субстраты непосредственно передаются от одного фермента к другому: только трансацил аза может взаимодействовать с промежуточным продуктом, связанным с ТДФ, а дигидро-липоилдегидрогеназа — с дигидролипоевой кислотой.
NAD+, NADH, КоА, ацетил-КоА и сукцинил- КоА не имеют транспортных белков в мембране митохондрий. Поэтому эти соединения не могут пройти через митохондриальную мембрану.
Накопление ацил-КоА производных, таких как ацетил-КоА или сукцинил-КоА, в митохондриальном матриксе ингибирует другие реакции, для которых необходим КоА.
Тесная связь нитратного цикла и ЦПЭ поддерживается благодаря использованию в этих реакциях общего фонда NAD+ и NАDН.
В. Анаболические функции нитратного цикла
Цикл лимонной кислоты — один из амфиболических путей метаболизма. В нём осуществляются не только окислительные превращения энергетических субстратов до конечных продуктов СO2 и Н2O, но и происходит образование субстратов для других метаболических путей (рис. 6-28).
Рис. 6-28. Использование метаболитов ЦТК в синтезе различных соединений. Синтез заменимых аминокислот (1, 2, 3), глюкозы (4, 5, 6), жирных кислот (7), гема (8).
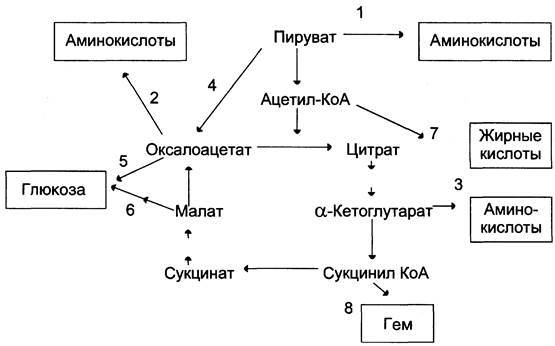
Некоторые промежуточные продукты цикла лимонной кислоты: α-кетоглутарат, сукцинат, оксалоацетат могут использоваться для синтеза заменимых аминокислот (см. раздел 9).
Убыль промежуточных продуктов цикла восполняется в реакциях, катализируемых специфическими ферментами. В нормальных условиях реакции, отвлекающие промежуточные продукты из цикла и восполняющие их убыль, находятся в состоянии динамического равновесия, так что концентрация этих продуктов в митохондриях остаётся постоянной.
Реакции, обеспечивающие пополнение фонда промежуточных продуктов ЦТК, называются анаплеротическими (пополняющими). Важнейшая из них — реакция синтеза оксалоацетата из пирувата. Эту реакцию катализирует митохондриальный фермент — пируваткарбоксилаза.

Пируваткарбоксилаза — сложный олигомерный фермент. Молекула фермента содержит 4 простетические группы, представленные биотином (см. раздел 3), который ковалентно связан амидной связью с ε-аминогруппами остатков лизина, находящегося в активном центре фермента (рис. 6-29).
Рис. 6-29. Простетическая группа пируват карбоксилазы. Карбоксильная группа биотина образует амидную связь с ε-аминогруппой лизина в активном центре фермента. СO2активируется, образуя N-карбоксипроизводное биотина.

Если для цикла лимонной кислоты не хватает оксалоацетата или какого-нибудь другого промежуточного продукта, то карбоксилирование пирувата ускоряется. В этой реакции в качестве источника энергии используется АТФ.
Реакция протекает в 2 стадии. На первой стадии происходит активация СO2 путём присоединения к одному из атомов азота в молекуле биотина. Эта реакция сопряжена с гидролизом АТФ.
АТФ + СO2+ Е-биотин + Н2O —> АДФ + Н3РO4 + Е-биотин-СОО- + 2 Н+.
На второй стадии активированная карбоксильная группа переносится на пируват.
Е-биотин-СОО- + Пируват —> Е-биотин + Оксалоацетат.
Пируваткарбоксилаза — регуляторный фермент. Если концентрация ацетил-КоА увеличивается, то он действует как аллостерический активатор пируваткарбоксилазы, ускоряя образование оксалоацетата. Таким образом, избыток ацетил-КоА способствует активации нитратного цикла.
Метаболиты цитратного цикла используются не только как субстраты синтеза углеродного
скелета ряда соединений, но и являются донорами водорода для образования восстановленных коферментов, участвующих в реакциях синтеза жирных кислот, стероидов и других веществ (см. разделы 8, 10, 11). Два метаболита цитратного цикла могут дегидрироваться при участии NADP-зaвиcимыx дегидрогеназ: малата и изоцитрата. Например, манат может поступать из митохондрий в цитозоль клетки. В цитозоле находится NАDР-зависимая дегидрогеназа (малик- фермент), катализирующая реакцию:
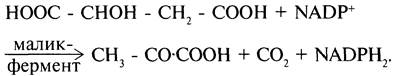
Манат и изоцитрат обеспечивают образование около половины общего фонда NАDРН, используемого в восстановительных синтезах; вторая половина образуется в пентозофосфатном пути превращения глюкозы (см. раздел 7).
Г. Гипоэнергетические состояния
Все живые клетки постоянно нуждаются в АТФ для осуществления различных видов жизнедеятельности.
Клетки мозга потребляют большое количество АТФ для синтеза нейро медиаторов, регенерации нервных клеток, поддержания необходимого градиента Na+ и К+, для проведения нервного импульса; почки используют АТФ в процессе реабсорбции различных веществ при образовании мочи; в печени происходит синтез гликогена, жиров, белков и многих других соединений; в миокарде постоянно совершается механическая работа, необходимая для циркуляции крови; скелетные мышцы в покое потребляют незначительные количества АТФ, но при физической нагрузке эти потребности возрастают в десятки раз (табл. 6-6).
Таблица 6-6. Скорость потребления О2 и АТФ в некоторых тканях
Ткань |
Потребление О2, мкмоль/г ткани/мин |
Потребление АТФ, мкмоль/г ткани/мин |
Мозг |
1,7 |
10,2 |
Сердце |
4,5 |
27,0 |
Почки |
7,1 |
42,6 |
Печень |
1,6 |
9,6 |
Мышцы (в покое) |
0,08 |
0,5 |
Вместе с тем запасов АТФ в клетках практически не существует. Так, в условиях прекращения синтеза АТФ в миокарде его запасы истощаются за несколько секунд.
Как мы уже знаем, для постоянного синтеза АТФ клеткам необходим приток метаболитов как субстратов дыхания и кислорода как конечного акцептора электронов в реакциях окисления, сопряжённых с синтезом АТФ.
Нарушения какого-либо этапа метаболизма, приводящие к прекращению синтеза АТФ, гибельны для клетки.
Состояния, при которых синтез АТФ снижен, объединяют термином «гипоэнергетические». Причинами гипоэнергетических состояний могут быть голодание, гиповитаминозы В1, РР, В2; гипоксия.
Гипоксия может возникнуть: при недостатке кислорода во вдыхаемом воздухе; при заболеваниях лёгких и нарушении лёгочной вентиляции; при нарушениях кровообращения, вызванных заболеваниями сердца, спазмом и тромбозом сосудов, кровопотерей. Причинами гипоксии могут быть также наследственные или приобрётенные нарушения структуры гемоглобина (см. разделы 1,4). Частой причиной гипоэнергетических состояний могут быть нарушения процессов использования кислорода в клетках.
Причинами этих нарушений могут быть:
✵ действие ингибиторов и разобщителей в ЦПЭ;
✵ железодефицитные анемии;
✵ снижение уровня гемоглобина и других железосодержащих белков (цитохромов, FeS- белков), в результате чего нарушаются перенос электронов и синтез АТФ;
✵ наследственные дефекты ферментов ЦПЭ и нитратного цикла.
Примерно 13 из 100 белков, участвующих в окислительном фосфорилировании, кодируются митохондриальной ДНК: 7 субъединиц комплекса I, субъединица комплекса III, 3 субъединицы комплекса IV и 2 субъединицы комплекса V, а также необходимые компоненты их трансляции. Остальные митохондриальные белки синтезируются в ядре.
Ядерная ДНК кодирует более 70 субъединиц белков, участвующих в окислительном фосфорилировании. Нарушения окислительного фосфорилирования в основном связаны с мутациями в митохондриальной ДНК, которые случаются примерно в 10 раз чаще, чем в ядерной. Ткани с высокой потребностью в АТФ (ЦНС, скелетные
мышцы, миокард, почки и печень) наиболее чувствительны к нарушениям окислительного фосфорилирования.
Дефекты митохондриальной ДНК наследуются по материнской линии, так как митохондрии из клеток сперматозоидов не проникают в оплодотворённую яйцеклетку. Мутации митохондриальной ДНК — частая причина, так как митохондрии не имеют такой же эффективной системы репарации Д НК, как ядро (см. раздел 4). Даже у здоровых индивидуумов соматические мутации снижают с возрастом возможности окислительного фосфорилирования. В этих случаях способность к синтезу АТФ ниже тканеспецифического уровня нормальных клеток.