БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 7. ОБМЕН УГЛЕВОДОВ
XII. Пентозофосфатный путь превращения глюкозы
Пентозофосфатный путь, называемый также гексомонофосфатным шунтом, служит альтернативным путём окисления глюкозо-6-фосфата. Пентозофосфатный путь состоит из 2 фаз (частей) — окислительной и неокислительной.
В окислительной фазе глюкозо-6-фосфат необратимо окисляется в пентозу — рибулозо-5- фосфат, и образуется восстановленный NADРН.
В неокислительной фазе рибулозо-5-фосфат обратимо превращается в рибозо-5-фосфат и метаболиты гликолиза.
Пентозофосфатный путь обеспечивает клетки рибозой для синтеза пуриновых и пиримидиновых нуклеотидов и гидрированным коферментом NАDРН, который используется в восстановительных процессах.
Суммарное уравнение пентозофосфатного пути выражается следующим образом:
3 Глюкозо-6-фосфат + 6 NАDР+ —> 3 СO2 + 6 NADРН + Н+) + 2 Фруктозо-6-фосфат + Глицеральдегид-3-фосфат.
Ферменты пентозофосфатного пути, так же, как и ферменты гликолиза, локализованы в цитозоле.
Наиболее активно пентозофосфатный путь протекает в жировой ткани, печени, коре надпочечников, эритроцитах, молочной железе в период лактации, семенниках.
А. Окислительный этап
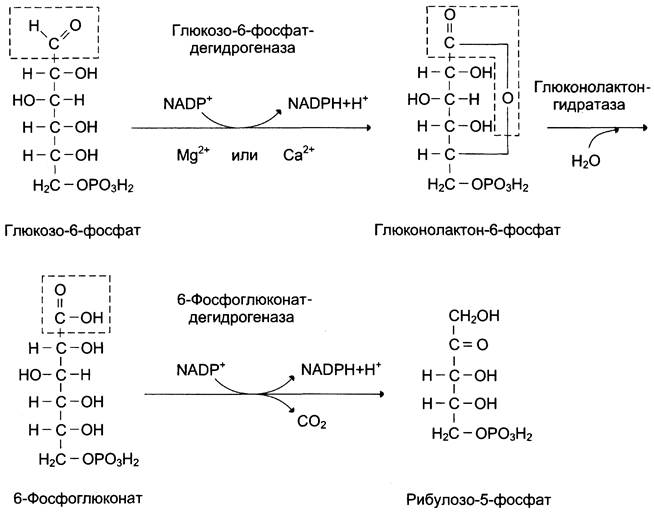
В окислительной части пентозофосфатного пути глюкозо-6-фосфат подвергается окислительному декарбоксилированию, в результате которого образуются пентозы. Этот этап включает 2 реакции дегидрирования.
Первая реакция дегидрирования — превращение глюкозо-6-фосфата в глюконолактон-6- фосфат — катализируется NADP+-зaвиcимoй глюкозо-6-фосфатдегидрогеназой и сопровождается окислением альдегидной группы у первого атома углерода и образованием одной молекулы восстановленного кофермента NАDРH.
Далее глюконолактон-6-фосфат быстро превращается в 6-фосфоглюконат при участии фермента глюконолактонгидратазы.
Фермент 6-фосфоглюконатдегидрогеназа катализирует вторую реакцию дегидрирования окислительной части, в ходе которой происходит также и декарбоксилирование. При этом углеродная цепь укорачивается на один атом углерода, образуется рибулозо-5-фосфат и вторая молекула гидрированного NАDРН (рис. 7-62).
Рис. 7-62. Окислительный этап пентозофосфатного пути.
Восстановленный NАDРН ингибирует первый фермент окислительного этапа пентозофосфатного пути — глюкозо-6-фосфатдегидрогеназу. Превращение NАDРН в окисленное состояние NАDР+ приводит к ослаблению ингибирования фермента. При этом скорость соответствующей реакции возрастает, и образуется большее количество NАDРН.
Суммарное уравнение окислительного этапа пентозофосфатного пути можно представить в виде:
Глюкозо-6-фосфат + 2 NАDР+ + Н2O —> Рибулозо-5-фосфат + 2 (NАDРН + Н+) + СO2.
Реакции окислительного этапа служат основным источником NАDРН в клетках. Гидрированные коферменты снабжают водородом биосинтетические процессы, окислительно-восстановительные реакции, включающие защиту клеток от активных форм кислорода. NАDРН как донор водорода участвует в анаболических процессах, например, в синтезе холестерина. Это источник восстановительных эквивалентов для цитохрома Р450, катализирующего образование гидроксильных групп при синтезе стероидных гормонов, жёлчных кислот, при катаболизме лекарственных веществ и других чужеродных соединений (см. разделы 8, 11, 12). Высокая активность фермента глюкозо-6- фосфатдегидрогеназы обнаружена в фагоцитирующих лейкоцитах, где NАDРН-оксидаза использует восстановленный NАDРН для образования супероксидного иона из молекулярного кислорода. Супероксидный ион генерирует другие активные формы кислорода, под действием которых и повреждаются молекулы ДНК, белков, липидов бактериальных клеток. Синтез жирных кислот из углеводов в печени является основным путём утилизации NADPH и обеспечивает регенерацию окисленной формы NADP+. В печени глюкозо-6- фосфатдегидрогеназа, как и ключевые ферменты гликолиза и биосинтеза жирных кислот, индуцируется при увеличении соотношения инсулин/глюкагон после приёма богатой углеводами пищи.
Несмотря на то, что NАDРН образуется также при окислении малата до пирувата и диоксида углерода (при участии NАDР+-зависимой малатдегидрогеназы) и дегидрировании изо- цитрата (при участии NADP+-зaвиcимoй изо- цитратдегидрогеназы), в большинстве случаев потребности клеток в восстановительных эквивалентах удовлетворяются за счёт пентозофосфатного пути.
Реакции окислительного пути протекают только в том случае, если восстановленный кофермент NАDРН возвращается в исходное окисленное состояние NАDР+ при участии NADPH-зaвиcимыx дегидрогеназ (т. е. при условии использования гидрированного NАDРН в восстановительных процессах). Если потребности клетки в NADPH незначительны, рибозо-5-фосфат образуется в результате обратимых реакций неокислительного этапа пентозофосфатного пути, используя в качестве исходных веществ метаболиты гликолиза — глицеральдегид-3-фосфат и фруктозо-6-фосфат.
Б. Неокислительный этап
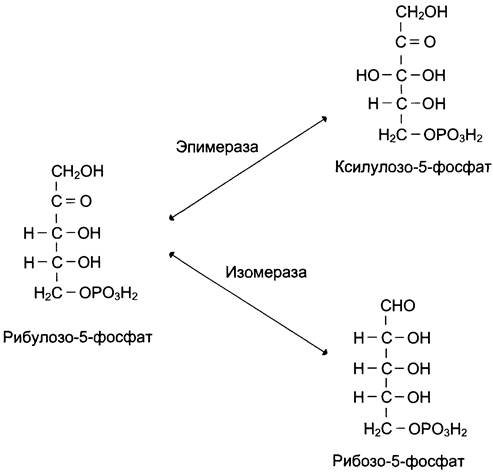
Неокислительный этап пентозофосфатного пути включает серию обратимых реакций, в результате которых рибулозо-5-фосфат превращается в рибозо-5-фосфат и ксилулозо-5-фосфат, и далее за счёт переноса углеродных фрагментов в метаболиты гликолиза — фруктозо-6-фосфат и глицеральдегид-3-фосфат. В этих превращениях принимают участие ферменты: эпимераза, изомераза, транскетолаза и трансальдолаза. Транскетолаза в качестве кофермента использует тиаминдифосфат. Неокислительный этап пентозофосфатного пути не включает реакции дегидрирования и поэтому используется только для синтеза пентоз.
Рибулозо-5-фосфат служит субстратом для двух ферментов. Фермент рибулозо-5-фосфат-3-эпимераза изменяет стехиометрическое положение одной ОН-группы у третьего атома углерода, превращая рибулозо-5-фосфат в ксилулозо-5-фосфат. Другой фермент — рибулозо-5-фосфат-изомераза — катализирует превращение рибулозо-5-фосфата в рибозо-5-фосфат (рис. 7-63). Рибозо-5- фосфат, образующийся в неокислительной фазе, обеспечивает клетки рибозой, необходимой для синтеза нуклеотидов, которые служат предшественниками и структурными компонентами коферментов дегидрогеназ и нуклеиновых кислот.
Рис. 7-63. Превращения рибулозо-5-фосфата.
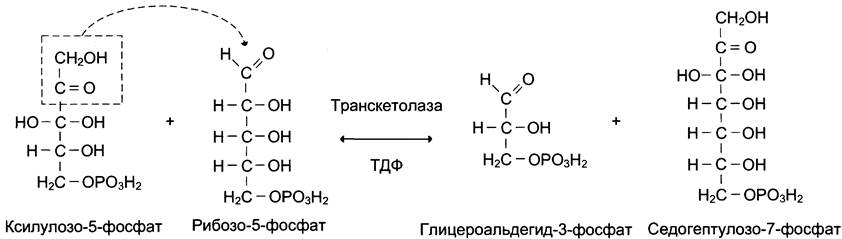
Ферменты транскетолаза и трансальдолаза катализируют перенос двух- и трёхуглеродных фрагментов, соответственно используя в качестве донора углеродных фрагментов кетозу, а альдозу — в качестве акцептора. Эти реакции протекают в 2 этапа: сначала происходит отщепление углеродного фрагмента от молекулы-донора, а затем — перенос этого фрагмента на молекулу, выполняющую роль акцептора. Транскетолаза в неокислительной фазе пентозофосфатного пути катализирует 2 реакции. В первой реакции (рис. 7-64) транскетолаза расщепляет связь С-С между кетогруппой и соседним атомом углерода в молекуле ксилулозо-5-фосфат, в результате чего кетосахар превращается в альдозу, глицеральде- гид-3-фосфат, содержащую на 2 атома углерода меньше. Образующийся после расщепления двухуглеродный фрагмент остаётся ковалентно связанным в каталитическом центре фермента с коферментом тиаминдифосфатом. Далее фермент переносит двухуглеродный фрагмент на альдегидную группу альдосахара, образую новую кетозу — седогептулозо-7-фосфат.
Рис. 7-64. Реакция переноса двухуглеродного фрагмента, катализируемая транскетолазой.
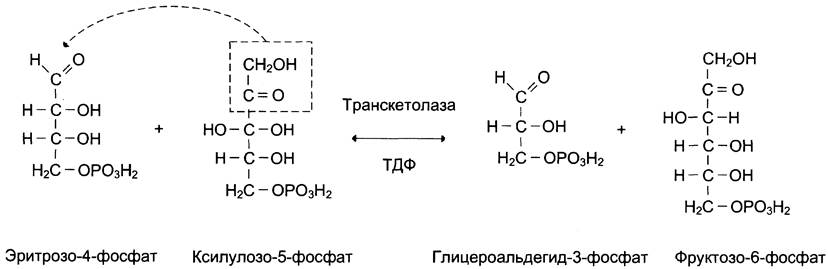
Трансальдолаза переносит трёхуглеродный фрагмент от седогептулозо-7-фосфата на глицеральдегид-3-фосфат, образуя эритрозо-4-фосфат и фруктозо-6-фосфат (рис. 7-65).
Рис. 7-65. Реакция, катализируемая трансальдолазой.

Эта реакция подобна реакции альдольного расщепления гликолитического пути, за исключением того, что в данном случае трёхуглеродный фрагмент, содержащий кетогруппу, переносится на альдосахар глицеральдегид-3-фосфат, а в гликолитическом пути кетофрагмент высвобождается в виде дигидроксиацетонфосфата.
В следующей реакции, катализируемой транс- кетолазой, происходит перенос двухуглеродного фрагмента от ксилулозо-5-фосфата на эритрозо-4-фосфат. Продуктами этой реакции являются фруктозо-6-фосфат и глицеральдегид- 3-фосфат (рис. 7-66).
Рис. 7-66. Реакция, катализируемая транскетолазой.
Так как все реакции неокислительного этапа обратимы, образование рибозо-5-фосфата может происходить не только в результате изомерного превращения продукта окислительной фазы пентозофосфатного пути рибулозо-5-фосфата в рибозо-5-фосфат под действием изомеразы, но также и из промежуточных продуктов гликолиза — фруктозо-6-фосфата и глицеральдегид-3-фосфата. Последовательность превращений, приводящих к образованию рибозо-5- фосфата из таких продуктов гликолитического пути, можно представить в виде:
2 Фруктозо-6-фосфат + Глицералъдегид-3-фосфат —> 2 Ксилулозо-5-фосфат + Рибозо-5-фосфат
2 Ксилулозо-5-фосфат —> 2 Рибулозо-5-фосфат
2 Рибулозо-5-фосфат —> 2 Рибозо-5-фосфат.
Суммарный результат метаболизма 3 молекул рибулозо-5-фосфата в неокислительной фазе пентозофосфатного пути — образование 2 молекул фруктозо-6-фосфата и 1 молекулы глице- ральдегид-3-фосфата. Далее фруктозо-6-фосфат и глицеральдегид-3-фосфат могут превратиться в глюкозу. С учётом стехиометрического коэффициента, равного 2, для образования 5 молекул глюкозы (содержащих 30 атомов углерода) потребуются 4 молекулы фруктозо-6-фосфата и 2 молекулы глицеральдегид-3-фосфата (в сумме содержащие также 30 атомов углерода) или, соответственно, 6 молекул рибулозо-5-фосфата. Таким образом, неокислительный путь можно представить, как процесс возвращения пентоз в фонд гексоз.
В. Пентозофосфатный цикл
Окислительный этап образования пентоз и неокислительный этап (путь возвращения пентоз в гексозы) составляют вместе циклический процесс.
Такой процесс можно описать общим уравнением:
6 Глюкозо-6-фосфат + 12 NADР+ + 2 Н2O —> 5 Глюкозо-6-фосфат + 12 NАDРН +12 Н+ + 6 СO2.
Это означает, что из 6 молекул глюкозы образуются 6 молекул рибулозо-5-фосфат (пентозы) и 6 молекул СO2. Ферменты неокислительной фазы превращают 6 молекул рибулозо-5-фосфат в 5 молекул глюкозы (гексозы). При последовательном проведении этих реакций единственным полезным продуктом является NАDРН, образующийся в окислительной фазе пентозофосфатного пути. Такой процесс называют пентозофосфатным циклом (рис. 7-67).
Рис. 7-67. Пентозофосфатный цикл в жировой ткани.
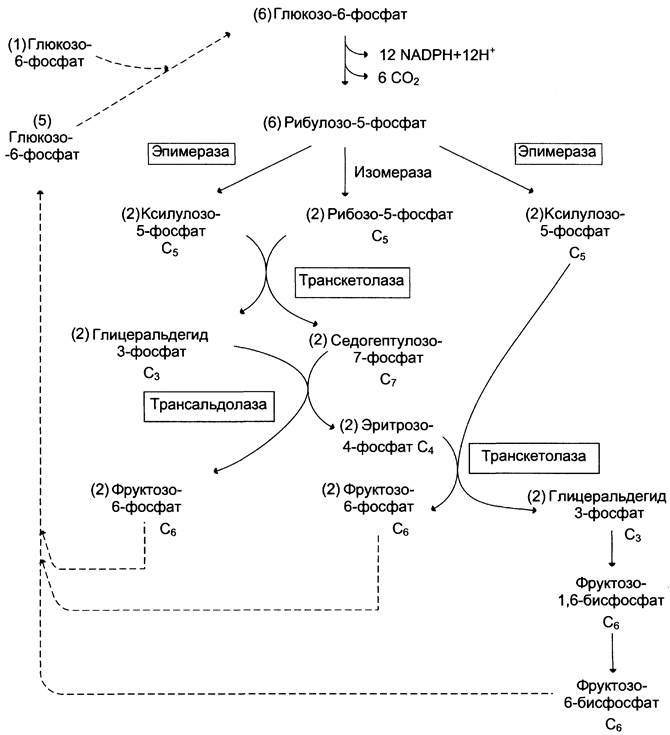
Протекание пентозофосфатного цикла позволяет клеткам продуцировать NАDРН, необходимый для синтеза жиров, не накапливая пентозы.
Энергия, выделяющаяся при распаде глюкозы, трансформируется в энергию высокоэнергетического донора водорода — NАDРН. Гидрированный NАDРН служит источником водорода для восстановительных синтезов, а энергия NADPH преобразуется и сохраняется во вновь синтезированных веществах, например, жирных кислотах, высвобождается при их катаболизме и используется клетками.
Г. Дефект глюкозо-6-фосфат дегидрогеназы в эритроцитах
Неферментативное окисление гемоглобина (Fе2+) в метгемоглобин (Fе3+) приводит к одноэлектронному восстановлению кислорода и появлению реакционноспособного анион-радикала — супероксида O2-, который служит предшественником других активных форм кислорода: пероксида водорода Н2O2 и гидроксильного радикала ОН-. Активные формы кислорода являются сильнейшими окислителями и поэтому способны вызывать серьёзные повреждения молекул ДНК, белков, ненасыщенных липидов.
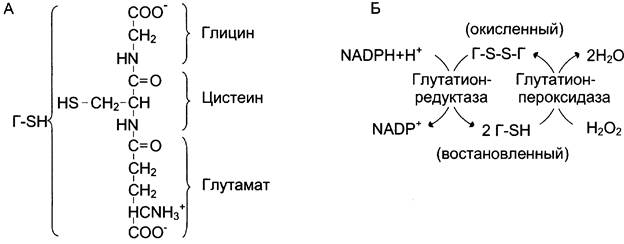
В эритроцитах, как и в большинстве клеток, присутствует тиолсодержащий трипептид — глутатион (y-глутамил-цистенил-глицин). Восстановленная форма глутатиона (Г-SН) содержит SН-группу (рис. 7-68), которая может служить донором электронов в реакциях восстановления. Под действием фермента глутатионпероксидазы восстановленный глутатион превращает молекулу пероксида водорода в молекулу воды, а сам переходит в окисленное состояние (Г-SS-Г). Регенерацию восстановленного глутатиона обеспечивает глутатионредуктаза, используя в качестве донора водорода гидрированный NАDРН. Для эритроцитов единственным источником получения NADРН служит пентозофосфатный путь, для других тканей существует альтернативный способ — при участии NАDН-зависимой малатдегидрогеназы (малик-фермент).
Рис. 7-68. Восстановление глутатиона под действием глутатионредуктазы. А — строение глутатиона; Б — восстановление глутатиона.
Взаимодействие восстановленного глутатиона: пероксидом водорода в эритроцитах предохраняет цистеиновые остатки в протомерах гемоглобина от окисления. При генетическом дефекте глюкозо-6-фосфатдегидрогеназы концентрация восстановленного кофермента NАDРН уменьшается, в результате чего резко снижается концентрация восстановленного глутатиона, а в клетке, соответственно, увеличивается количество активных форм кислорода. В этом случае окисление SН-групп молекул гемоглобина в эритроцитах приводит к образованию перекрёстных дисульфидных связей и агрегации протомеров гемоглобина с формированием телец Хайнца (см. раздел 14). В присутствии телец Хайнца пластичность мембраны нарушается, и она теряет способность к деформации при прохождении эритроцитов через капилляры. Это вызывает нарушение целостности мембраны, что приводит к гемолизу эритроцитов. Некоторые лекарственные вещества, например, антималярийный препарат примахин, сульфаниламиды, также снижают способность эритроцитов бороться с активными формами кислорода.