БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 9. ОБМЕН И ФУНКЦИИ АМИНОКИСЛОТ
IV. Катаболизм аминокислот
Аминокислоты, образующиеся при переваривании белков и поступающие в клетки тканей, подвергаются катаболизму и анаболизму, а также специфическим реакциям, в результате которых синтезируются биологически активные соединения.
Катаболизм большинства аминокислот начинается с отщепления α-аминогруппы. Аминокислота теряет аминогруппу в результате двух типов реакций: трансаминирования и дезаминирования.
А. Трансаминирование
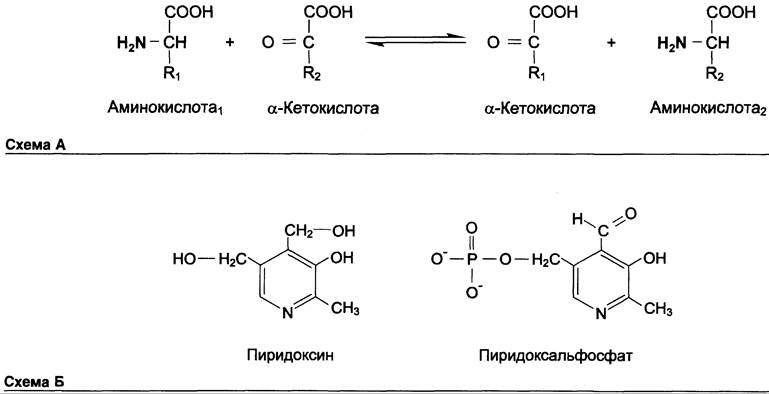
Трансаминирование — реакция переноса α-аминогруппы с аминокислоты на α-кетокислоту, в результате чего образуются новая кетокислота и новая аминокислота. Константа равновесия для большинства таких реакций близка к единице (Кр ~ 1,0), поэтому процесс трансаминирования легко обратим (см. схему А).
Реакции катализируют ферменты аминотрансферазы, коферментом которых служит пиридоксальфосфат (ПФ) — производное витамина В6 (пиридоксина, см. раздел 3) (см. схему Б).
Аминотрансферазы обнаружены как в цитоплазме, так и в митохондриях клеток эукариот. Причём митохондриальные и цитоплазматические формы ферментов различаются по физикохимическим свойствам. В клетках человека найдено более 10 аминотрансфераз, отличающихся по субстратной специфичности. Вступать в реакции трансаминирования могут почти все аминокислоты, за исключением лизина, треонина и пролина.
1. Механизм реакции
Аминотрансферазы — классический пример ферментов, катализирующих реакции, протекающие по механизму типа «пинг-понг» (см. раздел 2). В таких реакциях первый продукт должен уйти из активного центра фермента до того, как второй субстрат сможет к нему присоединиться.
Активная форма аминотрансфераз образуется в результате присоединения пиридоксальфосфата к аминогруппе лизина прочной альдиминной связью (рис. 9-6). Лизин в положении 258 входит в состав активного центра фермента. Кроме того, между ферментом и пиридоксальфосфатом образуются ионные связи с участием заряженных атомов фосфатного остатка и азота в пиридиновом кольце кофермента.
Рис. 9-6. Присоединение пиридоксальфосфата к активному центру аминотрансферазы. Цифрой «1» обозначена альдиминная связь.

Пиридоксальфосфат в данном случае служит переносчиком аминогрупп. При этом наиболее важную роль играет его альдегидная группа, которая может обратимо присоединять различные амины с образованием шиффовых оснований. Реакции трансаминирования проходят в 2 стадии, во время которых пиридоксальфосфат претерпевает обратимые превращения между свободной альдегидной формой (ПФ) и аминированной формой (пиридоксаминфосфат). Последовательность реакций трансаминирования представлена ниже.
✵ На первой стадии к пиридоксальфосфату в активном центре фермента с помощью альдиминной связи присоединяется аминогруппа от первого субстрата — аминокислоты. Образуются комплекс фермент-пиридоксаминфосфат и кетокислота — первый продукт реакции. Этот процесс включает промежуточное образование 2 шиффовых оснований.
✵ На второй стадии комплекс фермент-пиридоксаминфосфат соединяется с кетокислотой (вторым субстратом) и снова через промежуточное образование 2 шиффовых оснований передаёт аминогруппу на кетокислоту. В результате фермент возвращается в свою нативную форму, и образуется новая аминокислота — второй продукт реакции. Если альдегидная группа пиридоксальфосфата не занята аминогруппой субстрата, то она образует шиффово основание (альдимин) с ε-аминогруппой радикала лизина в активном центре фермента (см. схему).

2. Органоспецифичные аминотрансферазы АЛТ и АСТ
Чаще всего в реакциях трансаминирования участвуют аминокислоты, содержание которых в тканях значительно выше остальных — глутамат, аланин, аспартат и соответствующие им кетокислоты — α-кетоглутарат, пируват и оксалоацетат. Основным донором аминогруппы служит глутамат.
Суммарно эти реакции можно представить в виде схемы:
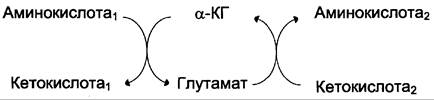
Акцептором аминогруппы любой аминокислоты, подвергающейся трансаминированию (аминокислота 1), служит α-кетоглутарат. Принимая аминогруппу, он превращается в глутамат, который способен передавать эту группу любой α-кетокислоте с образованием другой аминокислоты (аминокислота 2).
Аминотрансферазы обладают субстратной специфичностью к разным аминокислотам. В тканях человека обнаружено более 10 разных аминотрансфераз. Наиболее распространёнными ферментами в большинстве тканей млекопитающих являются аланинаминотрансфераза (АЛТ), по обратной реакции — глутамат-пируватами- нотрансфераза (ГПТ) и аспартатаминотрансфераза (ACT), по обратной реакции — глутамат- оксалоацетатаминотрансфераза (ГОТ).
АЛТ (АлАТ) катализирует реакцию транса- минирования между аланином и α-кетоглутаратом (см. схему А).
Локализован этот фермент в цитозоле клеток многих органов, но наибольшее его количество обнаружено в клетках печени и сердечной мышцы.
ACT (АсАТ) катализирует реакцию трансаминирования между аспартатом и α-кетоглутаратом аналогично предыдущей (см. схему Б).
Схема А, Б
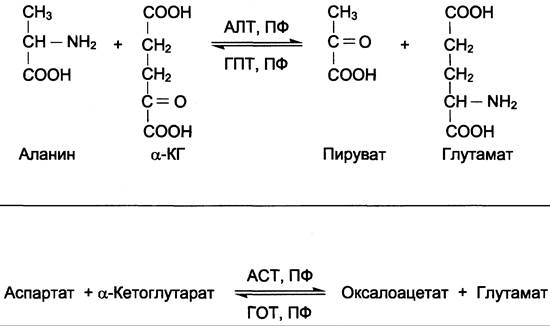
В результате образуются оксалоацетат и глутамат. ACT имеет как цитоплазматическую, так и митохондриальную формы. Наибольшее его количество обнаружено в клетках сердечной мышцы и печени.
Так как наибольшее количество АЛТ и ACT сосредоточено в печени и миокарде, а содержание в крови очень низкое, можно говорить об органоспецифичности этих ферментов.
В результате работы аминотрансфераз аминный азот многих аминокислот переходит в состав глутамата. Есть основания считать, что накопление аминогрупп в форме глутаминовой кислоты происходит в цитозоле. Затем глутамат с помощью транслоказ попадает в митохондрии, где активна специфическая ACT. В результате действия этого фермента глутамат снова превращается в α-кетоглутарат. Последний используется для непрямого дезаминирования аминокислот, содержащихся в митохондриях. Это очень важно, так, как только глутамат в тканях млекопитающих наиболее быстро может подвергаться окислительному дезаминированию (см. ниже).
3. Биологическое значение трансаминирования
Реакции трансаминирования играют большую роль в обмене аминокислот. Поскольку этот процесс обратим, ферменты аминотрансферазы функционируют как в процессах катаболизма, так и биосинтеза аминокислот. Трансаминирование — заключительный этап синтеза заменимых аминокислот из соответствующих α-кетокислот, если они в данный момент необходимы клеткам. В результате происходит перераспределение аминного азота в тканях организма. Трансаминирование — первая стадия дезаминирования большинства аминокислот, т. е. начальный этап их катаболизма. Образующиеся при этом кетокислоты окисляются в ЦТК или используются для синтеза глюкозы и кетоновых тел. При трансаминировании общее количество аминокислот в клетке не меняется.
4. Диагностическое значение определения аминотрансфераз в клинической практике
В клинической практике широко используют определение активности ACT и АЛТ в сыворотке крови для диагностики некоторых заболеваний.
В норме в крови активность этих ферментов очень мала и составляет 5 — 40 Е/л. При повреждении клеток соответствующего органа ферменты выходят в кровь, где активность их резко повышается. Поскольку ACT и АЛТ наиболее активны в клетках печени, сердца и, в меньшей степени, скелетных мышц, их используют для диагностики болезней этих органов (см. раздел 2). В клетках сердечной мышцы количество ACT значительно превышает количество АЛТ, а в печени — наоборот. Поэтому особенно информативно одновременное измерение активности обоих ферментов в сыворотке крови. Соотношение активностей АСТ/АЛТ называют «коэффициент де Ритиса». В норме этот коэффициент равен 1,33 ± 0,42. При инфаркте миокарда активность ACT в крови увеличивается в 8 — 10 раз, а АЛТ — в 1,5 — 2,0 раза. Наиболее резко активность ACTувеличивается при некрозе ткани, так как выходит в кровь и цитоплазматическая и митохондриальная формы фермента. При инфаркте миокарда значение коэффициента де Ритиса резко возрастает.
При гепатитах активность АЛТ в сыворотке крови увеличивается в ≈8 — 10 раз по сравнению с нормой, a ACT — в 2-4 раза. Коэффициент де Ритиса снижается до 0,6. Однако при циррозе печени этот коэффициент увеличивается, что свидетельствует о некрозе клеток, при котором в кровь выходят обе формы ACT.
Б. Дезаминирование аминокислот
Дезаминирование аминокислот — реакция отщепления α-аминогруппы от аминокислоты, в результате чего образуется соответствующая α-кетокислота (безазотистый остаток) и выделяется молекула аммиака. Дальнейшие превращения продуктов дезаминирования аминокислот представлены на рис. 9-7.
Рис. 9-7. Судьба продуктов дезаминирования аминокислот.
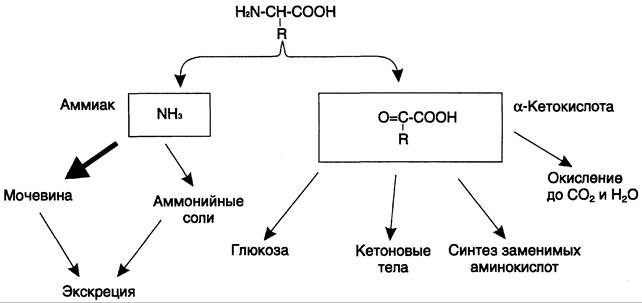
Аммиак токсичен для ЦНС, поэтому в организме человека и млекопитающих он превращается в нетоксичное хорошо растворимое соединение — мочевину. В виде мочевины, а также в виде солей аммония аммиак выводится из организма. Безазотистый остаток используется для образования аминокислот в реакциях трансаминирования, в процессах глюконеогенеза, кетогенеза, в анаплеротических реакциях для восполнения убыли метаболитов ОПК, в реакциях окисления до СO2 и Н2O.
Существует несколько способов дезаминирования аминокислот:
✵ окислительное;
✵ непрямое (трансдезаминирование);
✵ неокислительное;
✵ внутримолекулярное.
1. Окислительное дезаминирование
Наиболее активно в тканях происходит дезаминирование глутаминовой кислоты. Реакцию катализирует фермент глутаматдегидрогеназа, коферментом глутаматдегидрогеназы является NАD+. Реакция идёт в 2 этапа. Вначале происходит ферментативное дегидрирование глутамата и образование α-иминоглутарата, затем — неферментативное гидролитическое отщепление иминогруппы в виде аммиака, в результате чего образуется α-кетоглутарат (см. схему ниже).

Окислительное дезаминирование глутамата — обратимая реакция и при повышении концентрации аммиака в клетке может протекать в обратном направлении, как восстановительное аминирование α-кетоглутарата.
Глутаматдегидрогеназа очень активна в митохондриях клеток практически всех органов, кроме мышц. Этот фермент — олигомер, состоящий из 6 субъединиц (молекулярная масса 312 кД). Глутаматдегидрогеназа играет важную роль, так как является регуляторным ферментом аминокислотного обмена. Аллостерические ингибиторы глутаматдегидрогеназы (АТФ, ГТФ, NADH) вызывают диссоциацию фермента и потерю глутаматдегидрогеназной активности. Высокие концентрации АДФ активируют фермент. Таким образом, низкий энергетический уровень в клетках стимулирует разрушение аминокислот и образование α-кетоглутарата, поступающего в ЦТК как энергетический субстрат. Глутаматдегидрогеназа может индуцироваться стероидными гормонами (кортизолом).
Оксидаза L-аминокислот
В печени и почках обнаружен фермент оксидаза L-аминокислот, способный дезаминировать некоторые L-аминокислоты (см. схему в конце стр.).
Коферментом в данной реакции выступает FМN. Однако вклад оксидазы L-аминокислот в дезаминирование, очевидно, незначителен, так как оптимум её действия лежит в щелочной среде (pH 10,0). В клетках, где pH среды близок к нейтральному, активность фермента очень низка.
Оксидаза D-аминокислот также обнаружена в почках и печени. Это FАD-зависимый фермент. Оптимум pH этой оксидазы лежит в нейтральной среде, поэтому фермент более активен, чем оксидаза L-аминокислот. Роль оксидазы D-аминокислот невелика, так как количество D-изомеров в организме крайне мало, потому что в белки пищи и белки тканей человека и животных входят только природные L-аминокислоты. Вероятно, оксидаза D-аминокислот способствует их превращению в соответствующие L-изомеры (рис. 9-8).
Рис. 9-8. Биологическая роль оксидазы D-аминокислот.

2. Непрямое дезаминирование (трансдезаминирование)
Большинство аминокислот не способно дезаминироваться в одну стадию, подобно Глу. Аминогруппы таких аминокислот в результате трансаминирования переносятся на α-кетоглутарат с образованием глутаминовой кислоты, которая затем подвергается прямому окислительному дезаминированию. Такой механизм дезаминирования аминокислот в 2 стадии получил название трансдезаминирования, или непрямого дезаминирования:
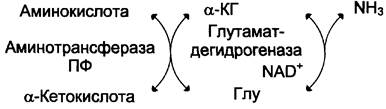
Непрямое дезаминирование аминокислот происходит при участии 2 ферментов: амино-трансферазы (кофермент ПФ) и глутаматдегидрогеназы (кофермент NАD+).
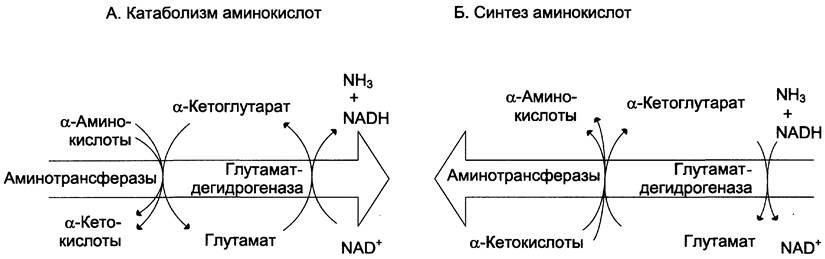
Значение этих реакций в обмене аминокислот очень велико, так как непрямое дезаминирование — основной способ дезаминирования большинства аминокислот. Обе стадии непрямого дезаминирования обратимы (рис. 9-9), что обеспечивает как катаболизм аминокислот (рис. 9-9, А), так и возможность образования практически любой аминокислоты из соответствующей α-кетокислоты (рис. 9-9, Б).
Рис. 9-9. Биологическая роль непрямого дезаминирования. А — при катаболизме почти все природные аминокислоты сначала передают аминогруппу на α-кетоглутарат в реакции трансаминирования с образованием глутамата и соответствующей кетокислоты. Затем глутамат подвергается прямому окислительному дезаминированию под действием глутаматдегидрогеназы, в результате чего получаются α-кетоглутарат и аммиак; Б — при необходимости синтеза аминокислот и наличии необходимых α-кетокислот обе стадии непрямого дезаминирования протекают в обратном направлении. В результате восстановительного аминирования α-кетоглутарата образуется глутамат, который вступает в трансаминирование с соответствующей α-кетокислотой, что приводит к синтезу новой аминокислоты.
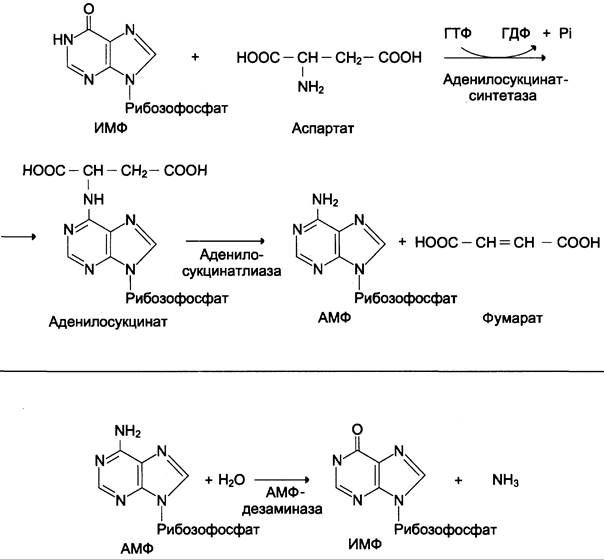
В мышечной ткани активность глутаматдегидрогеназы низка, поэтому в этих клетках при интенсивной физической нагрузке функционирует ещё один путь непрямого дезаминирования с участием цикла ИМФ-АМФ. Вначале происходит перенос аминогруппы аминокислот на аспартат, затем на инозиновую кислоту (ИМФ) и в завершение — дезаминирование АМФ. Представленная схема отражает последовательность реакций непрямого неокислительного дезаминирования:

Можно выделить 4 стадии процесса:
✵ трансаминирование с α-кетоглутаратом, образование глутамата;
✵ трансаминирование глутамата с оксалоацетатом (фермент ACT), образование аспартата;
✵ реакция переноса аминогруппы от аспартата на ИМФ (инозинмонофосфат), образование АМФ и фумарата;
✵ гидролитическое дезаминирование АМФ.
Перенос аминогруппы от аспартата и синтез АМФ происходят следующим образом (см. схему А).
Реакция дезаминирования адениловой кислоты происходит под действием фермента АМФ дезаминазы (см. схему Б).
Схема А

Схема Б
Этот путь дезаминирования преобладает в мышцах при интенсивной работе, в результате которой накапливается молочная кислота. Выделяющийся аммиак предотвращает закисление среды в клетках, вызванное образованием лактата.
3. Неокислительное дезаминирование
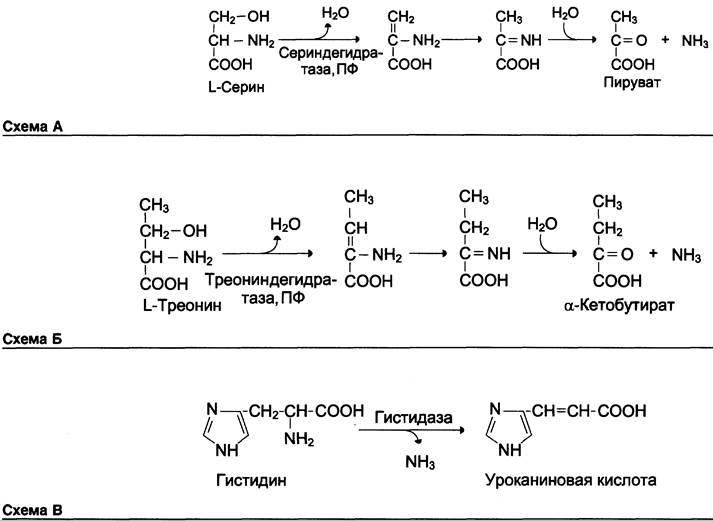
В печени человека присутствуют специфические ферменты, катализирующие реакции дезаминирования аминокислот серина, треонина и гистидина неокислительным путём.
Неокислительное дезаминирование серина катализирует сериндегидратаза (см. схему А).
Реакция начинается с отщепления молекулы воды и образования метиленовой группы, затем происходит неферментативная перестройка молекулы, в результате которой образуется иминогруппа, слабо связанная с α-углеродным атомом. Далее в результате неферментативного гидролиза отщепляется молекула аммиака и образуется пируват.
Неокислительное дезаминирование треонина катализирует фермент треониндегидратаза. Механизм реакции аналогичен дезаминированию серина (см. схему Б на с. 477).
Эти ферменты пиридоксальфосфатзависимые.
Неокислительное дезаминирование гистидина под действием фермента гистидазы (гистидин- аммиаклиазы) является внутримолекулярным, так как образование молекулы аммиака происходит из атомов самой аминокислоты без участия молекулы воды. Эта реакция происходит только в печени и коже (см. схему В).
Такие заболевания, как цистинурия, болезнь Хартнапа и некоторые другие, возникают вследствие дефекта переносчиков нейтральных аминокислот в кишечнике и почках. Описана врождённая патология, связанная с дефектом фермента 5-оксопролиназы (рис. 9-5, реакция 4). При этом с мочой выделяется оксопролин. У этих больных нарушены транспорт аминокислот в ткани и их метаболизм в клетках.