БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 12. ОБЕЗВРЕЖИВАНИЕ ТОКСИЧЕСКИХ ВЕЩЕСТВ В ОРГАНИЗМЕ
Печень — самая крупная железа пищеварительного тракта. Она выполняет в организме функцию биохимической лаборатории и играет важную роль в белковом, углеводном и липидном обменах (см. ниже). В печени синтезируются важнейшие белки плазмы крови: альбумин, фибриноген, протромбин, церулоплазмин, транс- феррин, ангиотензиноген и др. Через эти белки опосредуется участие печени в таких важных процессах, как поддержание онкотического давления, регуляция АД и объёма циркулирующей крови, свёртывание крови, метаболизм железа и др.
Важнейшая функция печени — детоксикационная (или барьерная). Она имеет существенное значение для сохранения жизни организма. В печени происходит обезвреживание таких веществ, как билирубин и продукты катаболизма аминокислот в кишечнике, а также инактивируются лекарственные препараты и токсические вещества экзогенного происхождения, NН3 — продукт азотистого обмена, который в результате ферментативных реакций превращается в нетоксичную мочевину, гормоны и биогенные амины.
Вещества, поступающие в организм из окружающей среды и не используемые им для построения тканей организма или как источники энергии, называют чужеродными веществами, или ксенобиотиками. Эти вещества могут попадать в организм с пищей, через кожу или с вдыхаемым воздухом.
Чужеродные вещества, или ксенобиотики, делят на 2 группы:
✵ продукты хозяйственной деятельности человека (промышленность, сельское хозяйство, транспорт);
✵ вещества бытовой химии — моющие средства, вещества для борьбы с насекомыми, парфюмерия.
Гидрофильные ксенобиотики выводятся из организма в неизменённом виде с мочой, гидрофобные могут задерживаться в тканях, связываясь с белками или образуя комплексы с липидами клеточных мембран. Со временем накопление в клетках тканей чужеродного вещества приведёт к нарушению их функций. Для удаления таких ненужных для организма веществ в процессе эволюции выработались механизмы их детоксикации (обезвреживания) и выведения из организма.
Основные функции печени
Обмен углеводов
Глюконеогенез
Синтез и распад гликогена
Обмен липидов и их производных
Синтез жирных кислот и жиров из углеводов
Синтез и выведение холестерина
Формирование липопротеинов
Кетогенез
Синтез жёлчных кислот 25-гидроксилирование витамина
Обмен белков
Синтез белков плазмы крови (включая некоторые факторы свёртывания крови)
Синтез мочевины (обезвреживание аммиака)
Обмен гормонов
Метаболизм и выделение стероидных гормонов
Метаболизм полипептидных гормонов
Метаболизм и экскреция билирубина
Депонирование
гликогена
витамина А
витамина В12
железа
Лекарства и чужеродные вещества
Метаболизм и экскреция
I. Механизмы обезвреживания ксенобиотиков
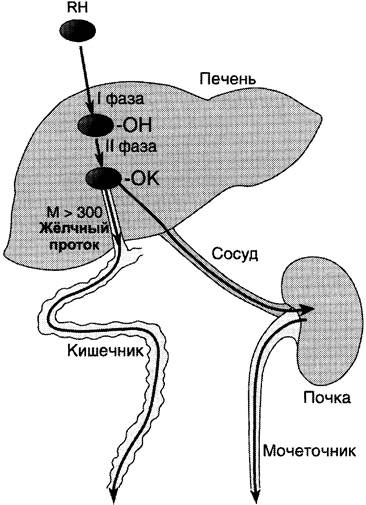
Обезвреживание большинства ксенобиотиков происходит путём химической модификации и протекает в 2 фазы (рис. 12-1). В результате этой серии реакций ксенобиотики становятся более гидрофильными и выделяются с мочой. Вещества, более гидрофобные или обладающие большой молекулярной массой (>300 кД), чаще выводятся с жёлчью в кишечник и затем удаляются с фекалиями.
Рис. 12-1. Метаболизм и выведение ксенобиотиков из организма. RH — ксенобиотик; К — группа, используемая при конъюгации (глутатион, глюкуронил и др.); М — молекулярная масса. Из множества цитохром Р450-зависимых реакций на рисунке приведена только одна — схема гидроксилирования ксенобиотика. В ходе первой фазы в структуру вещества RH вводится полярная группа ОН-. Далее происходит реакция конъюгации; конъюгат в зависимости от растворимости и молекулярной массы удаляется либо почками, либо с фекалиями.
Система обезвреживания включает множество разнообразных ферментов, под действием которых практически любой ксенобиотик может быть модифицирован.
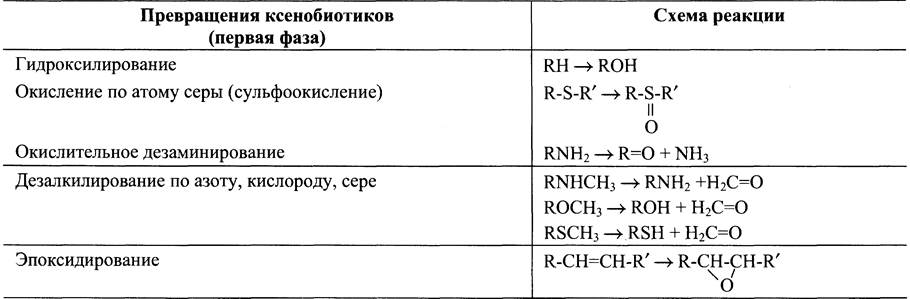
Микросомальные ферменты катализируют реакции С-гидроксилирования, Nгидроксилирования, О-, N-, S-дезалкилирования, окислительного дезаминирования, сульфоокисления и эпоксидирования (табл. 12-1).
Таблица 12-1. Возможные модификации ксенобиотиков в первой фазе обезвреживания
В мембранах ЭР практически всех тканей локализована система микросомального окисления (монооксигеназного окисления). В эксперименте при выделении ЭР из клеток мембрана распадается на части, каждая из которых образует замкнутый пузырёк — микросому, отсюда и название — микросомальное окисление. Эта система обеспечивает первую фазу обезвреживания большинства гидрофобных веществ. В метаболизме ксенобиотиков могут принимать участие ферменты почек, лёгких, кожи и ЖКТ, но наиболее активны они в печени. К группе микросомальных ферментов относят специфические оксидазы, различные гидролазы и ферменты конъюгации.
Вторая фаза — реакции конъюгации, в результате которых чужеродное вещество, модифицированное ферментными системами ЭР, связывается с эндогенными субстратами — глюкуроновой кислотой, серной кислотой, глицином, глутатионом. Образовавшийся конъюгат удаляется из организма.
А. Микросомальное окисление
Микросомальные оксидазы — ферменты, локализованные в мембранах гладкого ЭР, функционирующие в комплексе с двумя внемитохондриальными ЦПЭ. Ферменты, катализирующие восстановление одного атома молекулы О2 с образованием воды и включение другого атома кислорода в окисляемое вещество, получили название микросомальных оксидаз со смешанной функцией или микросомальных монооксигеназ. Окисление с участием монооксигеназ обычно изучают, используя препараты микросом.
1. Основные ферменты микросомальных электронтранспортных цепей
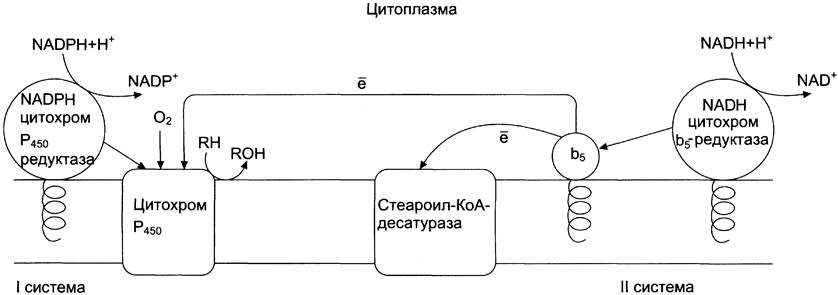
Микросомальная система не содержит растворимых в цитозоле белковых компонентов, все ферменты — мембранные белки, активные центры которых локализованы на цитоплазматической поверхности ЭР. Система включает несколько белков, составляющих электронтранспортные цепи (ЦПЭ). В ЭР существуют две такие цепи, первая состоит из двух ферментов — NADPH-P450 редуктазы и цитохрома Р450, вторая включает фермент NADH-цитохром-b5 редуктазу, цитохром b5 и ещё один фермент — стеароил-КоА-десатуразу.
Электронтранспортная цепь — NADPH-P450 редуктаза — цитохром Р450. В большинстве случаев донором электронов (e) для этой цепи служит NADPH, окисляемый NADPH-P450 редуктазой. Фермент в качестве простетической группы содержит 2 кофермента — флавинадениндинуклеотид (FAD) и флавинмононуклеотид (FMN). Протоны и электроны с NADPH переходят последовательно на коферменты NADPH-P450 редуктазы. Восстановленный FMN (FMNH2) окисляется цитохромом Р450 (см. схему ниже).
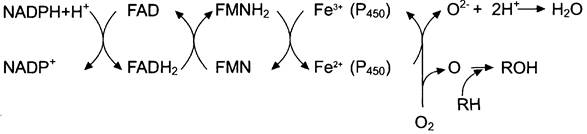
Цитохром Р450 — гемопротеин, содержит простетическую группу гем и имеет участки связывания для кислорода и субстрата (ксенобиотика). Название цитохром Р450 указывает на то, что максимум поглощения комплекса цитохрома Р450 лежит в области 450 нм.
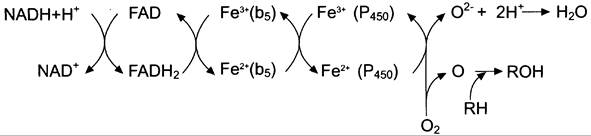
Окисляемый субстрат (донор электронов) для NADH-цитохром b5-редуктазы — NADH (см. схему выше). Протоны и электроны с NADH переходят на кофермент редуктазы FAD, следующим акцептором электронов служит Fe3+ цитохрома b5. Цитохром b5 в некоторых случаях может быть донором электронов (e) для цитохрома Р450 или для стеароил-КоА-десатуразы, которая катализирует образование двойных связей в жирных кислотах, перенося электроны на кислород с образованием воды (рис. 12-2).
Рис. 12-2. Электронтранспортные цепи ЭР. RН — субстрат цитохрома Р450; стрелками показаны реакции переноса электронов. В одной системе NАDРH окисляется NАDРHцитохром Р450-редуктазой, которая затем передаёт электроны на целое семейство цитохромов Р450. Вторая система включает в себя окисление NАDН цитохром b5-редуктазой, электроны переходят на цитохром b5; восстановленную форму цитохрома b5 окисляет стеароил-КоА-десатураза, которая переносит электроны на O2.
NADH-цитохром b5 редуктаза — двухдоменный белок. Глобулярный цитозольный домен связывает простетическую группу — кофермент FAD, а единственный гидрофобный «хвост» закрепляет белок в мембране.
Цитохром b5 — гемсодержащий белок, который имеет домен, локализованный на поверхности мембраны ЭР, и короткий «заякоренный» в липидном бислое спирализованный домен.
NАDН-цитохром b5-редукгаза и цитохром b5, являясь «заякоренными» белками, не фиксированы строго на определённых участках мембраны ЭР и поэтому могут менять свою локализацию.
2. Функционирование цитохрома Р450
Известно, что молекулярный кислород в триплетном состоянии инертен и не способен взаимодействовать с органическими соединениями. Чтобы сделать кислород реакционноспособным, необходимо его превратить в синглетный, используя ферментные системы его восстановления. К числу таковых принадлежит моноксигеназная система, содержащая цитохром Р450. Связывание в активном центре цитохрома Р450 липофильного вещества RН и молекулы кислорода повышает окислительную активность фермента. Один атом кислорода принимает 2 e и переходит в форму О2-. Донором электронов служит NADPH, который окисляется NADPH-цитохром Р450 редуктазой. О2- взаимодействует с протонами: О2- + 2Н+ —> Н2O, и образуется вода. Второй атом молекулы кислорода включается в субстрат RH, образуя гидроксильную группу вещества R-OH (рис. 12-3).
Рис. 12-3. Транспорт электронов при монооксигеназном окислении с участием Р450. Связывание (1) в активном центре цитохрома Р450 вещества RН активирует восстановление железа в геме — присоединяется первый электрон (2). Изменение валентности железа увеличивает сродство комплекса Р450-Fе2+• RН к молекуле кислорода (3). Появление в центре связывания цитохрома Р450 молекулы O2 ускоряет присоединение второго электрона и образование комплекса Р450-Fе2+О2--RН (4). На следующем этапе (5) Fе2+окисляется, второй электрон присоединяется к молекуле кислорода Р450-Fе3+О22-. Восстановленный атом кислорода (О2-) связывает 2 протона, и образуется 1 молекула воды. Второй атом кислорода идёт на построение ОН-группы (6). Модифицированное вещество R-ОН отделяется от фермента (7).

Суммарное уравнение реакции гидроксилирования вещества RH ферментами микросомального окисления:
RH + O2 + NADPH + Н+ —> ROH + Н2O + NADP+.
Субстратами Р450 могут быть многие гидрофобные вещества как экзогенного (лекарственные препараты, ксенобиотики), так и эндогенного (стероиды, жирные кислоты и др.) происхождения.
Таким образом, в результате первой фазы обезвреживания с участием цитохрома Р450 происходит модификация веществ с образованием функциональных групп, повышающих растворимость гидрофобного соединения. В результате модификации возможна потеря молекулой её биологической активности или даже формирование более активного соединения, чем вещество, из которого оно образовалось.
3. Свойства системы микросомального окисления
Важнейшие свойства ферментов микросомального окисления: широкая субстратная специфичность, которая позволяет обезвреживать самые разнообразные по строению вещества, и регуляция активности по механизму индукции.
Широкая субстратная специфичность. Изоформы Р450
К настоящему времени описано около 150 генов цитохрома Р450, кодирующих различные изоформы фермента. Каждая из изоформ Р450 имеет много субстратов. Этими субстратами могут быть как эндогенные липофильные вещества, модификация которых входит в путь нормального метаболизма этих соединений, так и гидрофобные ксенобиотики, в том числе лекарства. Определённые изоформы цитохрома Р450 участвуют в метаболизме низкомолекулярных соединений, таких как этанол и ацетон.
Регуляция активности микросомальной системы окисления
Регуляция активности микросомальной системы осуществляется на уровне транскрипции или посттранскрипционных изменений. Индукция синтеза позволяет увеличить количество ферментов в ответ на поступление или образование в организме веществ, выведение которых невозможно без участия системы микросомального окисления.
В настоящее время описано более 250 химических соединений, вызывающих индукцию микросомальных ферментов. К числу этих индукторов относят барбитураты, полициклические ароматические углеводороды, спирты, кетоны и некоторые стероиды. Несмотря на разнообразие химического строения, все индукторы имеют ряд общих признаков; их относят к числу липофильных соединений, и они служат субстратами для цитохрома Р450.
Б. Конъюгация — вторая фаза обезвреживания веществ
Вторая фаза обезвреживания веществ — реакции конъюгации, в ходе которых происходит присоединение к функциональным группам, образующимся на первом этапе, других молекул или групп эндогенного происхождения, увеличивающих гидрофильность и уменьшающих токсичность ксенобиотиков (табл. 12-2).
Таблица 12-2. Основные ферменты и метаболиты, участвующие в конъюгации
Фермент |
Метаболит, используемый для конъюгации |
Активная форма метаболитов |
Глутатионтрансфераза |
Глутатион (GSН) |
Глутатион (GSH) |
УДФ-глюкуронилтрансфераза |
Глюкуронат |
УДФ-глюкуронат |
Сульфотрансфераза |
Сульфат |
ФАФС |
Ацетилтрансфераза |
Ацетат |
Ацетил КоА |
Метилтрансфераза |
Метил |
SAM |
1. Участие трансфераз в реакциях конъюгации
Все ферменты, функционирующие во второй фазе обезвреживания ксенобиотиков, относят к классу трансфераз. Они характеризуются широкой субстратной специфичностью.
УДФ-глюкуронилтрансферазы
Локализированные в основном в ЭР уридин- дифосфат (УДФ)-глюкуронилтрансферазы присоединяют остаток глюкуроновой кислоты к молекуле вещества, образованного в ходе микросомального окисления (рис. 12-4).
Рис. 12-4. Уридиндифосфоглюкуроновая кислота (УДФ-С6H9О6).

В общем виде реакция с участием УДФ-глюкуронилтрансферазы записывается так:
ROH + УДФ-С6Н9О6 = RO-C6H9O6 + УДФ.
Сульфотрансферазы
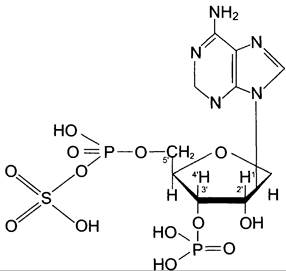
Цитоплазматические сульфотрансферазы катализируют реакцию конъюгации, в ходе которой остаток серной кислоты (-SO3Н) от 3'-фос- фоаденозин-5'-фосфосульфата (ФАФС) присоединяется к фенолам, спиртам или аминокислотам (рис. 12-5).
Рис. 12-5. 3'-Фосфоаденозин-5'-фосфосульфат(ФАФ-SO3Н).
Реакция с участием сульфотрансферазы в общем виде записывается так:
ROH + ФАФ-SO3H = RO-SO3H + ФАФ.
Ферменты сульфотрансферазы и УДФ-глюкуронилтрансферазы участвуют в обезвреживании ксенобиотиков, инактивации лекарств и эндогенных биологически активных соединений.
Глутатионтрансферазы
Особое место среди ферментов, участвующих в обезвреживании ксенобиотиков, инактивации нормальных метаболитов, лекарств, занимают глутатионтрансферазы (ГТ). Глутатионтрансферазы функционируют во всех тканях и играют важную роль в инактивации собственных метаболитов: некоторых стероидных гормонов, простагландинов, билирубина, жёлчных кислот, продуктов ПОЛ.
Известно множество изоформ ГТ с различной субстратной специфичностью. В клетке ГТ в основном локализованы в цитозоле, но имеются варианты ферментов в ядре и митохондриях. Для работы ГТ требуется глутатион (GSH) (рис. 12-6).
Рис. 12-6. Глутатион (GSH).
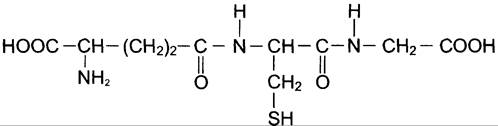
Глутатион — трипептид Глу-Цис-Гли (остаток глутаминовой кислоты присоединён к цистеину карбоксильной группой радикала).
ГТ обладают широкой специфичностью к субстратам, общее количество которых превышает 3000. ГТ связывают очень многие гидрофобные вещества и инактивируют их, но химической модификации с участием глутатиона подвергаются только те, которые имеют полярную группу. То есть субстратами служат вещества, которые, с одной стороны, имеют электрофильный центр (например, ОН-группу), а с другой стороны — гидрофобные зоны. Обезвреживание, т.е. химическая модификация ксенобиотиков с участием ГТ, может осуществляться тремя различными способами:
✵ путём конъюгации субстрата R с глутатионом (GSH):
R + GSH —> GSRH,
✵ в результате нуклеофильного замещения:
RX + GSH —> GSR + НХ,
✵ восстановления органических пероксидов до спиртов:
R-HC-O-OH + 2 GSH —> R-HC-OH + GSSG + Н2О.
В реакции: ООН — гидропероксидная группа, GSSG — окисленный глутатион.
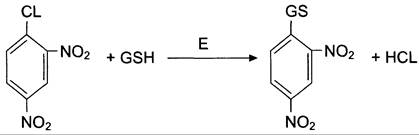
Система обезвреживания с участием ГТ и глутатиона играет уникальную роль в формировании резистентности организма к самым различным воздействиям и является наиболее важным защитным механизмом клетки. В ходе биотрансформации некоторых ксенобиотиков под действием ГТ образуются тиоэфиры (конъюгаты RSG), которые затем превращаются в меркаптаны, среди которых обнаружены токсические продукты. Но конъюгаты GSН с большинством ксенобиотиков менее реакционноспособны и более гидрофильны, чем исходные вещества, а поэтому менее токсичны и легче выводятся из организма (рис. 12-7).
Рис. 12-7. Обезвреживание 1-хлор, 2,4-динитробензола с участием глутатиона.
ГТ своими гидрофобными центрами могут нековалентно связывать огромное количество липофильных соединений (физическое обезвреживание), предотвращая их внедрение в липидный слой мембран и нарушение функций клетки. Поэтому ГТ иногда называют внутриклеточным альбумином.
ГТ могут ковалентно связывать ксенобиотики, являющиеся сильными электролитами. Присоединение таких веществ — «самоубийство» для ГТ, но дополнительный защитный механизм для клетки.
Ацетилтрансферазы, метилтрансферазы
Ацетилтрансферазы катализируют реакции конъюгации — переноса ацетильного остатка от ацетил-КоА на азот группы -SO2NH2, например, в составе сульфаниламидов. Мембранные и цитоплазматические метилтрансферазы с участием SAM метилируют группы -Р = O, -NH2 и SH-группы ксенобиотиков.
2. Роль эпоксидгидролаз в образовании диолов
Во второй фазе обезвреживания (реакции конъюгации) принимают участие и некоторые другие ферменты. Эпоксидгидролаза (эпоксид- гидратаза) присоединяет воду к эпоксидам бензола, бензпирена и другим полициклическим углеводородам, образованным в ходе первой фазы обезвреживания, и превращает их в диолы (рис. 12-8). Эпоксиды, образовавшиеся при микросомальном окислении, являются канцерогенами. Они обладают высокой химической активностью и могут участвовать в реакциях неферментативного алкилирования ДНК, РНК, белков (см. раздел 16). Химические модификации этих молекул могут привести к перерождению нормальной клетки в опухолевую.
Рис. 12-8. Обезвреживание бензантрацена. Е1 — фермент микросомальной системы; Е2 — эпоксидгидратаза.

В. Гниение аминокислот в кишечнике. Обезвреживание и выведение продуктов гниения из организма
Аминокислоты, невсосавшиеся в клетки кишечника, используются микрофлорой толстой кишки в качестве питательных веществ. Ферменты бактерий расщепляют аминокислоты и превращают их в амины, фенолы, индол, скатол, сероводород и другие ядовитые для организма соединения. Этот процесс иногда называют гниением белков в кишечнике. В основе гниения лежат реакции декарбоксилирования и дезаминирования аминокислот.
Образование и обезвреживание n-крезола и фенола
Под действием ферментов бактерий из аминокислоты тирозина могут образовываться фенол и крезол путём разрушения боковых цепей аминокислот микробами (рис. 12-9).
Рис. 12-9. Катаболизм тирозина под действием бактерий. Е — бактериальные ферменты.

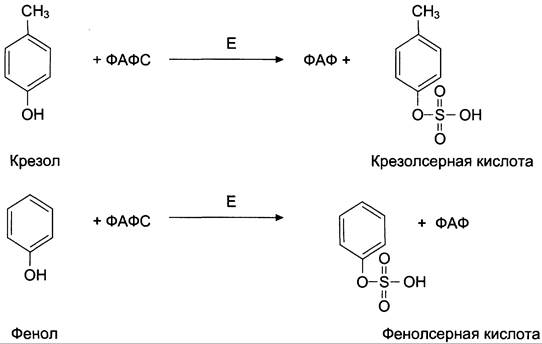
Всосавшиеся продукты по воротной вене поступают в печень, где обезвреживание фенола и крезола может происходить путём конъюгации с сернокислотным остатком (ФАФС) или с глюкуроновой кислотой в составе УДФ-глюкуроната. Реакции конъюгации фенола и крезола с ФАФС катализирует фермент сульфотрансфераза (рис. 12-10).
Рис. 12-10. Конъюгация фенола и крезола с ФАФС. Е — сульфотрансфераза.
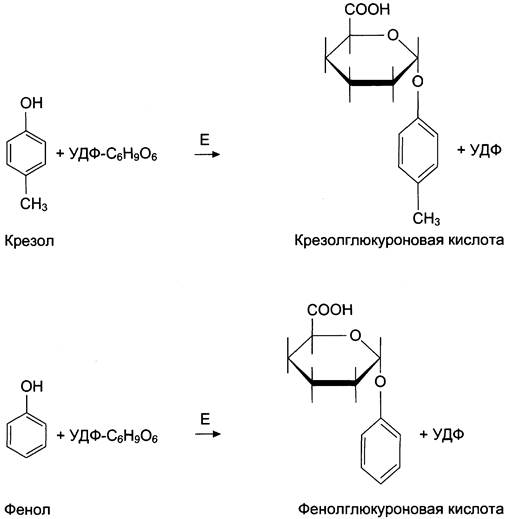
Конъюгация глюкуроновых кислот с фенолом и крезолом происходит при участии фермента УДФ-глюкуронилтрансферазы (рис. 12-11). Продукты конъюгации хорошо растворимы в воде и выводятся с мочой через почки. Повышение количества конъюгатов глюкуроновой кислоты с фенолом и крезолом обнаруживают в моче при увеличении продуктов гниения белков в кишечнике.
Рис. 12-11. Участие УДФ-глюкуронилтрансферазы в обезвреживании крезола и фенола. Е — УДФ-глюкуронилтрансфераза.
Образование и обезвреживание индола и скатола
В кишечнике из аминокислоты триптофана микроорганизмы образуют индол и скатол. Бактерии разрушают боковую цепь триптофана, оставляя нетронутой кольцевую структуру.
Индол образуется в результате отщепления бактериями боковой цепи, возможно, в виде серина или аланина (рис. 12-12).
Рис. 12-12. Катаболизм триптофана под действием бактерий. Е — бактериальные ферменты.

Скатол и индол обезвреживаются в печени в 2 этапа. Сначала в результате микросомального окисления они приобретают гидроксильную группу. Так, индол переходит в индоксил, а затем вступает в реакцию конъюгации с ФАФС, образуя индоксилсерную кислоту, калиевая соль которой получила название животного индикана (рис. 12-13).
Рис. 12-13. Участие сульфотрансферазы в обезвреживании индола. Е — сульфотрансфераза.

Обезвреживание бензойной кислоты
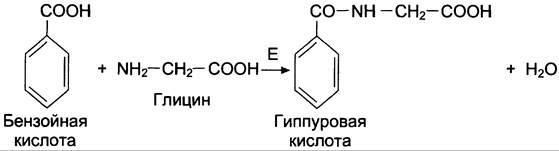
Синтез гиппуровой кислоты из бензойной кислоты и глицина протекает у человека и большинства животных преимущественно в печени (рис. 12-14). Скорость этой реакции отражает функциональное состояние печени.
Рис. 12-14. Образование гиппуровой кислоты из бензойной кислоты и глицина. Е — глицинтрансфераза.
В клинической практике используют определение скорости образования и выведения гиппуровой кислоты после введения в организм ксенобиотика бензойной кислоты (бензойнокислого натрия) — проба Квика.
Г. Связывание, транспорт и выведение ксенобиотиков
В плазме крови множество как эндогенных, так и экзогенных липофильных веществ транспортируются альбумином и другими белками.
Альбумин — основной белок плазмы крови, связывающий различные гидрофобные вещества. Он может функционировать в качестве белка-переносчика билирубина, ксенобиотиков, лекарственных веществ.
Помимо альбуминов, ксенобиотики могут транспортироваться по крови в составе липопротеинов, а также в комплексе с кислым α1-гликопротеином. Особенность этого гликопротеина состоит в том, что он является индуцируемым белком, участвующим в ответной реакции организма на изменения, происходящие в состоянии стресса, например, при инфаркте миокарда, воспалительных процессах; его количество в плазме увеличивается наряду с другими протеинами. Связывая ксенобиотики, кислый α1-гликопротеин инактивирует их и переносит в печень, где комплекс с белком распадается, и чужеродные вещества обезвреживаются и выводятся из организма.
Участие Р-гликопротеина в выведении ксенобиотиков
Очень важный механизм выведения из клетки гидрофобных ксенобиотиков — функционирование Р-гликопротеина (транспортная АТФ-аза). Р-гликопротеин — фосфогликопротеин с молекулярной массой 170 кД, присутствующий в плазматической мембране клеток многих тканей, в частности почек и кишечника. Полипептидная цепь этого белка содержит 1280 аминокислотных остатков, образуя 12 трансмембранных доменов и два АТФ-связывающих центра (рис. 12-15). В норме его функция состоит в экскреции ионов хлора и гидрофобных токсичных соединений из клеток.
Рис. 12-15. Строение Р-гликопротеина. Р-гликопротеин — интегральный белок, имеющий 12 трансмембранных доменов, пронизывающих бислой цитоплазматической мембраны. N- и С-концы белка обращены в цитозоль. Участки Р-гликопротеина на наружной поверхности мембраны гликозилированы. Область между шестым и седьмым доменами имеет центры для присоединения АТФ и аутофосфорилирования.

Когда гидрофобное вещество (например, противоопухолевое лекарство) проникает в клетку, то оно удаляется из неё Р-гликопротеином с затратой энергии (рис. 12-16). Уменьшение количества лекарства в клетке снижает эффективность его применения при химиотерапии онкологических заболеваний.
Рис. 12-16. Функционирование Р-гликопротеина. Заштрихованный овал — противоопухолевое лекарство (гидрофобное вещество).

Д. Индукция защитных систем
Многие ферменты, участвующие в первой и второй фазе обезвреживания, — индуцируемые белки. Ещё в древности царь Митридат знал, что, если систематически принимать небольшие дозы яда, можно избежать острого отравления. «Эффект Митридата» основан на индукции определённых защитных систем (табл. 12-3).
Таблица 12-3. Индукции систем, обеспечивающих защиту от ксенобиотиков
Ферменты защитной системы |
Фенобарбитал |
Тяжёлые металлы |
Противоопухолевые лекарства и другие гидрофобные вещества |
Система цитохрома Р450 |
↑ |
||
Эпоксидгидролазы |
↑ |
||
Глутатион и УДФ-глюкуронилтрансферазы |
↑ |
||
Синтез GSН |
↑ |
↑ |
|
Металлотионеины |
↑ |
||
Р-гликопротеин |
↑ |
В мембранах ЭР печени цитохрома Р450 содержится больше (20%), чем других мембрано-связанных ферментов. Лекарственное вещество фенобарбитал активирует синтез цитохрома Р450, УДФ-глюкуронилтрансферазы и эпоксид гидролазы. Например, у животных, которым вводили индуктор фенобарбитал, увеличивается площадь мембран ЭР, которая достигает 90% всех мембранных структур клетки, и, как следствие, — увеличение количества ферментов, участвующих в обезвреживании ксенобиотиков или токсических веществ эндогенного происхождения.
При химиотерапии злокачественных процессов начальная эффективность лекарства часто постепенно падает. Более того, развивается множественная лекарственная устойчивость, т. е. устойчивость не только к этому лечебному препарату, но и целому ряду других лекарств. Это происходит потому, что противоопухолевые лекарства индуцируют синтез Р-гликопротеина, глутатионтрансферазы и глутатиона. Использование веществ, ингибирующих или активирующих синтез Р-гликопротеина, а также ферменты синтеза глутатиона, повышает эффективность химиотерапии.
Металлы являются индукторами синтеза глутатиона и низкомолекулярного белка металлотионеина, имеющих SН-группы, способные связывать их. В результате возрастает устойчивость клеток организма к ядам и лекарствам.
Повышение количества глутатионтрансфераз увеличивает способность организма приспосабливаться к возрастающему загрязнению внешней среды. Индукцией фермента объясняют отсутствие антиканцерогенного эффекта при применении ряда лекарственных веществ. Кроме того, индукторы синтеза глутатионтрансферазы — нормальные метаболиты — половые гормоны, йодтиронины и кортизол. Катехоламины через аденилатциклазную систему фосфорилируют глутатионтрансферазу и повышают её активность.
Ряд веществ, в том числе и лекарств (например, тяжёлые металлы, полифенолы, S-алкилы глутатиона, некоторые гербициды), ингибируют глутатионтрансферазу.