БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 14. БИОХИМИЯ КРОВИ
II. Особенности метаболизма фагоцитирующих клеток
Способность некоторых клеток крови к фагоцитозу — одна из защитных функций крови. В фагоцитозе участвуют 2 типа лейкоцитов — нейтрофилы и моноциты. Нейтрофилы содержат многодольчатое ядро, поэтому их ещё называют полиморфноядерными лейкоцитами (ПЯЛ). Они поступают в кровоток из костного мозга и имеют продолжительность жизни около 8 сут. Взаимодействие белков интегринов (см. раздел 15) с рецепторами эндотелиальных клеток капилляров приводит к адгезии нейтрофилов, которые далее мигрируют в ткань.
Моноциты также могут выходить из кровяного русла, и тогда их называют макрофагами. Оба типа фагоцитов захватывают и разрушают бактерии. Макрофаги, кроме того, утилизируют старые повреждённые клетки и клеточные оболочки, в частности они поглощают около 1011 эритроцитов в сутки. Фагоцитоз — особая форма эндоцитоза, при которой образуются большие эндоцитозные пузырьки, размеры которых определяются размерами поглощаемых частиц.
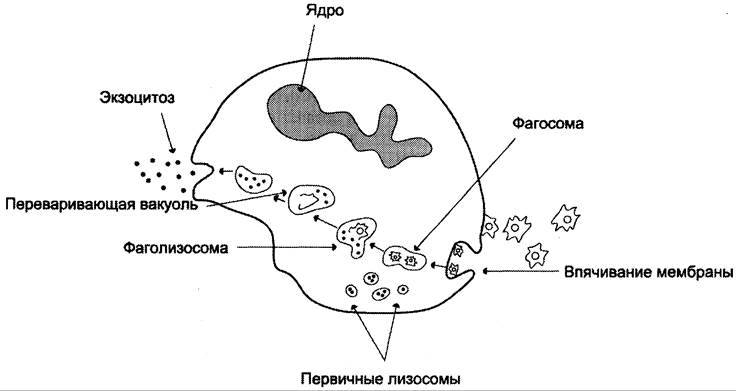
Образование фагосомы начинается с взаимодействия специфических рецепторов фагоцитов с бактерией или комплексом антиген — антитело. Рецепторы, расположенные в тех участках плазматической мембраны, где локализован особый белок клатрин (см. раздел 5), «узнают» компоненты комплемента, олигосахариды на поверхности микроорганизмов или Fс области комплекса антиген— антитело (см. раздел 1). Активация рецепторов, передающих сигнал в клетку с участием инозитолфосфатной системы, инициирует процессы, определяющие фагоцитарный ответ клетки. Он включает в себя формирование фагосомы, слияние её с л изосомой, образование фаголизосомы, активацию кислородзависимых бактерицидных механизмов уничтожения микробов и/или выработку клетками токсичного для микробов оксида азота, а также действие кислороднезависимых механизмов уничтожения микроорганизмов.
Формирование фагосомы. Взаимодействие микробной клетки с поверхностью фагоцита приводит к образованию на его мембране выростов — псевдоподий, окружающих микробную клетку. Фагосома, сформированная таким образом, вместе с захваченной бактерией погружается внутрь фагоцита.
Образование фаголизосомы. В цитозоле фагосомы сливаются с первичными лизосомами, образуя фаголизосомы. Первичные лизосомы, образованные аппаратом Гольджи, содержат ряд заключённых в гранулы гидролаз, способных разрушать органические молекулы в кислой среде фаголизосом: протеиназы, фосфатазы, эстеразы, ДНК-азы, РНК-азы. Низкое значение pH внутри фагосом оказывает бактерицидное действие и создаёт оптимальную среду для активации ли- зосомальных гидролаз. В результате действия этих ферментов разрушаются полимерные молекулы микроорганизмов и образуются аминокислоты, моносахариды, нуклеотиды, которые поступают в цитозоль и могут использоваться клеткой. Большая часть мембранных компонентов и непереваренные субстраты локализуются в остаточных тельцах, которые путём экзоцитоза возвращаются на поверхность плазматической мембраны фагоцитов, при этом значительная часть мембранных компонентов может утилизироваться и в самой мембране (рис. 14-6).
Рис. 14-6. Фагоцитоз в нейтрофилах.
Активация кислородзависимых бактерицидных механизмов уничтожения микробов. Ферментный комплекс мембраны фагосом — NADPH-oкcидаза восстанавливает O2, образуя супероксидный анион:
2 O2 + NАDРН —> 2 O2- + NАDР+ + Н+.
Супероксидный анион спонтанно или при участии фермента супероксидцисмутазы превращается в пероксид водорода:
O2- + O2- + 2Н+ —> Н2O2 + O2.
Под действием миелопероксидазы, проникающей в фагосому при её слиянии с лизосомой, из пероксидов в присутствии галогенов (йодидов и хлоридов) образуются дополнительные токсичные окислители — гипойодид и гипохлорид.
H2O2 + Сl- +Н+ —> НОСl + H2O.
Все эти молекулы являются сильными окислителями и оказывают бактерицидное действие. Резкое увеличение потребления кислорода фагоцитирующей клеткой называется «респираторным взрывом» (рис. 14-7).
Рис. 14-7. Образование активных форм кислорода фагоцитирующими клетками при респираторном взрыве. Активация NАDРH оксидазы, локализованной в мембране клетки, вызывает образование супероксидного аниона. В результате впячивания мембраны супероксид вместе с бактериальной клеткой оказываются в фагосоме. Супероксидный анион генерирует образование других токсичных молекул, включая Н2O2 и ОН•. Миелопероксидаза, содержащаяся в гранулах фагоцитирующих клеток, секретируется в фагосому, где образует НОСl.

Активные формы кислорода инициируют свободнорадикальные реакции, разрушающие липиды клеточных мембран поглощённых фагоцитами бактерий.
Наследственная недостаточность NADP-oкcидазы, обусловленная дефектом одного из генов этого ферментного комплекса, приводит к хроническому гранулематозу. В результате дефекта фермента фагоциты больных не способны продуцировать супероксидный кислородный радикал и пероксид водорода и поэтому не могут быстро разрушать фагоцитированные клетки бактерий и грибов. Некоторые устойчивые микроорганизмы остаются жизнеспособными внутри фагоцитов, и их антигены вызывают в месте скопления фагоцитов клеточный иммунный ответ и формирование гранулём. Наиболее часто встречается сцепленная с Х-хромосомой форма этого заболевания, связанная с дефектом гена одной из полипептидных цепей комплекса, локализованного на коротком плече Х-хромосомы.
Образование реакционноспособных метаболитов азота. Бактерицидное действие в макрофагах оказывает и оксид азота (NО). Оксид азота в этих клетках образуется, так же, как и в других, под действием фермента NО синтазы из аргинина (см. раздел 9). Активность NО синтазы в макрофагах заметно повышается при фагоцитозе в присутствии y-интерферона и фактора некроза опухолей. Супероксид- анион образует с NO соединения, обладающие большими бактерицидными свойствами, чем сам NO:
NO +O2- —> ОNOO- —> ОН• +NO2.
Пероксинитрил (ONOO-), оксид азота, диоксид азота, радикал гидроксила вызывают окислительное повреждение белков, нуклеиновых кислот и липидов бактериальных клеток. Оксид азота может непосредственно взаимодействовать с железосерными белками ЦПЭ, ингибируя дыхание и синтез АТФ в бактериях. При взаимодействии NO с O2образуются нитриты, которые превращаются в нитраты, также обладающие токсическим действием (см. раздел 12).
Вспышка метаболической активности нейтрофила заканчивается его гибелью. Погибшие нейтрофилы, макрофаги, бактерии и тканевая жидкость входят в состав гноя,
Действие кислороднезависимых бактерицидных механизмов. Некоторые грамположительные бактерии погибают в фагосомах нейтрофилов под действием лизосомального фермента лизоцима, который гидролизует связи между содержащимися в клеточной стенке 14- ацетилмурамовой кислотой и N-ацетил-D-глюкозамином и вызывает её разрушение.
В нейтрофилах человека обнаружены катионные пептиды — дефензины, содержащие около 30 аминокислотных остатков и богатые цистеином и аргинином. Они составляют от 30 до 50% всех белков гранул. Дефензины вызывают образование ионных каналов в мембране микробной клетки сразу же после образования фаголизосомы, и тем самым способствуют её уничтожению. Дефензины действуют и на обладающие оболочкой вирусы, например, вирус простого герпеса.
Таким образом, огромное разнообразие микроорганизмов, атакующих клетки человека, определило многообразие бактерицидных механизмов, действующих как в аэробных, так и анаэробных условиях.