БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 14. БИОХИМИЯ КРОВИ
IV. Белки плазмы крови
В плазме крови содержится 7% всех белков организма при концентрации 60 — 80 г/л. Белки плазмы крови выполняют множество функций. Одна из них заключается в поддержании осмотического давления, так как белки связывают воду и удерживают её в кровеносном русле.
✵ Белки плазмы образуют важнейшую буферную систему крови и поддерживают pH крови в пределах 7,37 — 7,43.
✵ Альбумин, транстиретин, транскортин, трансферрин и некоторые другие белки (табл. 14-2) выполняют транспортную функцию.
✵ Белки плазмы определяют вязкость крови и, следовательно, играют важную роль в гемодинамике кровеносной системы.
✵ Белки плазмы крови являются резервом аминокислот для организма.
✵ Иммуноглобулины, белки свёртывающей системы крови, α1-антитрипсин и белки системы комплемента осуществляют защитную функцию.
Методом электрофореза на ацетилцеллюлозе или геле агарозы белки плазмы крови можно разделить на альбумины (55 — 65%), α1-глобулины (2 — 4%), α2-глобулины (6 — 12%), β-глобулины (8 — 12%) и н-глобулины (12 — 22%) (рис. 14-19).
Рис. 14-19. Электрофореграмма (А) и денситограмма (Б) белков сыворотки крови.
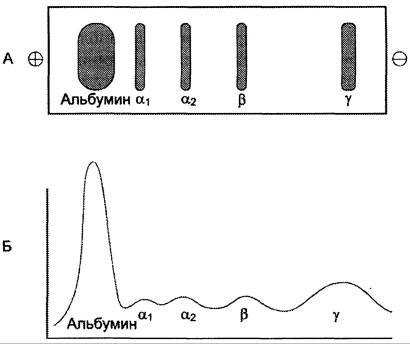
Применение других сред для электрофоретического разделения белков позволяет обнаружить большее количество фракций. Например, при электрофорезе в полиакриламидном или крахмальном гелях в плазме крови выделяют 16 — 17 белковых фракций. Метод иммуноэлектрофореза, сочетающий электрофоретический и иммунологический способы анализа, позволяет разделить белки плазмы крови более чем на 30 фракций.
Большинство сывороточных белков синтезируется в печени, однако некоторые образуются и в других тканях. Например, н-глобулины синтезируются В-лимфоцитами (см. раздел 4), пептидные гормоны в основном секретируют клетки эндокринных желёз, а пептидный гормон эритропоэтин — клетки почки.
Для многих белков плазмы, например, альбумина, α1-антитрипсина, гаптоглобина, трансферрина, церулоплазмина, α2-макроглобулина и иммуноглобулинов, характерен полиморфизм (см. раздел 4).
Почти все белки плазмы, за исключением альбумина, являются гликопротеинами. Олигосахариды присоединяются к белкам, образуя гликозидные связи с гидроксильной группой серина или треонина, или взаимодействуя с карбоксильной группой аспарагина. Концевой остаток олигосахаридов в большинстве случаев представляет собой N-ацетилнейраминовую кислоту, соединённую с галактозой. Фермент эндотелия сосудов нейраминидаза гидролизует связь между ними, и галактоза становится доступной для специфических рецепторов гепатоцитов. Путём эндоцитоза «состарившиеся» белки поступают в клетки печени, где разрушаются. Т1/2 белков плазмы крови составляет от нескольких часов до нескольких недель.
При ряде заболеваний происходит изменение соотношения распределения белковых фракций при электрофорезе по сравнению с нормой (рис. 14-20).
Рис. 14-20. Протеинограммы белков сыворотки крови. а — в норме; б — при нефротическом синдроме; в — при гипогаммаглобулинемии; г — при циррозе печени; д — при недостатке α1-антитрипсина; е — при диффузной гипергаммаглобулинемии.
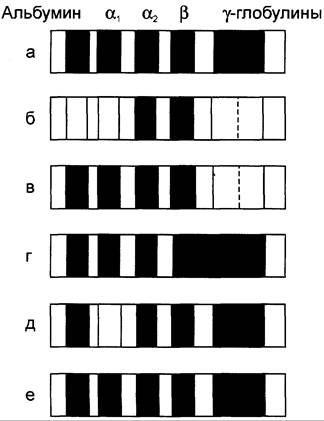
Такие изменения называют диспротеинемиями, однако их интерпретация часто имеет относительную диагностическую ценность. Например, характерное для нефротического синдрома снижение альбуминов, α1- и y-глобулинов и увеличение α2- и β-глобулинов отмечают и при некоторых других заболеваниях, сопровождающихся потерей белков. При снижении гуморального иммунитета уменьшение фракции y-глобулинов свидетельствует об уменьшении содержания основного компонента иммуноглобулинов — IgG, но не отражает динамику изменений IgA и IgM.
Содержание некоторых белков в плазме крови может резко увеличиваться при острых воспалительных процессах и некоторых других патологических состояниях (травмы, ожоги, инфаркт миокарда). Такие белки называют белками острой фазы, так как они принимают участие в развитии воспалительной реакции организма. Основной индуктор синтеза большинства белков острой фазы в гепатоцитах — полипептид интерлейкин-1, освобождающийся из мононуклеарных фагоцитов. К белкам острой фазы относят С-реактивный белок, называемый так, потому что он взаимодействует с С-полисахаридом пневмококков, α1-антитрипсин, гаптоглобин, кислый гликопротеин, фибриноген. Известно, что С-реактивный белок может стимулировать систему комплемента, и его концентрация в крови, например, при обострении ревматоидного артрита может возрастать в 30 раз по сравнению с нормой. Белок плазмы крови α1-антитрипсин может инактивировать некоторые протеазы, освобождающиеся в острой фазе воспаления.
Содержание некоторых белков в плазме крови и их функции представлены в таблице 14-2.
Таблица 14-2. Содержание и функции некоторых белков плазмы крови
Группа |
Белки |
Концентрация в сыворотке крови, г/л |
Функция |
Альбумины |
Транстиретин |
0,25 |
Транспорт тироксина и трийодтиронина |
Альбумин |
40 |
Поддержание осмотического давления, транспорт жирных кислот, билирубина, жёлчных кислот, стероидных гормонов, лекарств, неорганических ионов, резерв аминокислот |
|
α1-Глобулины |
α1-Антитрипсин |
2,5 |
Ингибитор протеиназ |
ЛПВП |
0,35 |
Транспорт холестерола |
|
Протромбин |
0,1 |
Фактор II свёртывания крови |
|
Транскортин |
0,03 |
Транспорт кортизола, кортикостерона, прогестерона |
|
Кислый α1-гликопротеин |
1 |
Транспорт прогестерона |
|
Тироксинсвязывающий глобулин |
0,02 |
Транспорт тироксина и трийодтиронина |
|
α2-Г лобулины |
Церулоплазмин |
0,35 |
Транспорт ионов меди, оксидоредуктаза |
Антитромбин III |
0,3 |
Ингибитор плазменных протеаз |
|
Гаптоглобин |
1 |
Связывание гемоглобина |
|
α2-Макроглобулин |
2,6 |
Ингибитор плазменных протеиназ, транспорт цинка |
|
Ретинолсвязывающий белок |
0,04 |
Транспорт ретинола |
|
Витамин D связывающий белок |
0,4 |
Транспорт кальциферола |
|
β-Глобулины |
ЛПНП |
3,5 |
Транспорт холестерола |
Трансферрин |
3 |
Транспорт ионов железа |
|
Фибриноген |
3 |
Фактор I свёртывания крови |
|
Транскобаламин |
25 x 10-9 |
Транспорт витамина В12 |
|
Глобулин связывающий белок |
20 x 10-6 |
Транспорт тестостерона и эстрадиола |
|
С-реактивный белок |
<0,01 |
Активация комплемента |
|
y-Глобулины |
IgG |
12 |
Поздние антитела |
IgA |
3,5 |
Антитела, защищающие слизистые оболочки |
|
IgM |
1,3 |
Ранние антитела |
|
IgD |
0,03 |
Рецепторы В-лимфоцитов |
|
IgE |
<0,01 |
Реагин |
Альбумин. Концентрация альбумина в крови составляет 40-50 г/л. В сутки в печени синтезируется около 12 г альбумина, Т1/2 этого белка — примерно 20 дней. Альбумин состоит из 585 аминокислотных остатков, имеет 17 дисульфидных связей и обладает молекулярной массой 69 кД. Молекула альбумина содержит много дикарбоновых аминокислот, поэтому может удерживать в крови катионы Са2+, Сu2+, Zn2+. Около 40% альбумина содержится в крови и остальные 60% в межклеточной жидкости, однако его концентрация в плазме выше, чем в межклеточной жидкости, поскольку объём последней превышает объём плазмы в 4 раза.
Благодаря относительно небольшой молекулярной массе и высокой концентрации альбумин обеспечивает до 80% осмотического давления плазмы. При гипоальбуминемии осмотическое давление плазмы крови снижается. Это приводит к нарушению равновесия в распределении внеклеточной жидкости между сосудистым руслом и межклеточным пространством. Клинически это проявляется как отёк. Относительное снижение объёма плазмы крови сопровождается снижением почечного кровотока, что вызывает стимуляцию системы ренин-ангиотензин-альдостерон, обеспечивающей восстановление объёма крови (см. раздел 11). Однако при недостатке альбумина, который должен удерживать Nа+, другие катионы и воду, вода уходит в межклеточное пространство, усиливая отёки.
Гипоальбуминемия может наблюдаться и в результате снижения синтеза альбуминов при заболеваниях печени (цирроз), при повышении проницаемости капилляров, при потерях белка из-за обширных ожогов или катаболических состояний (тяжёлый сепсис, злокачественные новообразования), при нефротическом синдроме, сопровождающемся альбуминурией, и голодании. Нарушения кровообращения, характеризующиеся замедлением кровотока, приводят к увеличению поступления альбумина в межклеточное пространство и появлению отёков. Быстрое увеличение проницаемости капилляров сопровождается резким уменьшением объёма крови, что приводит к падению АД и клинически проявляется как шок.
Альбумин — важнейший транспортный белок. Он транспортирует свободные жирные кислоты (см. раздел 8), неконъюгированный билирубин (см. раздел 13), Са2+, Сu2+, триптофан, тироксин и трийодтиронин (см. раздел 11). Многие лекарства (аспирин, дикумарол, сульфаниламиды) связываются в крови с альбумином. Этот факт необходимо учитывать при лечении заболеваний, сопровождающихся гипоальбуминемией, так как в этих случаях повышается концентрация свободного лекарства в крови. Кроме того, следует помнить, что некоторые лекарства могут конкурировать за центры связывания в молекуле альбумина с билирубином и между собой.
Транстиретин (преальбумин) называют тироксинсвязывающим преальбумином. Это белок острой фазы. Транстиретин относят к фракции альбуминов, он имеет тетрамерную молекулу. Он способен присоединять в одном центре связывания ретинолсвязывающий белок, а в другом — до двух молекул тироксина и трийодтиронина. Соединение с этими лигандами происходит независимо друг от друга. В транспорте последних транстиретин играет существенно меньшую роль по сравнению с тироксинсвязывающим глобулином.
α1-Антитрипсин относят к α1-глобулинам. Он ингибирует ряд протеаз, в том числе фермент эластазу, освобождающийся из нейтрофилов и разрушающий эластин альвеол лёгких. При недостаточности α1-антитрипсина могут возникнуть эмфизема лёгких (см. раздел 15) и гепатит, приводящий к циррозу печени. Существует несколько полиморфных форм α1-антитрипсина, одна из которых является патологической. У людей, гомозиготных по двум дефектным аллелям гена антитрипсина, в печени синтезируется α1-антитрипсин, который образует агрегаты, разрушающие гепатоциты. Это приводит к нарушению секреции такого белка гепатоцитами и к снижению содержания α1-антитрипсина в крови.
Гаптоглобин составляет примерно четверть всех α2-глобулинов. Гаптоглобин при внутрисосудистом гемолизе эритроцитов образует комплекс с гемоглобином, который разрушается в клетках РЭС. Если свободный гемоглобин, имеющий молекулярную массу 65 кД, может фильтроваться через почечные клубочки или агрегировать в них, то комплекс гемоглобин-гаптоглобин имеет слишком большую молекулярную массу (155 кД), чтобы пройти через гломерулы. Следовательно, образование такого комплекса предотвращает потери организмом железа, содержащегося в гемоглобине. Определение содержания гаптоглобина имеет диагностическое значение, например, снижение концентрации гаптоглобина в крови наблюдают при гемолитической анемии. Это объясняют тем, что при Т1/2 гаптоглобина, составляющем 5 дней, и Т1/2 комплекса гемоглобин-гаптоглобин (около 90 мин) увеличение поступления свободного гемоглобина в кровь при гемолизе эритроцитов вызовет резкое снижение содержания свободного гаптоглобина в крови.
Гаптоглобин относят к белкам острой фазы, его содержание в крови повышается при острых воспалительных заболеваниях.
Информация о некоторых других белках плазмы крови, представленных в табл. 14-2, имеется в соответствующих разделах учебника.