Підручник - БІОЛОГІЧНА ХІМІЯ - Губський Ю.І. - 2000
Розділ VI. БІОХІМІЯ ФІЗІОЛОГІЧНИХ ФУНКЦІЙ ТА СПЕЦІАЛІЗОВАНИХ ТКАНИН
ГЛАВА 28. БІОХІМІЯ І ПАТОБІОХІМІЯ КРОВІ
28.2. ДИХАЛЬНА ФУНКЦІЯ ЕРИТРОЦИТІВ. БІОХІМІЯ ТА ПАТОБІОХІМІЯ ГЕМОГЛОБІНУ
Гемоглобін: структура, властивості
Дихальна функція еритроцитів здійснюється за рахунок гемопротеїну гемоглобіну —білка з четвертинною структурою, що складається з чотирьох субодиниць (протомерів), кожен з яких містить поліпептидний ланцюг, зв’язаний з гемом через залишок гістидину. У молекулі гемоглобіну по два з чотирьох поліпептидних ланцюгів попарно однакові, його молекулярна маса 64,5 кД.
У крові дорослої людини основним типом гемоглобіну (до 96 % усього гемоглобіну еритроцитів) є форма, що містить два α- та два β-ланцюги, які складаються, відповідно, з 141 та 146 амінокислотних залишків. Умовна формула такого гемоглобіну дорослих (adult — англ.) позначається HbA1 = α2β2. Крім цієї форми, в крові міститься до 2 % гемоглобіну A2, формула якого HbA2= а2δ2, та 2-3 % ембріонального, або фетального гемоглобіну HbF = α2γ2.
Механізм участі гемоглобіну в транспорті кисню
Завдяки здатності приєднувати молекулу О2 при його високому парціальному тискові і віддавати — при низькому, молекула гемоглобіну виконує свою основну фізіологічну функцію транспортера кисню, приєднуючи його в капілярах альвеол легень рО2 дорівнює 90-100 мм рт. ст.) та віддаючи тканинам у венозних капілярах, де pО2 дорівнює 25-40 мм рт. ст.
Крива зв’язування гемоглобіном кисню та, відповідно, дисоціації оксигемоглобіну, має S-подібну форму, що свідчить про кооперативний характер процесу (рис. 28.1). Дійсно, приєднання молекули О2 до першої субодиниці гемоглобіну внаслідок конформаційних змін, що відбуваються, підвищує здатність гемопротеїну до взаємодії з подальшими трьома молекулами кисню. Таким чином, спорідненість гемоглобіну до четвертої молекули кисню майже в 300 разів вища, ніж до першої.
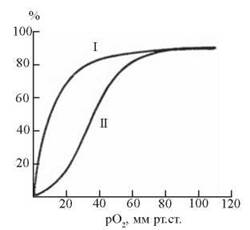
Рис. 28.1. Залежність ступеня оксигенації (% від максимальної) від парціального тиску О2 для гемоглобіну (II) та міоглобіну (I) — кисеньзв’язуючого білка м’язів, що не має кооперативних властивостей.
Ступінь оксигенації гемоглобіну (утворення НbO2) залежить від таких факторів:
- парціального тиску кисню;
- значення pH;
- концентрації діоксиду вуглецю;
- концентрації 2,3-дифосфогліцерату;
S-подібна кінетика залежності ступеня утворення HbO2 від парціального тиску
кисню та (відповідно) його концентрації в крові була розглянута вище. Зазначимо також, що вивільненню кисню з оксигемоглобіну в периферичних тканинах значною мірою сприяє градієнт його парціального тиску в напрямку альвеоли (100 мм рт. ст.) —► артеріальна кров (90 мм рт. ст.) —► венозна кров (40 мм рт. ст.) —► мітохондрії клітин (0-5 мм рт. ст.). Використання кисню вцитохромоксидазній реакції створює в мітохондріях «кисневий вакуум» (А.Я. Николаєв, 1998), завдяки якому клітини всмоктують атмосферний кисень.
Зв’язування гемоглобіном іонів H+ та СО2 зменшує здатність гему до взаємодії з киснем, тобто активність утворення HbO2. Цей негативний вплив зменшення pH та збільшення концентрації діоксиду вуглецю на утворення оксигемоглобіну має назву ефекту Бора. Молекулярні механізми ефекту Бора пов’язані з конформаційними змінами в молекулі гемопротеїну, шо відбуваються при його взаємодії із зазначеними лігандами.
2,3-Дифосфогліцерат — метаболіт, який має каталітичне значення для гліколізу, присутній в еритроцитах у концентрації 5 мМ, що наближається до еквімолекулярної концентрації з гемоглобіном. Важливою біохімічною функцією 2,3-дифосфогліцерату є його здатність зменшувати спорідненість гемоглобіну до кисню. Цей метаболіт зв’язується з молекулою гемоглобіну в деоксигенованій формі (Hb), протидіючи його взаємодії з O2, тобто утворенню HbO2. Таким чином, наявність в еритроцитах значної кількості 2,3-дифосфогліцерату є важливим регуляторним фактором, що сприяє вивільненню кисню з HbO2 в тканинній ділянці кровообігу.
Механізми транспорту діоксиду вуглецю від тканин до легенів
Крім транспорту молекул О2 від легенів до капілярів периферичних тканин, гемоглобін відіграє також суттєву роль у переносі від тканин до легенів СО2, який утворюється в клітинах у реакціях декарбоксилювання. Діоксид вуглецю, що надходить у кров через стінки тканинних капілярів, частково безпосередньо розчиняється в плазмі, але більша його частина утворює бікарбонати, які з током крові надходять до легенів. Оскільки гемоглобін має властивості кислоти (HHb), до того ж його кислотні властивості зростають при оксигенації (HHbO2), він здатен взаємодіяти з бікарбонатами (KHCO3) з утворенням вугільної кислоти (H2CO3), що і відбувається в легеневих капілярах; подальша дисоціація вугільної кислоти призводить до утворення вільного діоксиду вуглецю, який виділяється з легень у процесі зовнішнього дихання.
Процеси, що лежать в основі здатності гемоглобіну брати участь у транспорті СО2, описуються такими рівняннями реакцій:
1. В легеневих капілярах.
Оксигенація гемоглобіну, що збільшує його кислотні властивості (тобто ступінь дисоціації кислотних груп його білкової частини):
![]()
Взаємодія кислотної форми гемоглобіну з бікарбонатом калію, що надходить всередину еритроциту з плазми крові:
![]()
Розщеплення вугільної кислоти, що утворилась, під дією ферменту карбоангідрази:
![]()
2. В капілярах периферичних тканин.
Відщеплення кисню від калієвої солі оксигемоглобіну:
![]()
Утворення всередині еритроцитів вугільної кислоти з діоксиду вуглецю, що генерується за рахунок процесів декарбоксилювання:
![]()
Утворення в еритроцитах бікарбонату при взаємодії вугільної кислоти з калієвою сіллю гемоглобіну:
![]()
Бікарбонат (HCO3), що утворився в цій реакції, надходить з еритроциту в плазму крові (за рахунок іонного обміну з аніоном Cl-) і транспортується в легені (п.1).
Варіанти та патологічні форми гемоглобінів
Гемоглобіни A1, A2 та F є представниками множинних молекулярних форм гемоглобінів (ізобілками), що звичайно містяться в еритроцитах усіх здорових людей. Разом з тим, в результаті мутацій у генах, що контролюють синтез α- або (частіше) β-ланцюгів, можливе виникнення різноманітних варіантів (алелей) відповідних генів та поява в еритроцитах алельних варіантів гемоглобінів. Ці ізобілки розрізняються за амінокислотним складом певних поліпептидних ланцюгів (часто — заміною лише однієї амінокислоти в β-ланцюзі), за фізико- хімічними та функціональними властивостями, і головне — здатністю до транспорту кисню.
Патологічні стани, що розвиваються внаслідок наявності в крові варіантних або патологічних форм гемоглобінів із зміненими кисеньтранспортувальними властивостями, позначачаються як гемоглобінози.
За механізмом виникнення молекулярного дефекту гемоглобінози поділяють на гемоглобінопатії та таласемії. При гемоглобінопатіях молекулярний дефект полягає у змінах первинної структури поліпептидних ланцюгів, що формують α- або β-субодиниці молекул гемоглобіну (амінокислотні заміни, делеції або вставки) з утворенням аномальних форм гемоглобінів. Такі аномальні гемоглобіни позначають великими літерами латинського алфавіту або за містом, де був вперше виявлений даний дефект. Таласемії — це такі уроджені дефекти синтезу гемоглобінів, при яких у мутантних формах гемоглобінів взагалі відсутні α- або β-ланцюги. Клінічно гемоглобінози проявляються різними формами анемій, іноді несумісними з життям.
HbF (α2γ2) — фетальний гемоглобін — є основною молекулярною формою гемоглобіну людини під час внутрішньоутробного розвитку плода і зникає (замінюється на HbA) в перші 3 міс. після народження, тобто після переходу на легеневе дихання атмосферним киснем.
За своїми кисеньзв’язуючими властивостями HbF близький до міоглобіну; крива зв’язування кисню у фетального гемоглобіну є гіперболічною, тобто він не здатний до швидкої дисоціації з вивільненням O2 при зниженні парціального тиску кисню, подібно до HbA, та не чутливий до регулюючого впливу 2,3-ди- фосфогліцерату. В разі спадкового персистування HbF його концентрація в крові дорослої людини може бути збільшеною в 10-20 разів, що клінічно проявляється важкою гіпоксією внаслідок нездатності такого гемоглобіну до нормального транспорту кисню між артеріальною та венозною кров’ю.
HbS — мутантний гемоглобін, у β-ланцюгах якого в положенні 6 замість залишку глутамінової кислоти присутній залишок валіну. Ця молекулярна заміна (6Glu —► 6Val), зменшуючи негативний заряд молекули гемоглобіну, супроводжується зниженням його спорідненості до O2 та здатністю окремих молекул гемоглобіну злипатися між собою з утворенням ниткоподібних агрегатів. Такі міжмолекулярні агрегати змінюють форму еритроцитів, надаючи їм характерного серпоподібного вигляду — «серпоподібноклітинна анемія» (Sickle cell anemia — англ.). Серпоподібні еритроцити легко гемолізуються вже в судинному руслі, і клінічні прояви цієї хвороби варіюють від ледь помітних (гетерозиготна форма серпоподібноклітинної анемії) до тих, що спричиняють летальний кінець в ранньому віці (гомозиготні форми).
HbC — аномальний гемоглобін, у молекулі якого існує заміна залишку глутамінової кислоти в 6-му положенні β-ланцюга на лізин (6Glu —► 6Lys). Еритроцити, що містять такий аномальний гемоглобін, здатні до гемолізу, що також супроводжується розвитком анемії.
HbM — існує група гемоглобінів М, в поліпептидних ланцюгах яких залишок гістидину, що бере участь у зв’язуванні з залізом гему, заміщений на іншу амінокислоту. Зокрема, в гемоглобіні HbMБостон присутня заміна (α 58His —►58Tyt) в НbМСаскатон — заміна (β 63Hjs —► 63Tyt).
У гемоглобінах, що містять такий молекулярний дефект, атом заліза Fe3+ не може відновлюватися метгемоглобінредуктазою до Fe2+, у зв’язку з чим в еритроцитах накопичується метгемоглобін(містить Fe3+ у складі гему), що не здатний до нормального транспорту кисню. Така метгемоглобінемія найбільш виражена в гомозиготному стані, внаслідок чого хворі гинуть в умовах важкої гіпоксії.
HbA1C — глікозильований гемоглобін, який з’являється в еритроцитах за умов некомпенсованого цукрового діабету.
Таласемії — гемолітичні анемії, що розвиваються внаслідок утворення аномальних форм гемоглобінів, в глобіновій частині яких відсутній α- або β-поліпептидний ланцюг. Генетична основа таласемій полягає в ефекті мутацій, що зачіпають контрольні елементи (промотори або гени-регулятори), відповідальні за експресію певних структурних генів гемоглобіну.