Підручник - БІОЛОГІЧНА ХІМІЯ - Губський Ю.І. - 2000
Розділ VI. БІОХІМІЯ ФІЗІОЛОГІЧНИХ ФУНКЦІЙ ТА СПЕЦІАЛІЗОВАНИХ ТКАНИН
ГЛАВА 28. БІОХІМІЯ І ПАТОБІОХІМІЯ КРОВІ
28.4. БІОХІМІЧНИЙ СКЛАД КРОВІ В НОРМІ ТА ПАТОЛОГІЇ
Біохімічний склад крові у здорової людини є відносно постійним, що пояснюється наявністю в організмі потужних гомеостатичних систем (центральної нервової, ендокринної систем), які забезпечують сталість внутрішнього середовища за рахунок регуляторних механізмів, що протидіють суттєвим змінам у концентраціях основних метаболітів та зсувам у фізико-хімічних параметрах плазми й інших біологічних рідин. Разом з тим, склад біохімічних компонентів плазми крові в певний момент віддзеркалює будь-які зміни в метаболізмі клітин окремих органів та надходження біоорганічних сполук з навколишнього середовища, зокрема поживних речовин після їжі, що відразу призводить до включення зазначених регуляторних механізмів.
Яскравим прикладом фізіологічної регуляціі концентрації в плазмі крові глюкози, амінокислот та жирних кислот є постпрандіальне (після їжі) виділення β-клітинами підшлункової залози інсуліну та пригнічення секреції його антагоністів — контрінсулярних гормонів глюкагону, катехоламінів, гормону росту. Інсулін забезпечує підвищення проникності плазматичних мембран, зокрема м’язової та жирової тканини, для глюкози та певних амінокислот і стимулює анаболічні процеси, що призводять до активної внутрішньоклітинної утилізації зазначених біомолекул: індукцію ферментів синтезу глікогену у печінці та м’язах, синтезу тригліцеридів у печінці та адипоцитах, синтезу білків в печінці, м’язах та інших тканинах. Сукупність зазначених біохімічних перетворень призводить до нормалізації рівня глюкози та інших поживних метаболітів у плазмі крові до рівня, який спостерігався до прийняття їжі.
Хімічні компоненти, що входять до складу плазми крові, можна поділити на такі групи: білки плазми; небілкові органічні компоненти плазми (проміжні та кінцеві продукти метаболізму); неорганічні компоненти плазми.
Білки плазми крові
У плазмі крові міститься декілька десятків різних білків, що відрізняються за фізико-хімічними та функціональними властивостями: транспортні білки, ферменти, проферменти, інгібітори ферментів, гормони, антитіла, антитоксини, фактори коагуляції та антикоагулянти тощо. Загальна концентрація білків плазми крові людини складає 65-85 г/л, ця величина може змінюватися в бік зменшення (гіпопротеїнемія) у людей старечого віку та за умов патологічних станів, що супроводжуються пригніченням білкового синтезу та активацією розпаду тканинних білків (голодування; виснажливі інфекційні хвороби; стан після тяжких травм, оперативних втручань; кахексія при злоякісних новоутвореннях).
Кількість окремих фракцій білків, що виявляються в плазмі крові, залежить від методу їх поділу (паперовий, гелевий електрофорез, зокрема електрофорез у поліакриламідному гелі, імуноелектрофорез тощо). За умов поширеного в клінічній практиці паперового електрофорезу білки плазми поділяються на п’ять фракцій: альбуміни (сироваткові альбуміни), α1-глобуліни, α2-глобуліни, β-глобуліни та γ-глобуліни. Біохімічні характеристики основних білків плазми крові людини подано в таблиці 28.1.
Таблиця 28.1. Основні фракції білків плазми крові людини
Білки |
Концентрація, г/л |
Молекулярна маса |
Сироваткові альбуміни |
40-50 |
66-69 кД |
Глобуліни (загальна кількість) |
20-40 |
|
α1-глобуліни |
3-6 |
40-60 кД |
α2-глобуліни |
4-9 |
100-400 кД |
β-глобуліни |
6-11 |
110-120 кД |
γ-глобуліни |
7-15 |
150-200 кД |
Фібриноген |
1,5-3,5 |
1340 кД |
Протромбін |
0,1 |
69-70 кД |
Альбуміни (сироваткові альбуміни) — багатодисперсна фракція білків плазми, які характеризуються високою електрофоретичною рухомістю та легкою розчинністю у воді та сольових розчинах. Завдяки високій гідрофільності альбуміни зв’язують значну кількість води, і об’єм їх молекули за умов гідратації збільшується вдвічі. Гідратаційний шар, який утворюється навкруги молекул сироваткових альбумінів, забезпечує до 70-80 % онкотичного тиску білків плазми крові, що може застосовуватися в клінічній практиці при переливанні хворим із тканинними набряками розчинів альбуміну. В свою чергу, зменшення концентрації альбумінів сироватки, наприклад за умов порушення їх синтезу в гепатоцитах при печінковій недостатності, може спричиняти перехід води із судинного русла до тканин і розвиток онкотичних набряків.
Альбуміни виконують також важливу фізіологічну функцію як транспортери багатьох метаболітів та інших низькомолекулярних сполук. Молекули альбумінів мають декілька доменів з центрами зв’язування для молекул органічних лігандів, що приєднуються за рахунок електростатичних та гідрофобних зв’язків. За рахунок таких взаємодій сироваткові альбуміни можуть приєднувати та транспортувати жирні кислоти, холестерин, жовчні пігменти (білірубін тощо), вітаміни, гормони, деякі амінокислоти, фенол та інші токсичні та лікарські сполуки.
Глобуліни — гетерогенна фракція білків крові, що виконують транспортні (α1-глобуліни — транспорт ліпідів, тироксину, кортикостероїдних гормонів; α2-глобуліни — транспорт ліпідів, іонів міді; β-глобуліни — транспорт ліпідів, вільного та гемового заліза) та захисні (участь β-глобулінів в імунних реакціях як антитоксинів; γ-глобуліни як фракція імуноглобулінів) функції.
У клінічній практиці застосовується визначення співвідношення між концентраціями альбумінів та глобулінів у плазмі крові (так званого «білкового коефіцієнта»), що складає в середньому 1,5-2,0.
Імуноглобуліни крові. Імуноглобуліни (IgA, IgG, IgE, IgM) — білки γ-глобулінової фракції плазми крові, що виконують функцію антитіл, основних ефекторів гуморального імунітету. Структура та функції імуноглобулінів будуть докладно розглянуті в главі 30.
Значний клінічний інтерес викликають окремі білки плазми крові глікопротеїнової природи, зокрема компоненти системи неспецифічної резистентності організму — С-реактивний протеїн, кріоглобулін, сироваткові інгібітори протеїназ, фібронектин, білки системи комплементу, а також транспортні білки — гаптоглобін, трансферин, церулоплазмін.
С-реактивний білок (С-реактивний протеїн — СРП) — білок, що отримав свою назву внаслідок здатності реагувати з С-полісахаридом пневмокока, утворюючи при цьому преципітати. За хімічною природою є глікопротеїном.
У сироватці крові здорової людини С-реактивний білок відсутній, та з’являється при патологічних станах, що супроводжуються запаленням та некрозом тканин, зокрема він був вперше виявлений при крупозній пневмонії. Наявність СРП характерна для гострого періоду захворювань — «білок гострої фази». Визначення СРП має діагностичне значення в гострій фазі ревматизму, при інфаркті міокарда, пневмококових, стрептококових, стафілококових інфекціях.
Кріоглобулін — білок γ-глобулінової фракції, що, подібно до С-реактивного протеїну, відсутній у плазмі крові здорових людей і з’являється в ній при лейкозах, лімфосаркомі, мієломі, ревматизмі, цирозі печінки, нефрозах. Характерною фізико-хімічною ознакою кріоглобуліну є його розчинність при нормальній температурі тіла (37 °С) та здатність утворювати желеподібні осади при охолодженні плазми крові до 4 °С.
α2-Макроглобулін — білок α2-глобулінової фракції, універсальний сироватковий інгібітор протеїназ, вміст якого в крові найвищий, порівняно з іншими протеїназними інгібіторами, складаючи в середньому 2,5 г/л. α2-Макроглобулін є глікопротеїном з молекулярною масою 725 кД.
Інгібіторна активність α2-макроглобуліну виявляється відносно більшості природних протеїназ усіх чотирьох каталітичних класів: серинових, тіолових, карбокси- та металопротеїназ. У комплексі з цим інгібітором протеїнази втрачають каталітичну активність щодо високомолекулярних білків, але зберігають здатність гідролізувати низькомолекулярні пептиди. Біологічна роль α2-макроглобуліну полягає в регуляції систем тканинного протеолізу, які мають важливе значення в таких фізіологічних та патологічних процесах, як згортання крові, фібриноліз, процеси імунітету, функціонування системи комплементу, реакції запалення, регуляція судинного тонусу (кінінова та ренін-ангіотензинова системи).
α1-Антитрипсин (α1-протеїназний інгібітор) — глікопротеїн з молекулярною масою 55 кД, концентрація якого в плазмі крові складає 2-3 г/л. Основною біологічною властивістю цього інгібітора є його здатність утворювати комплекси з протеїназами, пригнічуючи при цьому протеолітичну активність таких ферментів, як трипсин, хімотрипсин, плазмін, тромбін та протеаз, що вивільняються при руйнуванні лейкоцитів або чужорідних клітин у вогнищах запалення.
В умовах запального процесу вміст (α1-антитрипсину в крові значно збільшується за рахунок стимуляції його синтезу в гепатоцитах. Велике значення має інгібіторна активність α1-антитрипсину також за умов некрозу підшлункової залози при гострих панкреатитах, що супроводжуються надходженням у тканини та біологічні рідини активних панкреатичних протеїназ. Уроджена недостатність α1-антитрипсину проявляється розвитком уже в молодому віці емфіземи легень внаслідок розщеплення тканинним трипсином міжальвеолярних перетинок.
Фібронектин — глікопротеїн плазми крові, який синтезується та секретується в міжклітинний простір багатьма клітинами. Фібронектин присутній на поверхні клітин, на базальних мембранах, у сполучній тканині та в крові. Фібронектин має властивості «липкого» білка, що зв’язується з вуглеводними угрупованнями сіалогліколіпідів (гангліозидів) на поверхні плазматичних мембран, виконуючи інтегруючу функцію у міжклітинній взаємодії. Крім того, за рахунок утворення комплексів з колагеновими фібрилами, фібронектин відіграє значну роль в організації перицелюлярного матриксу.
Гаптоглобін — білок α2-глобулінової фракції плазми крові. Гаптоглобін має здатність зв’язувати вільний гемоглобін, утворюючи комплекс, що входить до електрофоретичної фракції β-глобулінів. Нормальна концентрація в плазмі крові — 0,10-0,35 г/л.
У складі гаптоглобін-гемоглобінового комплексу гемоглобін поглинається клітинами ретикуло-ендотеліальної системи, зокрема в печінці, та підлягає окисленню до жовчних пігментів. Така функція гаптоглобіну сприяє збереженню в організмі за умов фізіологічного та патологічного розпаду еритроцитів іонів заліза, що входять до складу гемоглобіну. Надходження гемоглобіну до сечі (гематурія) спостерігається лише при значних кровотечах.
Трансферин (сидерофілін) — глікопротеїн β-глобулінової фракції, його молекулярна маса — 80 кД. Трансферин зв’язує в плазмі крові іони заліза (Fe3+). Білок має на своїй поверхні два центри зв’язування заліза, яке вступає в комплекс із трансферином разом з аніоном гідрокарбонату.
Трансферин — це транспортна форма заліза, що доставляє його до місць депонування та використання. Зокрема, трансферин акцептує іони Fe3+, що надходять у кров після їх всмоктування в кишечнику, та передає залізо на тканинний феритин, у складі якого залізо депонується в печінці, селезінці, кістковому мозку та інших органах. Концентрація трансферину в плазмі крові — близько 4 г/л.
Церулоплазмін — глікопротеїн α2-глобулінової фракції, що зв’язує в плазмі крові іони міді. Молекула церулоплазміну містить 8 іонів Cu+ та 8 іонів Cu2+, його молекулярна маса — близько 150 кД.
До складу церулоплазміну входить до 3 % усього вмісту міді в організмі та більше 90 % міді плазми. Церулоплазмін має властивості мідьвмісної фероксидази, окислюючи залізо з ферро-(Fe2+) до ферри-(Fe3+) форми. Ця реакція є необхідною для перетворення заліза в іонну форму, яка може зв’язуватися феритином і таким чином використовуватися для синтезу залізовмісних білків (гемоглобіну, цитохромів). Зниження вмісту церулоплазміну в плазмі крові (хвороба Вільсона) призводить до виходу іонів міді з судинного русла і його накопичення протеогліканами сполучної тканини, що проявляється патологічними змінами в печінці, головному мозку (гепатоцеребральна дегенерація), рогівці тощо.
Ферменти плазми крові
У крові присутня значна кількість ферментних білків, які поділяють на власні ферменти крові та ферменти, що потрапляють до плазми крові з клітин інших органів, тканин або біологічних секретів.
До власних ферментів плазми крові належать різні протеази, фосфатази, есте- рази, зокрема компоненти згортальної та антизгортальної систем крові, ферменти, що беруть участь в імунних процесах, активації системи комплементу та інших реакціях неспецифічної резистентності організму тощо. До другої групи належать ферменти, що надходять у кров в результаті всмоктування соку підшлункової залози, слини (трипсин, амілаза, ліпаза) та ферменти, які проникають у кров за рахунок підвищення проникності плазматичних мембран різних органів — печінки, міокарда, нирок, хребцевої мускулатури тощо. Ця група ферментів, що отримала назву індикаторних, має суттєве клініко-діагностичне значення, засвідчуючи про патологічні ушкодження мембран гепатоцитів (аланін-амінотрансфераза), міокарда (аспартат-амінотрансфераза, креатинфосфокіназа) тощо.
Калікреїн-кінінова система
Кініни — низькомолекулярні пептиди, що містяться в крові та інших біологічних рідинах та тканинах, беручи участь у регуляції судинного тонусу (розширення судин), процесів мікроциркуляції, запаленні, алергічних реакціях.
Основними кінінами крові є нонапептид брадикінін та декапептид калідин:
Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe-Arg
Брадикінін
Lys-Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe-Arg
Калідин (лізилбрадикінін)
Кініни синтезуються з білків кініногенів за участю протеїназ калікреїнів, що вирізають у молекулах кініногенів специфічні нона- або декапептидні фрагменти. В свою чергу, калікреїн плазми крові знаходиться в неактивному стані у формі прекалікреїну, який перетворюється в активний фермент за участю серинової Прекалікреїн протеїнази — фактора ХП згортальної системи крові.
Період напівжиття кінінів плазми крові незначний (20-30 с). Руйнування кінінів здійснюється за рахунок дії ферментів кініназ, що розщеплюють пептидні зв’язки у молекулах кінінів, спричиняючи втрату їх біологічної активності.
Схему утворення та розщеплення кінінів плазми крові подано на рис. 28.2:
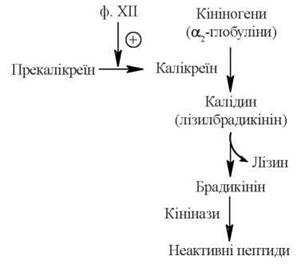
Рис. 28.2. Кінінова система плазми крові.
Кініни розслаблюють гладенькі м’язи кровоносних судин, спричиняючи зниження кров’яного тиску, а також розширення судин мікроциркуляторного русла в ділянках запалення. Брадикінін є найбільш потужною судинодилятуючою речовиною в організмі. Крім того, внутрішньотканинне утворення кінінів у зоні запалення спричиняє підвищення проникності судинних стінок, почуття болю.
У зв’язку із значною роллю кінінів у патогенезі запальних процесів, у клінічній практиці широко застосовуються лікарські засоби, що є інгібіторами кініноутворення (Контрикал, Гордокс тощо).
Небілкові органічні сполуки плазми крові
Азотовмісні сполуки
Органічний азот біохімічних сполук, що його можна визначити в надосадовій рідині після осадження білків плазми або сироватки крові, отримав у клінічній біохімії назву залишкового, або рест-азоту(RN). Цей небілковий азот складається з азоту таких кінцевих продуктів білкового та нуклеїнового катаболізму, як сечовина, амінокислоти, вільні нуклеотиди, сечова кислота, креатин, креатинін та деякі інші сполуки. Концентрацію в плазмі крові основних азотовмісних небілкових сполук плазми крові подано в таблиці. 28.2.
Таблиця 28.2. Небілкові азотовмісні компоненти плазми крові
Компонент |
Концентрація, г/л |
Сечовина |
0,2-0,3 |
Амінокислоти |
3,5-6,5 |
Сечова кислота |
2-6 |
Креатинін |
1-2 |
Загальна концентрація залишкового (рест-азоту) в плазмі крові здорових людей складає 20-40 мг % (0,2-0,4 г/л). Різке збільшення цього показника — гіперазотемія, зокрема за рахунок зростання азоту сечовини, спостерігається найбільш часто за умов порушення азотовидільної функції нирок, що має місце при гострій або хронічній нирковій недостатності.
Безазотисті сполуки
До безазотистих хімічних компонентів плазми крові належать вуглеводи, ліпіди, органічні кислоти, що є метаболітами обміну речовин (молочна, піровиноградна, ацетооцтова кислоти, метаболіти трикарбонового циклу).
Вуглеводи плазми крові. У плазмі крові містяться, переважно, моносахариди, головним чином глюкоза (в концентрації натщесерце — 65-119 мг %, або 3,58-6,05 ммоль/л) та фруктоза, галактоза і деякі пентози (рибоза, дезоксирибоза). Основні продукти гліколізу містяться в плазмі крові у концентраціях: молочна кислота — 8-17 мг %, піровиноградна кислота — 0,4-2,5 мг %.
Ліпіди плазми крові. Загальна концентрація ліпідів у плазмі крові людини коливається залежно від режиму і якості харчування та конституційних особливостей організму (віку, статі), складаючи в середньому 5-7 г/л. У фізіологічних умовах загальна кількість ліпідів крові може збільшуватися до 10-15 г/л після вживання їжі, багатої на жири (аліментарна гіперліпемія).
Найбільшу кількість серед ліпідів плазми крові становлять сполуки таких класів (А.Н. Клімов, 1980):
- тригліцериди — 0,5-1,9 г/л;
- фосфоліпіди — 1,1-2,75 г/л;
- холестерин загальний — 1,5-2,6 г/л;
- холестерин етерифікований — 1,0-2,1 г/л;
- жирні кислоти (неетерифіковані) — 0,08-0,2 г/л.
Ліпіди як гідрофобні сполуки не здатні знаходитися у вільному (розчинному) стані в плазмі крові, яка з фізико-хімічної точки зору є водно-сольовим розчином. Стабілізаторами ліпідів плазми є спеціальні білки (апопротеїни, або аполіпопротеїни), що сприяють утворенню ліпопротеїнових міцел, у складі яких різні класи ліпідів можуть транспортуватися кров’ю. Існує п’ять класів апопротеїнів (A,B,C,D,E), що в певних кількісних співвідношеннях входять до складу різних ліпопротеїнів (глава 16).
Розрізняють такі транспортні форми ліпопротеїнів плазми:
- хіломікрони (1-2,5 г/л) — основна транспортна форма триацилгліцеролів;
- ліпопротеїни дуже низької щільності (ЛПДНЩ), або пре-β-ліпопротеїни (1,3-2,0 г/л) — містять значну кількість триацилгліцеролів, а також фосфоліпіди та холестерин;
- ліпопротеїни низької щільності (ЛПНЩ), або β-ліпопротеїни (2,1-4,0 г/л) — основна транспортна форма холестерину; зростання концентрації в крові ЛПНЩ сприяє проникненню холестерину в ендотелій і утворенню атеросклеротичної бляшки, що є фактором ризику розвитку атеросклерозу;
- ліпопротеїни високої щільності (ЛПВЩ), або α-ліпопротеїни (0,2-0,25 г/л) — містять значну кількість фосфоліпідів, а також холестерин та триацилгліцероли; ЛПВЩ розглядаються як «антиатерогенні» ліпопротеїни, що сприяють виходу холестерину із судинної стінки.
Підвищення концентрації в плазмі крові різних класів ліпопротеїнів (гіперліпопротеїнемії) свідчить про серйозні зміни ліпідного обміну, найчастіше пов’язані з певними генетичними порушеннями. Відомо п’ять основних типів гіперліпопротеїнемій, що залежать від дефектів у ферментних системах розщеплення або перетворення певних ліпопротеїнів (типи I, II, III, IV, V) та можуть проявлятися раннім розвитком атеросклерозу, ожирінням, ксантоматозом, захворюваннями печінки, нирок, зниженням толерантності до глюкози.
Неорганічні компоненти плазми
Основними неорганічними компонентами плазми крові є катіони електролітів — кальцію (2,5 ммоль/л), натрію (140 ммоль/л), калію (5 ммоль/л), інших мінеральних елементів (переважно заліза, міді), мікроелементів — та аніони бікарбонатів, хлоридів, фосфатів, сульфатів, йодидів.