Підручник - БІОЛОГІЧНА ХІМІЯ - Губський Ю.І. - 2000
Розділ VI. БІОХІМІЯ ФІЗІОЛОГІЧНИХ ФУНКЦІЙ ТА СПЕЦІАЛІЗОВАНИХ ТКАНИН
ГЛАВА 33. БІОХІМІЯ НЕРВОВОЇ СИСТЕМИ. МОЛЕКУЛЯРНА ПСИХОБІОЛОГІЯ
33.2. НЕЙРОМЕДІАТОРИ. РЕЦЕПТОРИ ДЛЯ НЕЙРОМЕДІАТОРІВ І ФІЗІОЛОГІЧНО АКТИВНИХ СПОЛУК
Нейромедіатори (нейротрансмітери) — біомолекули, які забезпечують передавання імпульсів (хімічних сигналів) у нервовій системі з одного нейрона на інший, а також з нейрона на ефекторний орган.
За хімічною природою нейромедіатори поділяють на такі сполуки (F. Hucho, 1986): ацетилхолін, біогенні аміни (катехоламіни — норадреналін, дофамін, серотонін), амінокислоти та їх похідні (γ-аміномасляна кислота — ГАМК, гліцин, глутамат, аспартат), пептиди — нейропептиди (ендорфіни, енкефаліни, сполука P тощо). Медіаторні функції в нервовій системі можуть також виконувати пролін, таурин, β-аланін, аденозин, простагландини.
Рецептори нейромедіаторів — мембранні білки (здебільшого — глікопротеїни), що локалізовані в постсинаптичних мембранах нейронів або плазматичних мембранах клітин ефекторних органів і здатні до зв’язування фізіологічних ефекторів (нейромедіаторів, різних ФАС, психотропних сполук) і передавання зовнішньоклітинного хімічного сигналу всередину нейрона.
За принципами молекулярної організації та функціонування, рецептори нейромедіаторів — це, здебільшого, іонотропні рецептори (рецептори І класу), тобто такі, що контролюють відкриття іонних каналів на мембрані для Са2+, Na+ і К+; в ролі первинних ефекторів, що передають хімічний сигнал на нервову клітину, в цьому разі виступають компоненти іонних каналів (глава 23). Крім того, в фізіологічних ефектах деяких нейромедіаторів та нейромодуляторів (зокрема, нейропептидів головного мозку, ацетилхоліну та деяких біогенних амінів) беруть участь і метаботропні рецептори (рецептори II класу), які активують внутрішньоклітинні біохімічні системи шляхом утворення цАМФ або цГМФ, включенням фосфоінозитидної системи та/або збільшенням цитозольної концентрації іонів Са2+. Крім нейромедіаторів, із зазначеними типами рецепторів можуть взаємодіяти численні лікарські засоби, нейротоксини, що активують (агоністи) або гальмують, блокують (антагоністи) або модулюють біохімічні, нейрофізіологічні та психологічні (поведінкові) ефекти, опосередковані збудженням специфічних рецепторів певних зон головного мозку.
Характеристика окремих нейромедіаторів
Ацетилхолін — похідне холіну й оцтової кислоти, є найбільш поширеним нейромедіатором. Його синтез і розщеплення відбуваються в холінергічних центрах (структурах) центральної та периферичної нервової системи. В синтезі ацетилхоліну бере участь фермент холінацетилтрансфераза:
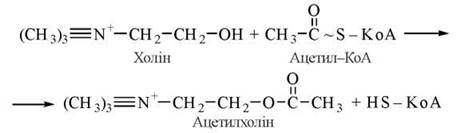
Подібно до інших нейромедіаторів (зокрема, катехоламінів), синтез ацетилхоліну відбувається в нервових закінченнях, а збереження — в спеціальних синаптичних везикулах. Вивільнення медіатора в синаптичну щілину відбувається внаслідок збудження нейрона дискретними порціями («квантами») за механізмом екзоцитозу синаптичних везикул. Безпосереднім біохімічним сигналом, що активує процеси виходу ацетилхоліну через пресинаптичну мембрану, є підвищення всередині нервового закінчення іонів Са2+. Ацетилхолін, що вивільнився, реагує з рецепторними структурами постсинаптичної мембрани — холінорецепторами (ХР) (рис. 33.1).
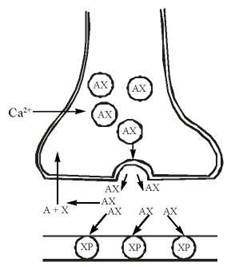
Рис. 33.1. Схема будови холінергічного синапсу.
Розщеплення медіатора в синаптичній щілині здійснюється ферментом ацетилхолінестеразою (АХ-естеразою).
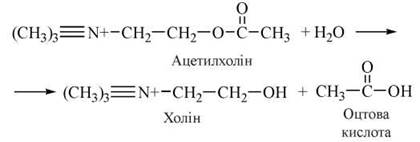
Залежно від молекулярної будови, фізіологічних і фармакологічних властивостей, зокрема вибіркової (селективної) чутливості до специфічних агоністів і антагоністів, виділяють два основні типи (та декілька субтипів) холінергічних рецепторів:
- м-холінорецептори (м-ХР) — такі, що вибірково збуджуються токсином грибів мускарином;
- н-холінорецептори (н-ХР) — такі, що вибірково збуджуються алкалоїдом тютюну — нікотином.
м-ХР локалізовані в постсинаптичних мембранах клітин ефекторних органів та в ділянках закінчень парасимпатичних нервових волокон. Ці рецептори належать до метаботропного типу. Внутрішньоклітинні ефекти їх збудження реалізуються за рахунок підвищення цитозольної концентрації Са2+, який активує Са2+-залежну гуанілатциклазу, що призводить до генерації цГМФ, яка опосередковує дію агоністів м-ХР на цГМФ-залежні біохімічні системи відповідних мішеней.
н-ХР локалізовані в постсинаптичних мембранах гангліонарних клітин, що контактують із закінченнями парасимпатичних і симпатичних прегангліонарних волокон. Це рецептори іонотропноготипу, стимуляція яких ацетилхоліном, нікотином та іншими агоністами супроводжується зростанням проникності клітинних мембран (н-холінергічних синапсів нервової системи, нервово-м’язової платівки) до іонів Са2+, Na+ та K+. Такий ефект активації н-ХР зумовлений їх внутрішньомембранною організацією, яка є надмолекулярним комплексом з п’яти білкових субодиниць (α2, β, γ, δ), що оточують іонний канал, який пронизує ліпідний бішар мембрани (рис. 33.2).
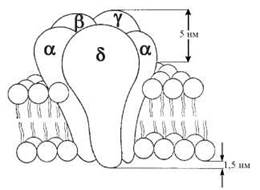
Рис. 33.2. Модель внутрішньомембранної організації н-холінорецептора.
Важливе фармакологічне й токсикологічне значення мають фізіологічно активні сполуки, що є інгібіторами АХ-естерази, спричиняючи значне підвищення концентрації нейромедіатора як в структурах центральної нервової системи, так і в організмі в цілому.
Зворотні інгібітори АХ-естерази — сполуки, які застосовуються в медичній практиці з метою збільшення активності холінергічної імпульсації, порушеної при певних неврологічних захворюваннях (міастенії тощо), атонії кишечника, сечового міхура. Із зазначеною метою застосовуються такі препарати: Прозерин, Фізостигмін, Галантамін.
Незворотні інгібітори АХ-естерази — сполуки, що є потужними нервовими отрутами, які спричиняють різке збудження нервової системи із судомами, порушенням функцій серцево-судинної, гастро-інтестинальної та інших фізіологічних систем організму. Найбільш поширеними незворотніми інгібіторами АХ-естерази є фосфорорганічні сполуки (ФОС), які сполучаються ковалентним зв’язком із гідроксильною групою серину в активному центрі ферменту, протидіючи таким чином його взаємодії з субстратом (глава 7).
ФОС знайшли надзвичайно широке застосування в сільському господарстві та побуті як пестициди для боротьби зі шкідливими комахами — хлорофос, дихлофос, метафос, карбофос тощо. Спрямований синтез ФОС, які є високотоксичними для теплокровних тварин, призвів до створення нервово-паралітичних отрут, що були прийняті на озброєння військовими силами багатьох країн як бойові отруйні речовини (БОР). Найбільш відомими БОР із класу фосфорорганічних сполук є такі речовини, як табун, зарин, зоман.
Норадреналін — біогенний амін, що разом із адреналіном і дофаміном належить до катехоламінів. На відміну від адреналіну, який проявляє, в основному, гормональну активність, норадреналін є медіатором, що відіграє трансмітерну роль в адренергічних синапсах центральної та периферичної нервової системи.
У головному мозку людини норадренергічні нейрони знаходяться, переважно, в зонах блакитної плями (Locus coeruleus), гіпокампу та значній частині кори мозку. Функціональну роль норадреналіну як одного з основних медіаторів центральної нервової системи пов’язують із підтриманням рівня активності нервово-психічних реакцій, формуванням когнітивних та адаптивних процесів.
Адренорецептори широко розповсюджені як у нервовій системі, так і в інших органах і тканинах. Існують декілька підтипів адренорецепторів: α1, α2, β1 та β2, що розрізняються за своїми біохімічними, фізіологічними та фармакологічними властивостями.
Взаємодія лігандів (норадреналіну, адреналіну тощо) із β-адренорецепторами (β1 та β2-) супроводжується активацією аденілатциклази, збільшенням внутрішньоклітинної концентрації цАМФ і через систему цАМФ-залежних протеїнкіназ — стимуляцією відповідних метаболічних процесів та фізіологічних функцій клітини; прикладом таких реакцій є стимуляція адреналіном глікогенолізу в печінці та м’язах і ліполізу в жировій тканині.
На відміну від β-адренорецепторів, стимуляція різних підтипів α-адренорецепторів включає принципово інші молекулярні механізми:
- стимуляція α1-адренорецептрів підвищує цитозольну концентрацію іонів Са2+ за рахунок його транспорту всередину клітин і вивільнення з внутрішніх депо, що призводить до активації Са-залежних реакцій клітини;
- стимуляція α2-адренорецепторів шляхом взаємодії ліганд-рецепторного комплексу з трансдукуючим інгібіторним білком мембрани (Ni) супроводжується гальмуванням активності аденілатциклази і відповідною перебудовою цДМФ-залежних біохімічних процесів.
У центральній нервовій системі адренорецептори локалізовані як на постсинаптичних мембранах(α1-адренорецептори), забезпечуючи передачу нервового сигналу на нейрон або ефекторний орган, так і на пресинаптичних мембранах (переважно α2-адренорецептори), гальмуючи за негативним зворотним зв’язком вивільнення норадреналіну в синаптичну щілину.
Норадреналін має складні біохімічні та функціональні зв’язки на пре- та постсинаптичному рівнях з іншими нейромедіаторами та модуляторами функцій центральної нервової системи — ацетилхоліном, серотоніном, дофаміном, нейропептидами тощо.
Дофамін — катехоламін із медіаторними властивостями, що виконує ряд важливих фізіологічних функцій у центральній і периферичній нервовій системі. Дофамін має слабку симпатоміметичну активність і бере участь у регуляції поведінки, рухової сфери, діяльності серцево-судинної системи, кишечника, нирок.
Дофамінові рецептори
Розрізняють декілька типів (D1, D2, D3, D4) та субтипів дофамінових рецепторів, що розрізняються чутливістю до лігандів та характером біохімічних і фізіологічних реакцій клітин, які настають після їх активації.
Активація D1-рецепторів супроводжується збільшенням активності дофамінчутливої аденілатциклази з наступним включенням цАМФ-залежного каскаду біохімічних реакцій.
Активація D2-рецепторів призводить до зменшення активності аденілатциклази, внутрішньоклітинної концентрації кальцію та пригнічення відповідних цАМФ- і Са-залежних метаболічних і фізіологічних процесів.
Із порушенням обміну дофаміну та функцій дофамінових рецепторів пов’язані розвиток шизофренії, алкоголізму, депресивних станів, хвороби Паркінсона та інших екстрапірамідних порушень. На функціонування дофамінергічних структур головного мозку людини впливають численні психотропні та нейротропні лікарські засоби, що отримали широке застосування в клінічній практиці.
Серотонін — біогенний амін, що є похідним триптофану (5-окситриптамін, 5-hydroxytryptamine — 5-HT). Серотонін має надзвичайно широкий спектр біологічної активності відносно до центральної, периферичної нервової системи, інших органів і тканин.
У центральній нервовій системі людини серотонін виконує функції медіатора для спеціальних серотонінергічних нейронів і модулятора дії інших нейротрансмітерів. Рецептори серотоніну розподіляються на окремі типи: 5-НТ1, 5-НТ2, 5-НТ3, 5-НТ4 та підтипи (зокрема, 5-НТ1A, 5-НТ1В, 5-НТ1С), які диференціюються за чутливістю до агоністів і антагоністів. Серотонінові рецептори належать до II класу (метаботропних), але розрізняються за характером біохімічних реакцій, що супроводжують їх стимуляцію:
- збудження 5-НТ1-рецепторів призводить (через GTP-зв’язуючий N-білок трансдуктор) до активації серотонін-чутливої аденілатциклази і зростання рівня цАМФ;
- збудження 5-НТ2-рецепторів супроводжується зростанням у цитозолі концентрації іонів кальцію (за рахунок їх вивільнення з внутрішньоклітинних депо) та активацією Са-залежних біохімічних процесів.
Фізіологічна роль серотоніну в головному мозку людини розглядається в зв’язку з регуляцією таких психоемоційних реакцій, як тривога, неспокій, агресивність, імпульсивні потяги, сексуальна поведінка, контролем циклів фізіологічного сну тощо, що дозволило визначити серотонін як «нейромедіатор гарного самопочуття».
Порушення обміну серотоніну та функцій серотонінових рецепторів впливають на патогенез депресивних і неспокійних станів, шизофренії, алкоголізму, наркоманій. Так, зокрема, дефіцит серотоніну в головному мозку та спинномозковій рідині виявлений у хворих із важкими станами депресії, що здійснювали суїцидальні акти (самогубства) (H.I. Kaplan, B.J. Sadock, 1994). Потяг до етилового алкоголю в експериментальних щурів залежить від функції серотонінових рецепторів, локалізованих у лімбічній системі. ФАС, що впливають на серотонінергічну передачу імпульсів, зокрема інгібітори зворотного синаптичного захоплення (реаптейку — reuptake, англ.) 5-HT зменшують споживання експериментальними тваринами алкоголю (W. Kostowski, 1995). Відповідно до зазначеного, модуляція фізіологічних і біохімічних ефектів серотоніну є основою фармакологічних ефектів багатьох психотропних і нейротропних препаратів.
Нейромедіатори — амінокислоти та їх похідні
Амінокислотні нейромедіатори поділяють на два класи:
1) збуджувальні кислі амінокислоти;
2) гальмівні нейтральні амінокислоти.
Збуджувальні амінокислоти
До амінокислот із властивостями нейромедіаторів належать «збуджувальні амінокислоти» — L-глутамат і L-аспартат, обміну яких надається серйозна увага в патології нервової системи, патопсихології та психофармакології. Встановлена наявність у клітинах головного мозку як іонотропних, так і метаботропних рецепторів збуджувальних амінокислот.
Іонотропні рецептори збуджувальних амінокислот поділяють на такі підкласи:
- рецептори, що активуються, крім глутамату й аспартату, також NMDA (N-метил-Б-аспартатом) — NMDA-рецептори;
- рецептори, що активуються глутаматом, а також AMPA (DL-α-аміно-3-гідрокси-5-метил-4-ізоксалонопропіоновою кислотою) та каїнатом — AMPA/каїнатні рецептори.
Активація NMDA-рецепторів призводить до надходження в клітину екстрацелюлярного кальцію шляхом відкриття кальцієвих каналів.
Активація AMPA/каїнатних рецепторів супроводжується деполяризацією мембран нейронів за рахунок відкриття NA+-каналів; ця деполяризація, в свою чергу, призводить до відкриття потенціал-залежних Са2+-каналів і збільшення внутрішньоклітинної концентрації Са2+.
Метаботропні рецептори збуджувальних амінокислот активуються глутаматом. Активація рецепторів цього типу призводить через G-білок-трансдуктор до стимуляції обміну фосфоінозитидів та утворення інозитолтрифосфату (Са2+) і діацилгліцеролу — внутрішньоклітинних месенджерів, що призводять до росту концентрації Са2+ і за рахунок його мобілізації з внутрішньоклітинних депо.
Надходження в постсинаптичний нейрон Са2+ внаслідок збудження іонотропних (NMDA- або AMPA/каїнатних) рецепторів спричиняє довготривалу потенціацію міжнейронної передачі, що створює нейрофізіологічні передумови для процесів навчання, пам’яті, становлення індивідуальних форм поведінки.
Модуляції системи рецепторів збуджувальних амінокислот надається значна роль у розумінні біохімічних механізмів дії антипаркінсоничних, антиепілептичних, міорелаксантних лікарських засобів.
Гальмівні амінокислоти
До цього класу нейромедіаторів належать γ-аміномасляна кислота — ГАМК (γ-амінобутират; 4-амінобутират), гліцин, таурин, β-аланін.
Найбільш вивченим гальмівним нейромедіатором є ГАМК. Ця амінокислота, взаємодіючи з відповідними селективними рецепторами (ГАМК-рецепторами), пригнічує міжнейронну передачу нервових імпульсів. Біохімічний механізм гальмівної дії ГАМК полягає в активації входу через мембрану нейронів іонів Cl-, що відбувається внаслідок взаємодії ГАМК із хлорними каналамимембрани.
Відповідно до зазначених нейрофізіологічних властивостей ГАМК, агоністи ГАМК-рецепторів та сполуки, що потенціюють гальмівні ефекти ГАМК, виявляють протисудомні, заспокоювальні (транквілізуючі) та седативні ефекти. Навпаки, антагоністи ГАМК, які зменшують гальмівну активність ГАМК-ергічних нейронів (пікротоксин, бікукулін), є потужними конвульсантами. Судомна активність препарату стрихніну зумовлена його антагоністичною дією відносно гліцинових рецепторів спинного мозку, які також сполучені з хлорними каналами мембран.
Нейропептиди — широкий клас сполук пептидної природи, що синтезуються переважно в клітинах центральної нервової системи, складаючи її пептидергічну систему, і здатні суттєво впливати на біохімічні та нейрофізіологічні процеси в головному мозку.
Опіоїдні пептиди
Найбільшу увагу в молекулярній психобіології та фармакології привертають нейропептиди, що є ендогенними лігандами морфінових (опіатних) рецепторів мозку — опіоїдні пептиди. Опіоїдні пептиди, подібно до наркотичного анальгетика морфіну і близьких до нього сполук, мають найбільш сильно виражену знеболювальну (анальгетичну) активність і специфічну дію на головний мозок людини, що проявляється розвитком складного психоемоційного стану ейфорії з покращанням настрою, відчуттям душевного комфорту, позитивним сприйняттям довкілля (Д.А. Харкевич, 1993).
Основними представниками опіоїдних нейропептидів є: метіонін (мет-)-енкефалін, лейцин (лей-)енкефалін, α-, β-, γ- та δ-ендорфіни («ендогенні морфіни»), α- та β-неоендорфіни, динорфіни A та B.
Як очевидно з наведених первинних структур, опіоїдні нейропептиди мають гомологічні послідовності амінокислотних залишків (1-4(5) в енкефалінах і ендорфінах та 1-16 у всіх ендорфінах). Це свідчить про єдність у структурі генів (послідовностей нуклеотидів ДНК), що кодують ці пептиди. Безпосереднім попередником енкефалінів та ендорфінів є білок проопіомеланокортин, шляхом часткового гідролізу якого утворюються не тільки нейропептиди, а й такі гормональні сполуки, як кортикотропін та в-ліпотропін (глава 24).
Рецептори опіоїдних пептидів
Подібно до інших мембранних рецепторів для нейромедіаторів, опіатні рецептори поділяють на декілька субтипів: μ-(мю-)рецептори, δ-(дельта)-рецептори, χ-(каппа-) рецептори, σ-(сигма-)рецептори, ε-(епсилон-)рецептори. Найбільш високу щільність опіатних рецепторів виявлено в лімбічній зоні головного мозку — еволюційно прадавній структурі, що відповідає за процеси емоційного збудження, прояви ейфоричних та емоційно-позитивних компонентів дії як нейропептидів, так і опіатних наркотиків із класу морфіну.
Біохімічні механізми функціонування опіатних рецепторів включають у себе вплив утвореної ліганд-рецепторної системи на обмін внутрішньоклітинних месенджерів — цАМФ та іонів Ca2+, що визначає безпосередні фізіологічні ефекти дії того чи іншого нейропептиду.