Підручник - БІОЛОГІЧНА ХІМІЯ - Губський Ю.І. - 2000
Розділ II. ЗАГАЛЬНІ ЗАКОНОМІРНОСТІ МЕТАБОЛІЗМУ
ГЛАВА 6. ФЕРМЕНТИ I. СТРУКТУРА, ВЛАСТИВОСТІ
6.3. ХІМІЧНА СТРУКТУРА ФЕРМЕНТІВ. КОФЕРМЕНТИ
А. Будова ферментних білків
За хімічною структурою ферменти є простими білками або складними білками (тобто такими, що містять у собі небілкову частину).
Білкова частина складного білка-ферменту має назву апофермент (апоензим), небілкова — кофермент (коензим) — див. нижче. Повна назва складного ферменту — холофермент:
![]()
Олігомерні білки-ферменти
Багато ферментних білків складаються з декількох субодиниць (протомерів), що являють собою різні поліпептидні ланцюги, сполучені нековалентними зв’язками — олігомерні ферменти.
Найбільш розповсюджені олігомерні ферменти, що містять у собі два (С2), чотири (С4) або шість (С6) протомерів. Окрім ферментів, що складаються з однакових за хімічною природою протомерів, існують ферменти, до складу яких входять різні за будовою та біохімічними функціями субодиниці. Наприклад, фермент аспартат-карбамоїлтрансфераза складається з шести каталітичних та шести регуляторних субодиниць (С6R6). Приклади деяких білків-ферментів, що мають олігомерний склад, були наведені в таблиці 2.1.
У клітині, особливо в складі біологічних мембран, деякі ферменти здатні утворювати поліферментні (мультиензимні) комплекси (системи), що каталізують послідовності спряжених біохімічних реакцій. Такі поліферментні комплекси складаються з декількох десятків фізично асоційованих білків-ферментів, кожен з яких каталізує певну реакцію. Розрізняють (рис. 6.1):
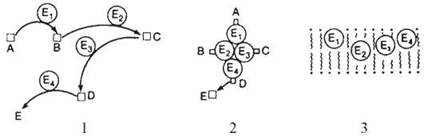
Рис. 6.1. Типи мультиензимних систем в клітині.
1. Розчинні мультиензимні системи, в яких відсутня постійна асоціація між ферментами Е1, Е2, Е3, Е4; відбувається дифузія субстратів A, B, C, D між окремими ферментами.
2. Мультиензимні системи, в яких окремі ферменти сполучені між собою нековалентними зв’язками, утворюючи комплекси, які полегшують передавання субстратів та продуктів між окремими ферментними білками.
3. Мембрано-зв’язані мультиензимні системи, в яких окремі ферменти асоційовані з ліпідним бішаром субклітинних органел (мітохондрій, ендоплазматичного ретикулума тощо).
Прикладом мультиензимних систем може бути піруватдегідрогеназний комплекс, виділений із мітохондрій та E. Coli. Зокрема, піруватдегідрогеназний комплекс E. Coli, що має м.м. 4,0 · 106, складається з 24 молекул ферментного білка піруватдегідрогенази (м.м. — 90 кД; із кожною молекулою білка зв’язаний тіаміндифосфат — ТДФ), молекули дигідроліпоїлтрансацетилази (яка складається з 24 протомерів — окремих поліпептидних ланцюгів із м.м. 36 кД; кожен ланцюг містить залишок ліпоєвої кислоти) та 12 молекул дигідроліпоїлдегідрогенази (м.м. — 55 кД; кожна молекула сполучена з ФАД).
Ізоферменти
Ізоферменти (ізозими) — множинні молекулярні форми одного й того ж ферменту. Ізоферменти каталізують одну й ту ж біохімічну реакцію, але розрізняються за своєю первинною структурою і, відповідно, фізико-хімічними (молекулярною масою, рухомістю при електрофорезі тощо) та каталітичними (різною спорідненістю ферменту із субстратом — Km) властивостями.
Різні ізоферменти одного й того ж ферменту можуть бути присутніми в різних органах і тканинах (ізоферменти лактатдегідрогенази), субклітинних структурах (мітохондріальний та цитозольний ізоферменти ізоцитратдегідрогенази).
Ізоферменти належать до більш широкого класу ізобілків — множинних молекулярних форм певного білка, що зустрічаються в різних організмах в межах одного біологічного виду і є результатами експресії різних генетичних локусів або алеломорфами — продуктами одного локусу. В разі, якщо фермент, що представлений ізоферментними формами, має олігомерну будову, його ізоферменти формують за рахунок різних комбінацій неідентичних протомерів. Прикладом такого ізоферментного сімейства можуть бути ізоферменти лактатдегідрогенази (ЛДГ-аза) — ферменту, що каталізує обернену реакцію перетворення піровиноградної кислоти в молочну:
![]()
За своєю молекулярною будовою ЛДГ-аза є тетрамером, що побудований із протомерів двох типів: Н («серцевого» — heart, англ.) та М («м’язового» — muscle). В організмі людини присутні п’ять комбінацій зазначених протомерів, які створюють різні ізоферменти ЛДГ-ази: ЛДГ1(Н4), ЛДГ2(Н3М), ЛДГ3(Н2М2), ЛДГ4(НМ3) та ЛДГ5(М4), що розподілені переважно в різних органах (міокарді, печінці, скелетних м’язах, нирках тощо). Ці ізоферменти розрізняються за своєю електрофоретичною рухомістю та їх визначення в сироватці крові хворих має діагностичне значення для виявлення пошкоджень мембранних структур, що спостерігаються при різних захворюваннях (інфаркті міокарда, гепатиті тощо).
Б. Кофактори та коферменти
Кофактори
Багато ферментів потребують для реалізації своєї каталітичної активності наявності певних низькомолекулярних небілкових сполук — кофакторів. Роль кофакторів можуть відігравати біоорганічні сполуки різної хімічної природи або іони металів (Mg2+, Ca2+, Fe3+- Fe2+, Cu2+ - Cu1+ т.і.).
Іони металів зв’язані з апоферментом або входять до складу небілкової простетичної групи (див. нижче) — найчастіше порфіринового кільця гемінових ферментів (цитохромів, пероксидаз, каталази). Ферменти, які міцно зв’язані з іонами металів і не втрачають цього зв’язку за умов виділення та фракціонування ферменту, назваються металоферментами (табл. 6.1).
Таблиця 6.1. Металоферменти та відповідні метали-кофактори
Металоферменти |
Іони металів |
Аргіназа |
Mn2+ |
Алкогольдегідрогеназа |
Zn2+ |
Карбоангідраза |
Zn2+ |
Карбоксипептидаза А |
Zn2+ |
Супероксиддисмутаза |
Zn2+, Cu2+ |
Ксантиноксидаза |
Mo6+ |
Цитохром с |
Fe2+ |
Цитохроми (a + a3) |
Fe2+, Cu+ |
У деяких випадках іони металів не входять до складу ферментів як інтегральні структурні компоненти, а виконують лише функцію їх активаторів.
Коферменти (коензими) — біорганічні сполуки небілкової природи, що є необхідними для дії ферменту, тобто перетворення субстрату в каталітичному акті.
Коферменти можуть сполучатися з білковою частиною (апоферментом) нековалентними фізико-хімічними або ковалентними зв’язками (в останньому випадку вони є простетичними групами ферментного білка — флавінові коферменти, піридоксальфосфат, ліпоєва кислота тощо); деколи коферменти утворюють комплекси з апоферментом лише в ході каталітичного процесу (НАД, НАДФ).
Класифікація коферментів
А. За хімічною природою коферменти підрозділяють на:
- похідні вітамінів, зокрема: вітаміну В1 — тіаміндифосфат; вітаміну В2 — флавінмононуклеотид (ФМН); вітаміну В6 — піридоксальфосфат, піридоксамінфосфат; пантотенової кислоти — коензим А; вітаміну В12 — метилкобаламін, дезоксиаденозилкобаламін; вітаміну Н (біотину) — карбоксибіотин; фолієвої кислоти — тетрагідрофолієва кислота;
- динуклеотиди (похідні нікотинаміду — НАД+, НАДФ+; похідний рибофлавіну — ФАД);
- нуклеотиди — похідні пуринів та піримідинів (АТФ, АДФ, ЦТФ, ЦДФ, УТФ, УДФ);
- комплекси порфіринів з іонами металів.
Б. За типом реакції, яку вони каталізують, коферменти поділяють на:
1. Коферменти, що є переносниками атомів водню та електронів.
2. Коферменти, що є переносниками різних хімічних груп.
3. Коферменти синтезу, ізомеризації та розщеплення вуглець-вуглецевих зв’язків.
Таблиця 6.2. Коферменти та ферментативні реакції, в яких вони беруть участь
Коферменти |
Біоорганічна сполука, похідним якої є кофермент |
Тип реакції, що каталізується коферментом |
1. Переносники водню та електронів: |
||
НАД (нікотинамідаденіндинуклеотид) |
Вітамін РР (нікотинова кислота, нікотинамід) |
Перенос гідрид-іону (:Н-) -«- Перенос атомів водню (2Н+ + 2е-) -«- Перенос атомів водню (2Н+ + 2е-) Перенос водню в пероксидазних та редуктазних реакціях Перенос електронів |
НАДФ (нікотинамідаденіндинуклеотидфосфат) ФАД (флавінаденіндинуклеотид) ФМН (флавінмононуклеотид) |
-«- |
|
Вітамін В2 (рибофлавін) -«- |
||
Коензим Q Глутатіон Гемінові коферменти |
Убіхінон |
|
Трипептид: γ-глутамінілцистеїніл-глшин Металопорфірини |
||
2. Переносники інших хімічних груп: |
||
Нуклеозидфосфати: |
||
АТФ (аденозинтрифосфат) АДФ (аденозиндифосфат) УТФ (уридинтрифосфат) УДФ (уридиндифосфат) ЦТФ (цитидинтрифосфат) ЦДФ (цитидиндифосфат) Піридоксалеві коферменти: Піридоксальфосфат Піридоксамінфосфат Коензим ацилювання (КоА; КоА-SH) Тетрагідрофолієва кислота (ТГФК) Ліпоєва кислота |
Аденозин -«- Уридин -«- Цитидин -«- Вітамін В6 (піридоксин) Вітамін В3 (пантотенова кислота) Вітамін Вс (фолієва кислота) Тіооктова кислота |
Перенос фосфатних, пірофосфатних, аденозильних радикалів -«- Перенос моносахаридних радикалів -«- Перенос холіну та етаноламіну -«- Перенос аміногруп; декарбоксилювання Перенос ацильних радикалів Перенос одновуглецевих радикалів (формільного, оксиметильного, метильного) Перенос ацетильних радикалів |
3. Коферменти синтезу, ізомеризації та розщеплення вуглець-вуглецевих зв’язків: |
||
Тіаміндифосфат (ТДФ) |
Вітамін В1 (тіамін) |
Окисне декарбоксилювання оксо(α-кето)-кислот; перенос кето-фрагментів |
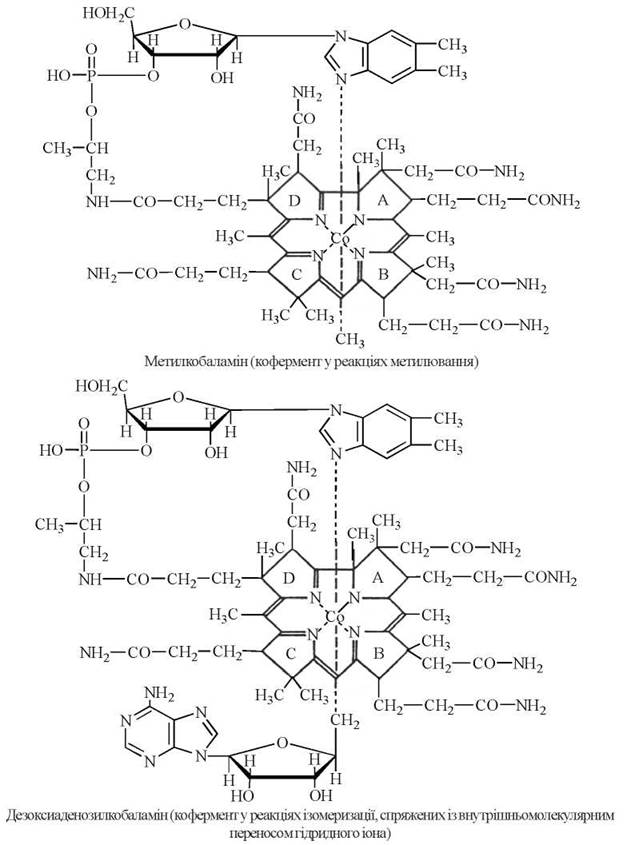
Кобамідні коферменти: |
Вітамін В12 (кобаламін) |
|
Метилкобаламін |
Реакції трансметилювання |
|
5-Дезоксиаденозилкобаламін |
Реакції ізомеризації |
|
Карбоксибіотин |
Вітамін Н (біотин) — похідне тіофену |
Реакції карбоксилювання за участю СО2 |
Структура найбільш поширених коферментів.
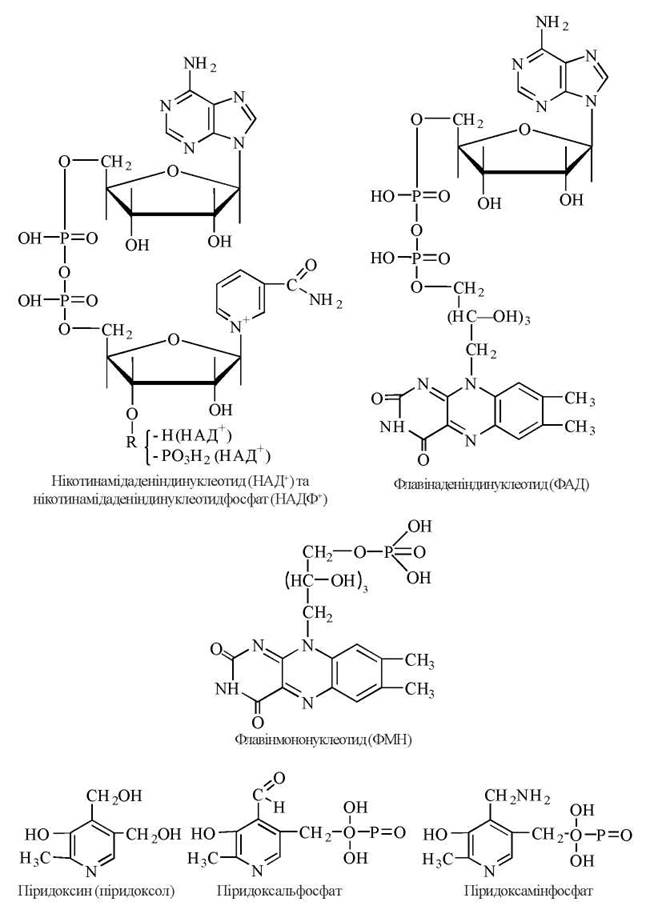
Коферменти — похідні вітаміну РР (нікотинаміду) (входять до складу дегідрогеназ): нікотинамідаденіндинуклеотид (НАД+) та нікотинамідаденіндинуклеотидфосфат (НАДФ+).
Коферменти — похідні вітаміну В2 (рибофлавіну) (входять до складу дегідрогеназ та оксидаз): флавінаденіндинуклеотид (ФАД), флавінмононуклеотид (ФМН).
Піридоксалеві коферменти — похідні вітаміну В6 (піридоксину) (входять до складу амінотрансфераз, декарбоксилаз): піридоксин (піридоксол), піридоксальфосфат, піридоксамінфосфат.
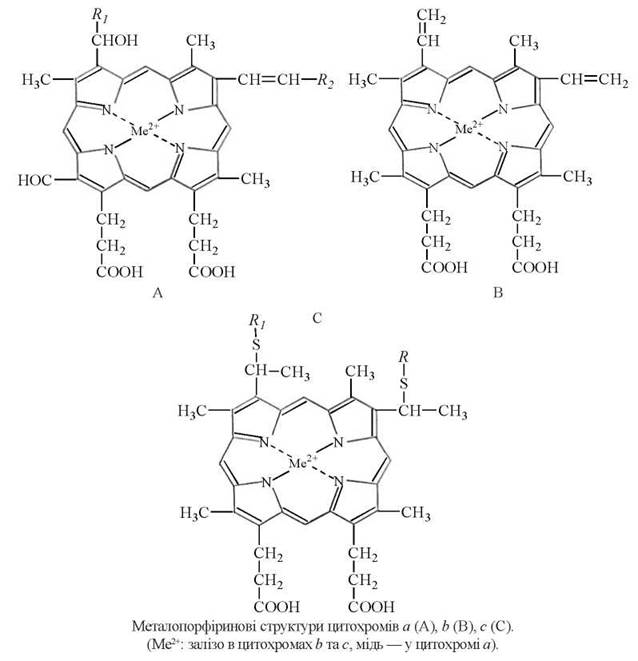
Металопорфірини — коферменти цитохромів: металопорфіринові структури цитохромів a (A), b (B), c (C). (Me2+: залізо в цитохромах b та c, мідь — у цитохромі a).
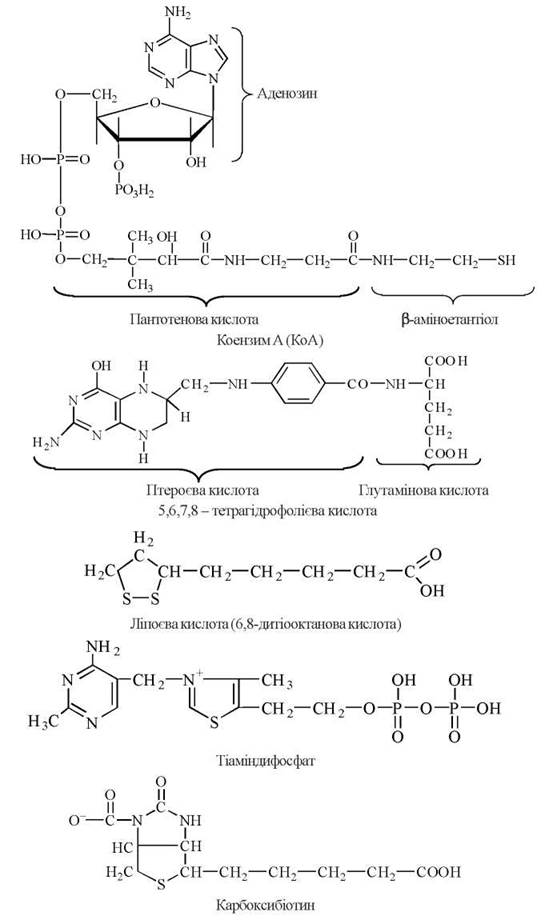
Кофермент ацилювання — похідний пантотенової кислоти: коензим А (КоА).
Коферменти — похідні фолієвої кислоти (коферменти в реакціях переносу та оксидоредукції одновуглецевих радикалів): 5,6,7,8-тетрагідрофолієва кислота.
Ліпоєва кислота (кофермент у реакціях окислювального декарбоксилювання α-кетокислот): ліпоєва кислота (6,8-дитіооктанова кислота).
Тіаміндифосфат — похідний вітаміну В1 (кофермент у реакціях декарбоксилювання α-кетокислот, транскетолазній реакції): тіаміндифосфат.
Кофермент карбоксибіотин (кофермент реакцій карбоксилювання): карбоксибіотин.
Коферменти — похідні вітаміну В12. метилкобаламін (кофермент у реакціях метилювання), дезоксиаденозилкобаламін (кофермент у реакціях ізомеризації, спряжених із внутрішньомолекулярним переносом гідридного іона).