Підручник - БІОЛОГІЧНА ХІМІЯ - Губський Ю.І. - 2000
Розділ II. ЗАГАЛЬНІ ЗАКОНОМІРНОСТІ МЕТАБОЛІЗМУ
ГЛАВА 7. ФЕРМЕНТИ II. МЕХАНІЗМИ КАТАЛІЗУ. КІНЕТИКА. РЕГУЛЯЦІЯ
7.3. РЕГУЛЯЦІЯ ФЕРМЕНТАТИВНИХ ПРОЦЕСІВ. ЕНЗИМОПАТІЇ
Упорядкований перебіг біохімічних реакцій в організмі можливий лише за умов присутності каталітично активних форм ферментів у потрібний час і в потрібному місці (в тканині, клітині, субклітинному компартменті), що вимагає наявності чіткої системи регуляції (контролю) діяльності ферментів. Крім того, будь-які зміни оточуючого або внутрішнього середовища (характеру харчування, інтенсивності впливу на організм біологічних, хімічних та фізичних факторів) потребують спрямованих адаптаційних реакцій різних фізіологічних систем, що реалізується через зміни швидкостей певних метаболічних процесів, які каталізуються ферментами.
Існують два принципових шляхи регуляції інтенсивності, або швидкості біохімічних ферментативних реакцій:
А — через зміну каталітичної активності ферменту.
Б — через зміну кількості ферменту (або ферментів), що визначають перебіг ферментативного процесу.
А. Перший шлях регуляції передбачає наявність у ферментному пулі клітини спеціальних регуляторних ферментів, які містяться звичайно на головних, ключових ланках метаболізму. Цей шлях забезпечує термінову адаптацію ферментного апарату організму і реалізується протягом декількох секунд або хвилин — механізм «швидкого реагування».
Існують чотири основних механізми регуляції каталітичної активності ферментів (L. Stryer, 1995):
1. Алостерична регуляція активності ферментів.
2. Регуляція активності ферментів за рахунок їх ковалентної модифікації.
3. Активація ферментів шляхом обмеженого протеолізу.
4. Активація та гальмування активностей ферментів за допомогою особливих регуляторних білків.
Алостеричні ферменти
Алостеричні ферменти — це різновид регуляторних ферментів, що, крім активного центру, мають додатковий регуляторний (алостеричний) центр, з яким взаємодіють алостеричні регулятори (ефектори, модулятори).
Алостеричні ефектори можуть бути як позитивними, тобто такими, що збільшують каталітичну активність ферменту (алостеричні активатори), так і негативними, тобто такими, що її гальмують (алостеричні інгібітори).
За своєю молекулярною будовою алостеричні регуляторні ферменти складаються, як правило, з декількох поліпептидних ланцюгів, тобто мають четвертинну структуру. Активний та регуляторний (алостеричний) центри локалізуються на різних білкових субодиницях — каталітичній та регуляторній, відповідно. Модифікація каталітичної активності такого ферменту здійснюється шляхом передачі на каталітичні субодиниці конформаційних змін із регуляторних субодиниць, які відбуваються в останніх після взаємодії з лігандами — ефекторами.
Згідно з моделлю Ж. Моно, Дж. Уаймена, Ж .-П. Шанжьо (J. Monod, J. Wyman, J-P. Changeux, 1965) (рис. 7.11), існують два фізичних стани алостеричного ферменту, що відрізняються своєю конформацією та каталітичною активністю: каталітичний (релаксований) стан (R-стан — relaxed, англ.) та інгібірований (напружений) стан (T-стан — tensed, англ.) (рис. 7.11).
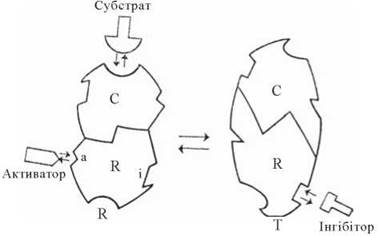
Рис. 7.11. Перехід між каталітично активною (R) та неактивною (Т) формами алостеричного ферменту (модель Monod-Wyman-Changeux). C і R — каталітична і регуляторна субодиниці, відповідно.
Зворотний перехід між R- та T-станами залежить від взаємодії ферменту з алостеричними ефекторами (активатором або інгібітором, відповідно), які, взаємодіючи з місцями зв’язування на регуляторній субодиниці ферменту, стабілізують його молекулу в одному з конформаційних станів.
Кінетика алостеричних ферментів
Кінетика алостеричних ферментів має ряд відмінностей від кінетики звичайних ферментів. Крива залежності швидкості реакції від концентрації субстрату для цих ферментів має не гіперболічну, а S-подібну (сигмоподібну) форму, що визначається кооперативними ефектами взаємодії між окремими субодиницями регуляторного ферменту під час зв’язування молекул субстрату: при низьких концентраціях субстрат практично не перетворюється, лише після досягнення концентрацією певного порогового значення, швидкість реакції починає стрімко зростати (рис. 7.12).
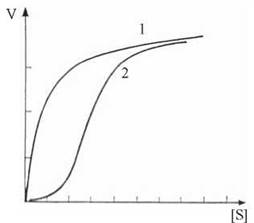
Рис. 7.12. Вплив концентрації субстрату на швидкість реакції для звичайного (1 — гіперболічна крива) та алостеричного (2 — S-подібна крива) ферментів.
Алостеричні ферменти каталізують біохімічні реакції, що знаходяться, як правило, на початку нерозгалужених або розгалужених метаболічних шляхів. При цьому модуляторами цих ферментів можуть бути як їх власні субстрати — гомотропні регуляторні ферменти, так і інші хімічні ефектори, зокрема кінцеві продукти багатоступеневого біохімічного процесу — гетеротропні регуляторні ферменти. В останньому випадку продукт (або продукти) метаболічного шляху (звичайно анаболічного, біосинтетичного характеру) за механізмом негативного зворотного зв’язку гальмує активність першого ферменту послідовності — ретроінгібірування:
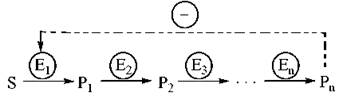
Класичним прикладом ферменту з алостеричним механізмом регуляції є аспартаткарбамоїлтрансфераза (АКТ-аза) — перший фермент біосинтетичного шляху утворення піримідинів, що синтезуються у вигляді таких нуклеозидтрифосфатів, як уридинтрифосфат (УТФ) та цитидинтрифосфат (ЦТФ):
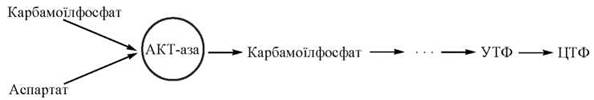
Враховуючи роль піримідинів як компонентів нуклеотидів ДНК та РНК і деяких коферментів, регуляція каталітичної активності АКТ-ази має надзвичайно велике біологічне значення. У зв’язку з цим, існує чітка система контролю за їх кількістю, яка реалізується шляхом впливу алостеричних ефекторів на активність першого ферменту цього біосинтетичного шляху — АКТ-ази:
ЦТФ — кінцевий продукт біосинтезу — є алостеричним інгібітором АКТ-ази, що переводить фермент у неактивну Т-форму;
АТФ — продукт біосинтезу пуринів та показник високого енергетичного стану клітини — є алостеричним активатором ферменту, що переводить його в активну R-форму.
За своєю молекулярною будовою АКТ-аза є типовим регуляторним ферментом, що складається із шести регуляторних та каталітичних субодиниць (R6C6), які утворюють білок із четвертинною структурою (рис. 7.13).
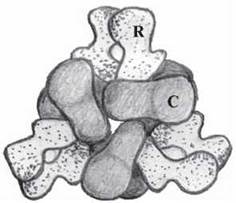
Рис. 7.13. Четвертинна структура аспартаткарбамоїлтрансферази — вигляд зверху. С — каталітичні, R — регуляторні субодиниці.
Кінетика субстратної залежності швидкості АКТ-азної реакції подана на рис. 7.14. Додавання алостеричного активатора (АТФ) зсуває кінетичну криву вліво, інгібітора (ЦТФ) — вліво.
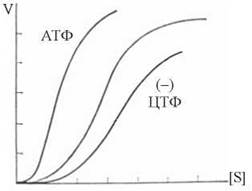
Рис. 7.14. Кінетичні криві АКТ-ази в присутності АТФ та ЦТФ.
Ковалентна модифікація ферментів
Постсинтетична ковалентна модифікація ферментних білків є одним із поширених механізмів контролю за перебігом метаболічних процесів. Шляхами такої модифікації є зворотне фосфорилювання-дефосфорилювання (найбільш поширений механізм регуляції), метилування, аденілування, АДФ-рибозилювання білків-ферментів.
Фосфорилюють білки спеціальні ферменти протеїнкінази (протеїнфосфокінази), що за рахунок кінцевого (γ-) фосфату АТФ здійснюють фосфорилювання серинового чи треонінового (деякі протеїнкінази—тирозинового) радикалу відповідного білка:
![]()
Зворотна реакція — дефосфорилювання білків — каталізується протеїнфосфатазами:
![]()
Субстратами протеїнкіназ є численні ферментні білки (глікогенфосфорилаза, кіназа фосфорилази b, глікогенсинтетаза, тригліцеридліпаза, піруватдегідрогеназа, ацетил-КоА-карбоксилаза тощо), деякі білки мембранних каналів, гістони хроматину тощо.
Фосфорилювання багатьох білків-ферментів трансформує їх у каталітично активну форму (фосфорилювання глікогенфосфорилази, кінази фосфорилази b, тригліцеридліпази тощо); фосфорилювання інших ферментних білків (глікогенсинтетази, β-ГОМК-редуктази) є, навпаки, механізмом їх інактивації. Швидкість фосфорилювання-дефосфорилювання білків коливається, як правило, в межах від декількох секунд до декількох хвилин, відповідно до необхідності включення або виключення певної фізіологічної функції клітини.
У регуляції численних біохімічних функцій та фізіологічних процесів бере участь унікальна протеїнкіназа, що активується циклічним аденозинмонофосфатом (цАМФ) — вторинним посередником у дії на клітину багатьох фізіологічно активних сполук (див. нижче).
Протеолітична активація ферментів
Активація ферментів шляхом обмеженого протеолізу їх молекул є механізмом незворотної трансформації ферменту в каталітично активний стан. При дії цього механізму від неактивної форми ферменту-попередника {проферменту, зимогену) відщеплюється певний пептидний ланцюг; у пептиді, що залишається після обмеженого протеолізу, відбуваються конформаційні зміни, які призводять до формування активного центру і створення каталітично активної форми білка-ферменту.
Цей регуляторний механізм функціонує при утворенні активних форм більшості протеолітичних ферментів травного каналу — пепсину, трипсину, хімотрипсину, а також активних протеаз, що є компонентами (факторами) згортальної і фібринолітичної систем крові людини.
Дія регуляторних білків
Активність деяких ферментів контролюється спеціальними регуляторними білками, що можуть спричиняти активуючі або інгібіторні ефекти.
Прикладами таких білків-ефекторів є:
- кальмодулін (КМ) — Са-чутливий протеїн, який є хімічним сенсором, що трансформує збільшення цитозольної концентрації Са2+ в певні біохімічні та фізіологічні реакції клітини; після зв’язування чотирьох іонів кальцію комплекс КМ-4Са2+ стає здатним до активації багатьох ферментних білків, зокрема фосфодіестерази циклічних нуклеотидів, кінази легких ланцюгів міозину тощо;
- протеїназні інгібітори, тобто ефектори, що обмежують (блокують) активність тканинних протеїназ — ферментів, які спроможні розщеплювати власні білки організму; найбільш активними інгібіторами є α2-макроглобулін та α1-антитрипсин (α1-протеїназний інгібітор), які блокують активність серинових та інших протеїназ за рахунок зв’язування з їх активними центрами;
- антигемофільний глобулін А (фактор VIII згортальної системи крові); цей білок бере участь в активації фактора Х, що запускає весь коагуляційний каскад, який призводить до формування кров’яного згустка; спадкова недостатність антигемофільного глобуліну А проявляється схильністю до кровотеч — гемофілією.
Б. Другий шлях регуляції є механізмом довготривалої адаптації ферментного апарату. Для його включення і повної реалізації необхідно декілька годин або діб. У більшості випадків він полягає в змінах в інтенсивності біосинтезу певного ферментного білка за рахунок впливу на систему ядерного генома або рибосомального білкового синтезу (тобто процеси транскрипції та трансляції). У деяких біохімічних системах кількість білка-ферменту в клітині збільшується шляхом стабілізації існуючих молекул за рахунок гальмування активності протеаз, що їх розщеплюють.
Цей тип регуляції широко представлений у мікроорганізмів, які мають вражаючу властивість пристосування до змін у хімічному складі культурального середовища (концентрацій амінокислот, вуглеводів, присутності певних антибіотиків тощо) шляхом швидкої активації або гальмування синтезу відповідних ферментів.
Розрізняють два класи ферментів мікроорганізмів:
- конститутивні ферменти — такі, що синтезуються бактеріальними клітинами постійно, незалежно від змін в умовах існування;
- адаптивні ферменти — такі, інтенсивність біосинтезу яких змінюється залежно від змін в умовах існування.
Адаптивні ферменти мікроорганізмів поділяються на індуцибельні та репресибельні, тобто такі, активність синтезу яких, відповідно, підвищується або гальмується залежно від дії певних сполук-ефекторів. Молекулярні механізми ферментної індукції та репресії в кишкової палички E. Coli будуть розглянуті в главі 22.
Адаптивна індукція або репресія ферментів має місце і в клітинах еукаріотів. Прикладами індукції ферментних систем в організмі людини можуть бути зміни в концентрації білків-ферментів у печінці, що відбуваються залежно від кількості поживних сполук в їжі (адаптація ферментів вуглеводного, амінокислотного та ліпідного обмінів), надходження в організм чужорідних сполук — лікарських, токсичних (індукція ферментів детоксикації — глюкуронування та мікросомального окислення).
Циклічні нуклеотиди в регуляції ферментативних процесів
Важливою та поширеною біологічною системою контролю за ферментативними реакціями, що поєднує в собі різні молекулярні механізми регуляції, є система циклічних нуклеотидів.
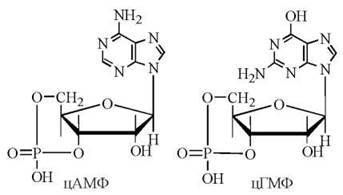
Циклічні нуклеотиди 3',5'-АМФ (цАМФ) та 3',5'-ГМФ (цГМФ) — це внутрішні (3'5') дифосфорні ефіри аденілової (АМФ) та гуанілової (ГМФ) кислот.
Найбільш поширеними є цАМФ-залежні системи контролю за внутрішньоклітинними біохімічними процесами, зокрема за такими, що підлягають нейрогуморальній регуляції з боку цілісного організму, яка реалізується гормонами та нейромедіаторами (глава 23). Регуляція ферментативних процесів за участю цАМФ включає декілька послідовних стадій передавання та трансформації хімічного (регуляторного) сигналу.
1. Утворення циклічних нуклеотидів у реакціях, що каталізуються ферментами циклазами: аденилатциклазою та гуанілатциклазою з нуклеозидтрифосфатів АТФ та ГТФ, відповідно:
![]()
Розщеплення цАМФ та цГМФ до звичайних, нециклічних нуклеозидмонофосфатів каталізується фосфодіестеразою циклічних нуклеотидів.
Фермент аденілатциклаза розміщений у плазматичних мембранах клітин і його активація відбувається в результаті взаємодії з рецепторами мембран певних фізіологічно активних сполук, зокрема гормонів адреналіну, глюкагону тощо.
2. Активація циклічним АМФ протеїнкіназ, функцією яких є фосфорилювання інших ферментних білків. Ці цАМФ-залежні протеїнкінази є регуляторними ферментами, що активуються цАМФ за механізмом алостеричного контролю.
цАМФ-залежна протеїнкіназа є тетрамером, що складається з двох каталітичних та двох регуляторних субодиниць (C2R2), як і інші ферменти з алостеричним механізмом регуляції. Взаємодія чотирьох молекул цАМФ із R-субодиницями призводить до дисоціації протеїнкіназного комплексу з вивільненням С-субодиниць, які спроможні до каталізу відповідної реакції (тобто фосфорилювання відповідних клітинних білків):
![]()
Активована протеїнкіназа може фосфорилювати декілька сотень або тисяч білків- субстратів, що призводить до значного посилення первинного хімічного регуляторного сигналу — каскадна система регуляції. Більш детально молекулярні механізми включення цАМФ-залежних каскадів біохімічних реакцій при дії гормонів на чутливі клітини будуть розглянуті в главі 23.
Порушення ферментативних процесів
Результатом зменшення концентрації в біохімічній системі in vivo будь-якого ферменту є порушення перебігу відповідної ферментативної реакції. Такі порушення ферментативних процесів мають місце в організмі людини та є біохімічним базисом розвитку численних патологічних процесів. У випадку, якщо зменшення кількості ферменту на певному метаболічному шляху є результатом уродженої нездатності клітини до його біосинтезу, внаслідок дії спадкових, генетичних факторів, виникають уроджені вади метаболізму.
Поняття «уроджені вади метаболізму» було висунуто ще в 1908 р. лікарем А.Оагго4, який першим розпізнав спадкову природу таких порушень метаболізму в людини, як алкаптонурія, цистинурія, альбінізм та пентозурія. Завдяки розвитку біохімічної генетики встановлено, що молекулярною основою уроджених вад метаболізму є дефекти ферментів (ензимопатії), що спричинені мутаціями в складі генів, які відповідальні за синтез певних ферментних білків.
До ензимопатій належать:
- уроджені порушення метаболізму простих та складних вуглеводів;
- уроджені порушення метаболізму ліпідів;
- уроджені порушення метаболізму амінокислот;
- уроджені порушення метаболізму порфіринів;
- уроджені порушення метаболізму пуринів та піримідинів.
На даний час відомо близько 150 спадкових ензимопатій. Зрозуміло, що, якщо ген, експресія якого відбувається шляхом синтезу білка-ферменту, є домінантним, певна патологія метаболізму проявляється вже в гетерозиготному стані; у випадку дефекту в структурірецесивного гена гетерозиготні за даним геном особини здатні синтезувати відповідний білок у зменшеній кількості, й ензимопатія у вигляді спадкової патології часто проявляє себе лише за певних фізіологічних умов.
Біохімічні механізми виникнення окремих типів ензимопатій та їх клінічні прояви будуть розглянуті у відповідних главах.