Підручник - БІОЛОГІЧНА ХІМІЯ - Губський Ю.І. - 2000
Розділ III. МЕТАБОЛІЗМ ОСНОВНИХ КЛАСІВ БІОМОЛЕКУЛ
ГЛАВА 13. МЕТАБОЛІЗМ ВУГЛЕВОДІВ. III. ОБМІН ГЛІКОГЕНУ ТА ГЛІКОКОН’ЮГАТІВ
13.2. РЕГУЛЯЦІЯ ГЛІКОГЕНОЛІЗУ ТА ГЛІКОГЕНЕЗУ
Глікоген є головною молекулярною формою запасання вуглеводів в організмі людини і тварин, що акумулюється у вигляді внутрішньоклітинних гранул, переважно в печінці та м’язах, під час травлення і витрачається в проміжках між прийомами їжі. Концентрація глікогену в гепатоцитах значно перевищує його концентрацію в клітинах м’язів, але, враховуючи загальну масу скелетних м’язів, в останніх зберігається більша частина тотального глікогену організму.
Кількісні показники вмісту глікогену в органах дорослої людини наведені в таблиці 13.1.
Таблиця 13.1. Вміст глікогену та глюкози в організмі людини (масою 70 кг, після споживання їжі)
Пул вуглеводів |
Концентрація |
Загальна кількість |
Глікоген печінки1 |
4,0 % |
72 г |
Глікоген м'язів2 |
0,7 % |
245 г |
Глюкоза екстрацелюлярна3 |
0,1 % |
10 г |
Всього |
327 г |
1 — маса печінки — 1,8 кг;
2 — маса м’язів — 35 кг;
3 — загальний об’єм екстрацелюлярної рідини — 10 л.
Завдяки наявності глюкозо-6-фосфатази, мобілізація глікогену печінки призводить до утворення вільної глюкози, що визначає функцію гепатоцитів у підтриманні рівня глікемії в умовах зменшення або відсутності абсорбції глюкози з кишечника. Вичерпання резервів глікогену печінки спостерігається у людини через 12-18 год після прийняття їжі; в цих умовах рівень глюкози в крові, необхідний для нормального функціонування інших тканин, насамперед головного мозку, підтримується за рахунок глюконеогенезу в печінці та нирках.
На відміну від печінки, м’язи використовують глікогеноліз лише для покриття власних енергетичних потреб. Значне зменшення концентрації глікогену м’язів спостерігається лише після тривалої та виснажливої фізичної роботи.
Виходячи із зазначеного, в організмі повинні існувати регуляторні механізми, що контролюють координовані зміни процесів синтезу та розпаду глікогену в умовах змін у режимі харчування, переходу організму від стану спокою до активної діяльності.
Ключову роль у регуляції реакцій глікогенолізу та глікогенезу відіграють ключові ферменти розщеплення та синтезу глікогену глікогенфосфорилаза та глікогенсинтаза. Контроль активностей глікогенфосфорилази та глікогенсинтази здійснюється шляхом їх ковалентної модифікації (фосфорилювання — дефосфорилювання) та частково — за механізмом алостеричної регуляції.
Регуляція активності глікогенфосфорилази
Глікогенфосфорилаза печінки та м’язів — це димер, який містить у своєму складі піридоксальфосфат. Фермент може перебувати в активній фосфорильованій формі (фосфорилаза а) та неактивній дефосфорильованій формі (фосфорилаза b).
1. Перетворення неактивної фосфорилази b в активну фосфорилазу а відбувається шляхом фосфорилювання серинових залишків у молекулі фосфорилази за рахунок макроергічних зв’язків АТФ:
![]()
Дефосфорилювання фосфорилази а протеїнфосфатазою (фосфатазою) призводить до утворення неактивної фосфорилази b.
2. Фермент, що фосфорилює фосфорилазу b, — кіназа фосфорилази b. Кіназа фосфорилази b також існує в двох молекулярних формах — неактивній та активній, які взаємоперетворюються шляхом фосфорилювання — дефосфорилювання.
Фосфорилювання кінази фосфорилази b (КФ b) відбувається за участю АТФ під дією цАМФ-залежної протеїнкінази:
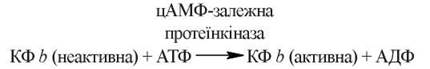
Дефосфорилювання кінази фосфорилази b фосфатазою супроводжується зворотним переходом ферменту в неактивну форму.
3. Каталітично активна протеїнкіназа формується за умов її взаємодії з 3',5'-АМФ (цАМФ), утворення якого в аденілатциклазній реакції є пусковою молекулярною подією, що включає каскадний механізм регуляції ферментних процесів у клітині (глава 7).
Активація аденілатциклази в гепатоцитах відбувається за умов взаємодії з мембранними рецепторами гормону α-клітин підшлункової залози глюкагону. В клітинах м’язів ферментний каскад глікогенолізу включається при взаємодії з β-адренорецепторами мембран міоцитів гормону мозкового шару надниркових залоз адреналіну (епінефрину).
Схему ферментного каскаду регуляції активності фосфоролізу глікогену подано на рис. 13.3:
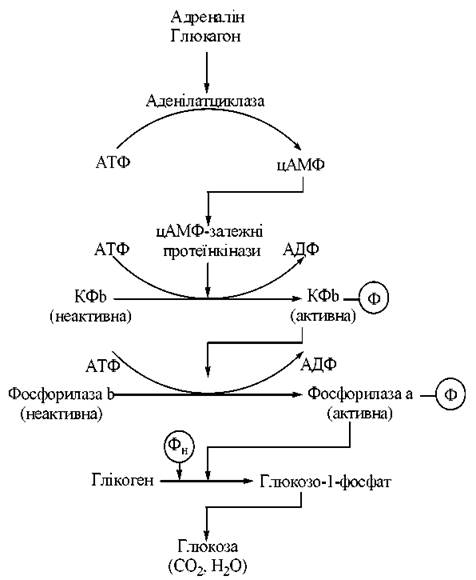
Рис. 13.3. Ферментний каскад фосфоролізу глікогену.
4. У м’язах існують також механізми стимуляції глікогенолізу шляхом алостеричної активації фосфорилази b та кінази фосфорилази b без фосфорилювання цих білків ферментного каскаду:
- до складу кінази фосфорилази b входить субодиниця, що є Са2+-зв’язуючим білком, за своїми властивостями ідентичним кальмодуліну. Зв’язування цією субодиницею чотирьох іонів кальцію активує каталітичний центр кінази фосфорилази b, хоча молекула ферменту залишається в дефосфорильованому стані. Цей процес має фізіологічне значення термінового механізму забезпечення енергією м’язового скорочення, який включається в результаті вивільнення Са2+ з саркоплазматичного ретикулума після надходження нервового імпульсу;
- активація м’язової фосфорилази b м’язів може також відбуватися без її фосфорилювання. Алостеричним активатором ферменту є АМФ, концентрація якого в м’язах значно зростає в умовах тривалого фізичного навантаження, що призводить до вичерпання резервів АТФ і накопичення АДФ та АМФ. Активована АМФ фосфорилаза b здатна забезпечити швидкість глікогенолізу, достатню для виконання м’язової роботи помірної інтенсивності.
Регуляція активності глікогенсинтази
Аналогічно до глікогенфосфорилази, глікогенсинтаза може існувати в двох молекулярних формах — фосфорильованій і дефосфорильованій. Але, на відміну від глікогенфосфорилази, каталітично активною є дефосфорильована форма ферменту — глікогенсинтаза а, а неактивною — фосфорильована форма — глікогенсинтаза b.
Фосфорилювання глікоген-синтази здійснюється за сериновими залишками ферменту цАМФ-залежною протеїнкіназою за рахунок макроергічних фосфатів АТФ:
![]()
Зворотна реакція — дефосфорилювання (активація) глікоген-синтази каталізується відповідною фосфатазою.
Із наведеного зрозуміло, що стимуляція каскаду фосфоролізу глікогену адреналіном або глюкагоном, яка супроводжується зростанням концентрації в клітинах цАМФ та активності цАМФ-залежних протеїнкіназ, призводить до фосфорилювання глікогенсинтази і її інактивації, тобто до пригнічення реакцій синтезу глікогену.
Таким чином, глікогенфосфорилаза і глікогенсинтаза регулюються реципрокно: активація глікогенфосфорилази (і фосфоролізу глікогену) відбувається в умовах інактивації глікогенсинтази (і синтезу глікогену). Ця реципрокна регуляція метаболізму є яскравим проявом молекулярної логіки живих організмів, які включають катаболічні ферментні системи при необхідності забезпечення клітин енергією (м’язова діяльність вимагає розщеплення резервних вуглеводів) і переключають біохімічні реакції на шляхи анаболізму (в даному випадку — синтезу глікогену) в період фізіологічного спокою (рис. 13.4).
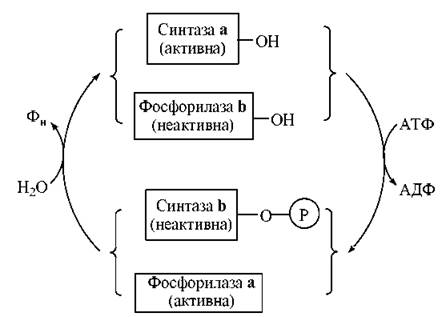
Рис. 13.4. Схема реципрокної регуляції активностей глікогенфосфорилази та глікогенсинтази.
Гормональна регуляція метаболізму глікогену
Участь гормонів у регуляції глікогенолізу та глікогенезу в м’язах та печінці може бути підсумована таким чином:
А. У м’язах.
Адреналін — стимулює глікогеноліз та гальмує глікогенез шляхом:
а) активації глікогенфосфорилази за рахунок її цАМФ-залежного фосфорилювання;
б) інгібірування глікогенсинтази за рахунок її цАМФ-залежного фосфорилювання.
Інсулін — стимулює глікогенез і гальмує глікогеноліз шляхом:
а) підвищення проникності мембран м’язових клітин для глюкози, що використовується для синтезу глікогену;
б) зменшення внутрішньоклітинного рівня цАМФ за рахунок активації її розщеплення фосфодіестеразою.
Б. У печінці.
Глюкагон — стимулює глікогеноліз та гальмує глікогенез за механізмом, аналогічним дії адреналізу в клітинах м’язів.
Інсулін — підвищує активність ферментативних реакцій синтезу глікогену за рахунок біохімічних механізмів, близьких до розглянутих вище.
Таким чином, співвідношення глюкагон/інсулін є важливим фізіологічним механізмом, що контролює глікогенну функцію печінки та рівень глюкози в крові після споживання їжі:
- переважання інсуліну сприяє утворенню в організмі резервів вуглеводів у формі глікогену печінки;
- переважання глюкагону сприяє мобілізації запасів глікогену печінки в умовах зниження рівня глюкоземії, яке спостерігається через кілька годин після споживання їжі.