Підручник - БІОЛОГІЧНА ХІМІЯ - Губський Ю.І. - 2000
Розділ III. МЕТАБОЛІЗМ ОСНОВНИХ КЛАСІВ БІОМОЛЕКУЛ
ГЛАВА 16. МЕТАБОЛІЗМ ЛІПІДІВ. III. ОБМІН ХОЛЕСТЕРИНУ. ТРАНСПОРТ ЛІПІДІВ
16.3. ТРАНСПОРТ ТА ДЕПОНУВАННЯ ЛІПІДІВ. ЛІПОПРОТЕЇНИ ПЛАЗМИ. ГІПЕРЛІПОПРОТЕЇНЕМІЇ
Із продуктами харчування до організму людини надходять ліпіди різних класів, а саме: триацилгліцероли (що складають основну масу харчових жирів); вільний холестерин та його ефіри з жирними кислотами (холестериди); складні ліпіди (переважно гліцерофосфоліпіди).
Детально біохімічні механізми перетравлення ліпідів різних класів у шлунково- кишковому тракті людини будуть подані в главі 26. У даному розділі розглянемо основні процеси, що стосуються біотранспорту триацилгліцеролів та холестерину, який починається з абсорбції цих ліпідів слизовою оболонкою кишечника.
Під дією панкреатичної ліпази та за участю жовчних кислот, які виробляються в печінці, триацилгліцероли продуктів харчування розщеплюються з утворенням 2-моноацилгліцеролів(моногліцеридів) та двох молекул вільних жирних кислот, що можна подати таким сумарним рівнянням:
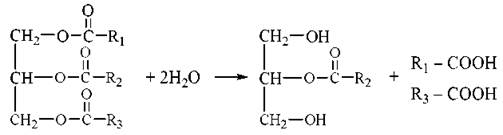
Зазначені продукти гідролізу (вищі жирні кислоти, моногліцериди) абсорбуються клітинами слизової оболонки тонкої кишки (ентероцитами). Холестерин продуктів харчування всмоктується у вільному стану, холестериди — після відповідного гідролізу холестеролестеразою.
Усередині ентероцитів продукти гідролізу триацилгліцеролів, що всмокталися, беруть участь у двох біохімічних процесах, які є передумовою подальшого надходження нейтральних жирів у кров, біотранспорту та їх тканинного депонування, а саме:
- реетерифікації вищих жирних кислот з утворенням нових молекул триацилгліцеролів;
- формування транспортних форм триацилгліцеролів — хіломікронів.
Ресинтез триацилгліцеролів в ентероцитах
Оскільки 2-моноацилгліцероли є основними продуктами гідролізу триацилгліцеролів, що абсорбуються епітеліоцитами кишечника, реетерифікація жирних кислот усередині цих клітин перебігає моногліцеридним шляхом, що включає такі реакції:
1. Утворення 1,2-моноацилгліцеролів (реакція каталізується кишковим ферментом моноацилгліцерол-ацилтрансферазою):
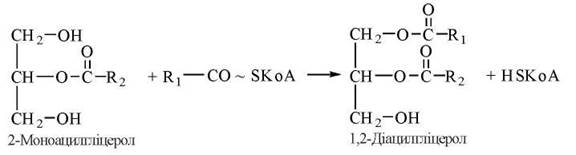
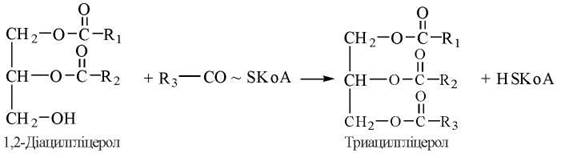
2. Утворення триацилгліцеролів за участю діацилгліцерол-ацилтрансферази:
Утворення хіломікронів
Триацилгліцероли ресинтезуються в ендоплазматичному ретикулумі мукозних клітин тонкої кишки. Вони утворюють ультрамікроскопічні краплинки, вкриті шаром поверхнево активних білків та фосфоліпідів. Ці структури отримали назву хіломікронів. До складу хіломікронів входять також вільний і етерифікований холестерин.
Хіломікрони є основною молекулярною формою, у вигляді якої нейтральні жири (триацилгліцероли) проходять через латеральну мембрану ентероцитів і через систему лімфатичних судин (лактеалей) потрапляють у лімфатичний протік, а потім — у кров (через v.subclavia sin.).
Ліпопротеїни плазми крові
Крім хіломікронів, кров людини містить декілька класів комплексів ліпідів із білками, що виконують функції міжорганного транспорту ліпідів — транспортні ліпопротеїни плазми крові. Транспортні ліпопротеїни є фізико-хімічною формою, за допомогою якої гідрофобні молекули ліпідів утримуються в стабільному стані у гідрофільному (водно-сольовому) середовищі плазми крові.
Фракціонування ліпопротеїнів крові людини здійснюється за допомогою методу ультрацентрифугування плазми в сольових розчинах, під час якого відбувається диференційоване спливання — флотація різних класів ліпопротеїнів, залежно від розмірів їх часточок та щільності. Ліпопротеїни можна також розділити методом електрофорезу, при якому вони пересуваються разом із певними класами глобулінів (α-, β-ліпопротеїни тощо).
За основу сучасної клініко-біохімічної класифікації ліпопротеїнів плазми крові людини взято їх розділення за умов ультрацентрифугування. Існує певна відповідність між класами ліпопротеїнів, що розділяються при застосуванні зазначених двох методів фракціонування.
Основні класи ліпопротеїнів плазми крові.
- хіломікрони (ХМ);
- ліпопротеїни дуже низької щільності (ЛПДНЩ), або пре-β-ліпопротеїни;
- ліпопротеїни проміжної щільності (ЛППЩ);
- ліпопротеїни низької щільності (ЛПНЩ), або β-ліпопротеїни;
- ліпопротеїни високої щільності (ЛПВЩ), або α-ліпопротеїни.
Зазначені класи ліпопротеїнів розрізняються за своїми фізико-хімічними характеристиками (табл. 16.1), біохімічним (ліпідним, білковим) складом та фізіологічними функціями.
Таблиця 16.1. Фізичні властивості ліпопротеїнів плазми крові людини
Клас ліпопротеїнів |
Щільність (г/мл) |
Діаметр часточок (нм) |
Хіломікрони |
< 0,95 |
100-1 000 |
ЛПДНЩ |
0,95-1,006 |
25-75 |
ЛППЩ |
1,006-1,019 |
25 |
ЛПНЩ |
1,019-1,063 |
20-28 |
ЛПВЩ |
1,063-1,210 |
5-13 |
За своєю молекулярною будовою ліпопротеїни плазми крові — це кулеподібні структури — міцели, всередині яких міститься гідрофобна ліпідна серцевина (ядро), що складається переважно з триацилгліцеролів та ефірів холестерину. Гідрофобне ядро вкрите шаром полярних амфіпатичних фосфоліпідів, периферичних та інтегральних білків. Схему молекулярної будови ліпопротеїнів подано на рис. 16.4.
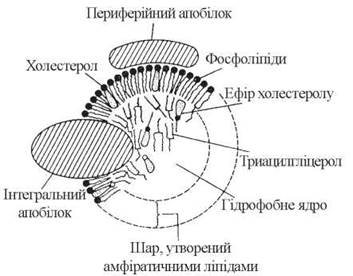
Рис.16.4. Схема будови ліпопротеїнів плазми крові.
Окремі класи ліпопротеїнів розрізняються також за складом білків, що входять до них. Білки, які входять до складу ліпопротеїнів плазми крові людини, отримали назву аполіпопротеїнів(апопротеїнів, апобілків, Апо). Існує п’ять основних сімейств таких білків (A, B, C, D, E), до яких належать десять основних апопротеїнів: A-1, A-2, A-4, В-48, В-100, C-1, C-2, C-3, D та E, що входять до складу певних ліпопротеїнів у різних кількісних співвідношеннях (таблиця 16.2).
Таблиця 16.2. Аполіпопротеїни плазми крові людини
Апопротеїн |
Класи ліпопротеїнів, до складу яких входять певні апобілки |
A-1 |
ЛПВЩ |
А-2 |
ЛПВЩ |
В |
ЛПНЩ, ЛПДНЩ |
С-1,С-2,С-3 |
ЛПВЩ, ЛПНЩ, ЛПДНЩ |
D |
ЛПВЩ |
E |
ЛПВЩ, ЛПНЩ, ЛПДНЩ |
Ліпопротеїни певних класів (ЛП) містять у собі різні кількості окремих фракцій ліпідів крові — триацилгліцеролів (ТГ), вільного (Хв) та етерифікованого (Хе) холестерину, фосфоліпідів (ФЛ) — в міжорганному транспорті яких вони беруть активну участь (таблиця 16.3). Ці ліпопротеїни формуються в різних органах, і їх метаболізм має надзвичайне значення в нормальному розподілі та депонуванні нейтральних жирів та холестерину.
Таблиця 16.3. Хімічний склад основних ліпопротеїнів плазми крові людини (%) (за R.Murray т.і.,1988, L. Stryer,1995)
ЛП |
Білки |
Ліпіди (всього) |
Фракції ліпідів( % від загальної кількості ліпідів) |
Апобілки |
|||
ТГ |
Х |
ФЛ |
|||||
Всього |
Хв/Хе |
||||||
ХМ |
1-2 |
98-99 |
88 |
4 |
1/3 |
8 |
B-48,C,E |
ЛПДНЩ |
7-10 |
90-93 |
57 |
23 |
8/15 |
20 |
B-100,C,E |
ЛПНЩ |
21 |
79 |
14 |
58 |
10/48 |
28 |
B-100 |
ЛПВЩ |
45 |
55 |
18 |
38 |
8/30 |
44 |
A |
Хіломікрони — ліпопротеїни, що утворюються в слизовій оболонці тонкої кишки після внутрішньоклітинного ресинтезу триацилгліцеролів. Вони є молекулярною формою, в якій нейтральні жири та холестерин надходять із ентероцитів у кров через систему лімфатичних судин.
ЛПДНЩ — ліпопротеїни, що також містять значну кількість нейтральних жирів. ЛПДНЩ синтезуються в гепатоцитах і є основною молекулярною формою, в якій триацилгліцероли виходять із печінки у кров та транспортуються в інші органи. Деяка кількість ЛПДНЩ утворюється, подібно до хіломікронів, в ентероцитах під час перетравлення харчових ліпідів і з кишечника надходить у кров.
Хіломікрони та ЛПДНЩ щодобово переносять із кишечника та печінки в різні тканини (жирову та ін.) в середньому 70-150 г нейтральних жирів. У тканинному депонуванні триацилгліцеролів, що транспортуються ліпопротеїнами плазми крові, бере участь ліпопротеїнліпаза судинного ендотелію різних органів, яка гідролізує нейтральні жири, які входять до складу ХМ та ЛПДНЩ.
Ліпопротеїнліпаза — ферментний білок, адсорбований на глікозамінгліканах поверхні ендотелію і має центр зв’язування ліпопротеїнів крові та каталітичний центр гідролізу триацилгліцеролів. Під дією ліпопротеїнліпази утворюються вільні жирні кислоти та гліцерин, що проникають через судинну стінку всередину клітин, де окислюються з вивільненням енергії (в міоцитах тощо) або депонуються у вигляді резервних триацилгліцеролів (в адипоцитах жирової тканини). Ліпопротеїни, що утворюються внаслідок деліпідизації ХМ та ЛПДНЩ — залишкові, або ремнантні(remnant— залишок, англ.) ліпопротеїни, збагачені (порівняно з ХМ та ЛПДНЩ) вільним та етерифікованим холестеролом.
Ремнанти ХМ поглинаються з крові клітинами печінки, які використовують більшість холестерину цих ліпопротеїнів для синтезу жовчних кислот. Ремнанти ЛПДНЩ отримали назву ЛІІІІІЦ і є безпосередніми попередниками в утворенні ЛПНЩ.
ЛПНЩ — ліпопротеїни, що утворюються з ЛІ IIІЩ (ремнантів ЛПДНЩ) під дією печінкової ліпази, локалізованої на люмінальній поверхні ендотеліальних клітин печінки. ЛПНЩ, що утворюються внаслідок цього процесу, містять, на відміну від своїх попередників — ЛПДНЩ та ЛППЩ, значно меншу кількість триацилгліцеролів і відрізняються складом апопротеїнів. Разом з тим, до складу ЛПНЩ входить найбільша кількість холестерину (здебільшого в етерифікованій формі), і вони є основним класом ліпопротеїнів плазми крові людини, що переносять холестерин.
ЛПНЩ поглинаються клітинами різних органів за механізмом піноцитозу після взаємодії цих ліпопротеїнів з ЛПНЩ-специфічними рецепторами на плазматичних мембранах. Завдяки наявності означених рецепторів, ЛПНЩ виконують свою функцію основної молекулярної форми транспорту холестерину в тканини.
Біологічна роль рецепторів ЛПНЩ полягає в забезпеченні всіх клітин організму достатньою кількістю холестерину, необхідного для побудови біологічних мембран та синтезу фізіологічно активних продуктів біотрансформації холестерину — жовчних кислот, статевих гормонів, кортикостероїдів. Відповідно до зазначеного, найбільша кількість рецепторів ЛПНЩ міститься на плазматичних мембранах клітин печінки, статевих та надниркових залоз.
Порушення обміну ЛПНЩ є біохімічною основою ряду важких порушень ліпідного обміну. Оскільки холестерин може проникати в судинну стінку саме у складі ЛПНЩ, висока концентрація цих ліпопротеїнів у плазмі крові людини розглядається як фактор, що сприяє розвиткові атеросклерозу (див. нижче). Генетично спадковане порушення синтезу рецепторів ЛПНЩ призводить до розвитку сімейної гіперхолестеринемії (СГХ), яка проявляється накопиченням ЛПНЩ у плазмі та вираженою гіперхолестеринемією вже в ранньому дитячому віці. За відкриття рецепторів ЛПНЩ та розв’язання молекулярних механізмів виникнення СГХ американським ученим М. Брауну та Дж. Гольдштейну (M.Brown, J.Goldstein) було присуджено Нобелівську премію 1985 р. в галузі фізіології та медицини.
ЛПВЩ — ліпопротеїни, що утворюються в печінці й, частково, у тонкій кишці у вигляді бішарових ліпідних дисків, що складаються, переважно, з фосфоліпідів, вільного холестерину та апобілків Апо Е та Апо С. Дозрівання ліпопротеїнів відбувається в крові, де Апо Е та Апо С замінюються на Апо А, холестерин етерифікується за участю лецитин-холестерол-ацилтрансферази, і ліпопротеїнові часточки набувають сферичної форми. За особливостями свого хімічного складу ЛПВЩ поділяються на підкласи — ЛПВЩ2 та ЛПВЩ3.
Подібно до ЛПНЩ, ЛПВЩ здатні до активного обміну свого холестерину з холестерином, що входить до складу біомембран. При цьому виникають протилежно спрямовані потоки холестерину: тоді як ЛПНЩ постачають холестерин у клітинні мембрани, ЛПВЩ, навпаки, — витягують на себе мембранний холестерин. Таким чином, за допомогою ЛПВЩ забезпечується протидія надмірному накопиченню холестерину в клітинах, у зв’язку з чим ЛПВЩ розглядаються як антиатерогенні ліпопротеїни. Катаболізм ЛПВЩ також відбувається в печінці.
Гіперліпопротеїнемії
Гіперліпопротеїнемія — клініко-біохімічний синдром, при якому в плазмі крові людини спостерігається підвищення (порівняно з нормою для певної популяції) концентрації певних класів ліпопротеїнів, а також триацилгліцеролів та холестерину.
За механізмом походження виділяють:
- первинні (спадкові) гіперліпопротеїнемії, тобто такі, що спричинені генетичними дефектами в синтезі певних ферментів обміну ліпідів крові (зокрема, ліпопротеїнліпази, холестерол-ацилтрансферази) або неферментних білків — порушеннями в синтезі певних апопротеїнів, рецепторів для апобілків та ліпопротеїнів (зокрема ЛПНЩ);
- вторинні (набуті) гіперліпопротеїнемії — гіперліпопротеїнемії, що розвиваються внаслідок певних хвороб внутрішніх органів (гепатит, цироз печінки, нефроз), ендокринопатій (порушення функції щитовидної залози, статевих залоз, цукровий діабет), дії пошкоджуючих факторів середовища (хронічний алкоголізм).
Сучасна класифікація гіперліпопротеїнемій, запропонована ВООЗ, бере до уваги клініко-біохімічні характеристики порушень ліпідного обміну у людини (зокрема концентрації ЛПНЩ, ЛПДНЩ, триацилгліцеролів та холестерину) без врахування причин їх розвитку (первинних (генетичних) або вторинних). Згідно з класифікацією ВООЗ, виділяють п’ять основних типів гіперліпопротеїнемій (I, II, III, IV, V) та два субтипи (IIa та IIb) — таблиця 16.4.
Таблиця 16.4. Класифікація гіперліпопротеїнемій за ВООЗ (за G.Thompson, 1991)
Тип |
Ліпопротеїни |
Холестерин плазми |
Холестерин ЛПНЩ |
Триацилгліцероли плазми |
I |
Надлишок ХМ |
Підвищений |
Підвищений або в нормі |
Підвищені |
IIa |
Надлишок ЛПНЩ |
Підвищений або в нормі |
Підвищений |
В нормі |
IIb |
Надлишок ЛПНЩ та ЛПДНЩ |
Підвищений |
Підвищений |
Підвищені |
III |
Надлишок ремнантів ХМ та ЛППЩ |
Підвищений |
Підвищений або в нормі |
Підвищені |
IV |
Надлишок ЛПДНЩ |
Підвищений або в нормі |
В нормі |
Підвищені |
V |
Надлишок ХМ та ЛПДНЩ |
Підвищений |
В нормі |
Підвищені |
Прикладами первинних гіперліпопротеїнемій, що можуть бути віднесені до певних типів порушень обміну ліпопротеїнів, за класифікацією ВООЗ, є:
- сімейна гіпертригліцеридемія (сімейна хіломікронемія) — тип I;
- сімейна гіперхолестеринемія (сімейна гіпербеталіпопротеїнемія) — тип II;
- сімейна дисбеталіпопротеїнемія — тип III;
- сімейна гіперпребеталіпопротеїнемія — тип IV.