Підручник - БІОЛОГІЧНА ХІМІЯ - Губський Ю.І. - 2000
Розділ III. МЕТАБОЛІЗМ ОСНОВНИХ КЛАСІВ БІОМОЛЕКУЛ
ГЛАВА 17. МЕТАБОЛІЗМ АМІНОКИСЛОТ I. ЗАГАЛЬНІ ШЛЯХИ ПЕРЕТВОРЕННЯ
17.2. ТРАНСАМІНУВАННЯ АМІНОКИСЛОТ
Реакції трансамінування полягають у переносі α-аміногрупи від амінокислоти на α-вуглецевий атом а-кето- кислоти — акцептора аміногрупи (здебільшого — α-кетоглутарату); в результаті реакції утворюється α-кетоаналог вихідної амінокислоти та нова амінокислота (в разі використання як акцептора α-кетоглутарату — L-глутамат):
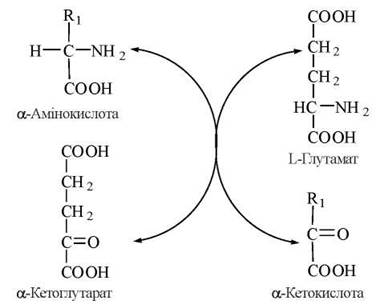
Рис. 17.2. Загальна схема реакцій трансамінування.
Ферменти, що каталізують реакції трансамінування, — амінотрансферази (трансамінази).
Амінотрансферазні реакції
У різних тканинах організму людини і тварин міститься більше десяти різних амінотрансфераз, що розрізняються за своєю субстратною специфічністю. Найбільш поширеними є такі амінотрансферази:
(1) аланінамінотрансфераза (глутамат-піруваттрансаміназа — ГПТ):
![]()
(2) аспартатамінотрансфераза (глутамат-оксалоацетаттрансаміназа — ГОТ):
![]()
(3) тирозинамінотрансфераза:
![]()
(4) лейцинамінотрансфераза:
![]()
Реакції трансамінування, що каталізуються амінотрансферазами, активно перебігають в багатьох органах, найактивніше — в печінці, скелетних м’язах, міокарді, головному мозку, нирках. Визначення активності аланінамінотрансферази (аланінової трансамінази — АлТ) та аспартатамінотрансферази (аспарагінової трансамінази — АсТ) широко застосовується в медичній практиці з метою діагностики пошкоджень внутрішніх органів. Внаслідок виходу цих ферментних білків через ушкоджені клітинні мембрани в кров при інфаркті міокарда спостерігається значне підвищення активності в сироватці крові АсТ, при вірусних та токсичних пошкодженнях печінки — АлТ.
Механізм дії амінотрансфераз
Амінотрансферази є складними білками-ферментами, простетичною групою в яких є коферментні форми вітаміну В6 (піридоксину, піридоксолу) — піридоксальфосфат (ПАЛФ) та піридоксамінфосфат (ПАМФ), що утворюється з ПАЛФ у процесі переносу аміногрупи.
Утворення коферменту з вітаміну В6, що надходить в організм із продуктами харчування, відбувається шляхом фосфорилювання піридоксолу до піридоксолфосфату (ПОЛФ) за дії АТФ-залежної кінази з подальшим окисленням ПОЛФ до ПАЛФ специфічним флавопротеїном.
У складі ферменту амінотрансферази кофермент (ПАЛФ) сполучений з поліпептидним ланцюгом за рахунок утворення альдімінного зв’язку (основи Шиффа) з ε-аміногрупою залишку лізину (Lys-258).
У процесі каталітичного акту трансамінування відбувається циклічне перетворення ПАЛФ на ПАМФ:
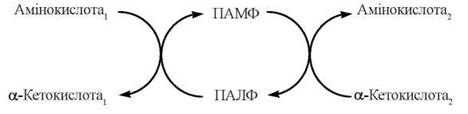
Процес складаєтья з двох напівреакцій:
1) взаємодія амінокислоти, що втрачає аміногрупу, з піридоксальфосфатом з утворенням кетокислоти та піридоксамінфосфату:
![]()
Механізм реакції полягає у взаємодії амінокислоти з ПАЛФ-Е із заміною альдимінного зв’язку у складі ПАЛФ-Е на альдимінний зв’язок між коферментом та амінокислотою (1а); після внутрішньомолекулярного перегрупування (1б) відбувається гідроліз кетиміну (1в) з утворенням коферментної форми, що містить аміногрупу (ПАМФ), та α-кетокислоти1:
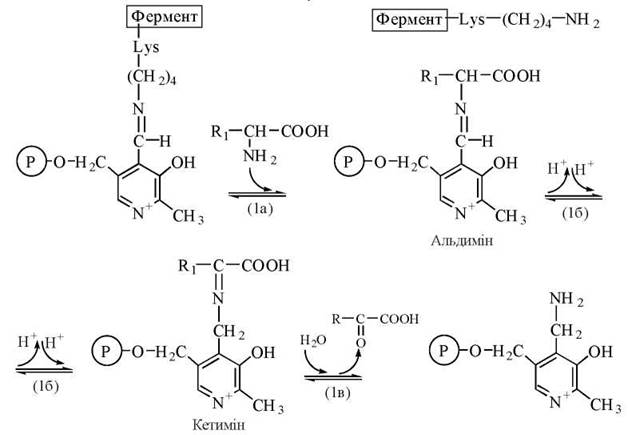
Напівреакція каталітичного циклу трансамінування.
2) взаємодія α-кетокислоти2, що акцептує аміногрупу, з піридоксамінфосфатом з утворенням нової амінокислоти та регенерацією піридоксальфосфату:
![]()
Механізм цієї напівреакції аналогічний розглянутому для першої напівреакції (при її течії в зворотному напрямку); ПАЛФ, що регенерує в результаті другої напівреакції, знову сполучається альдимінним зв’язком з білковою частиною ферменту.
Процес трансамінування та ферменти, що його каталізують, були вперше описані в 1937 р. А.О. Браунштейном та М.Г. Крицман; пізніше А.О. Браунштейном та М.М. Шемякіним була запропонована теорія піридоксалевого каталізу. А.О. Браунштейн народився в м. Харкові, закінчив Харківський медичний інститут, працював в Інституті біологічної і медичної хімії АМН СРСР, Інституті молекулярної біології АН СРСР.

Рис. 17.3. Браунштейн Олександр Овсійович (1902-1986)— академік АН та АМН СРСР.
Біохімічне значення реакцій трансамінування
Як випливає з наведеного, в реакціях трансамінування не відбувається дезамінування, тобто вивільнення аміаку, оскільки аміногрупа, що відщеплюється від α-L-амінокислоти, акцептується відповідною α-кетокислотою, здебільшого — α-кетоглутаровою.
Біохімічне значення трансамінування суттєво відрізняється в різних органах.
У печінці роль трансамінувавання полягає в його колекторній функції, тобто збиранні аміногруп від різних амінокислот переважно в одній молекулярній формі — у вигляді L-глутамінової кислоти. Біохімічний сенс такого процесу полягає в тому, що саме L-глутамат є основним субстратом реакцій дезамінування, тобто постачальником аміногруп на метаболічний шлях утворення сечовини — кінцевого продукту азотистого катаболізму.
У м’язах спрямованість реакцій трансамінування призводить до утворення значної кількості аланіну (за рахунок переамінування амінокислот з піруватом), що виділяється в кров’яне русло і поглинається гепатоцитами; в печінці аланін знову перетворюється на піруват, який використовується в глюконеогенезі (глюкозо-аланіновий цикл — див. главу 12).