Підручник - БІОЛОГІЧНА ХІМІЯ - Губський Ю.І. - 2000
Розділ IV. МОЛЕКУЛЯРНІ МЕХАНІЗМИ СПАДКОВОСТІ ТА РЕАЛІЗАЦІЇ ГЕНЕТИЧНОЇ ІНФОРМАЦІЇ
ГЛАВА 20. МОЛЕКУЛЯРНІ МЕХАНІЗМИ РЕПЛІКАЦІЇ ДНК ТА ТРАНСКРИПЦІЇ РНК
20.4. ФЕРМЕНТИ ТА МЕХАНІЗМИ ТРАНСКРИПЦІЇ РНК
Біосинтез РНК на ДНК-матриці отримав назву транскрипції(transcription — переписування, англ.). Загальні закономірності цього процесу близькі у прокаріотів та еукаріотів.
Послідовність включення рибонуклеотидів у полірибонуклеотидний ланцюг у процесі транскрипції програмується послідовністю нуклеотидів в матричній ДНК. Розрізняють кодуючий ланцюг ДНК — тобто такий, з якого зчитується генетична інформація, та некодуючий ланцюг. У дволанцюговій ДНК, що містить багато генів, для деяких генів кодуючою може бути один з ланцюгів, для інших генів — другий ланцюг:
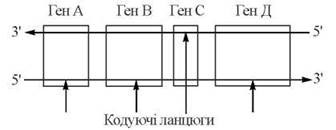
Транскрипція РНК різних класів на матричній ДНК каталізується ферментами ДНК-залежними РНК-полімеразами (РНК-полімеразами), які розрізняються у прокаріотичних та еукаріотичних організмів. На відміну від ДНК-полімераз, РНК-полімерази здатні до самостійної ініціації синтезу полінуклеотидного ланцюга, зв’язуючись у певних ділянках (сайтах) з матричною ДНК.
Ферменти та механізми транскрипції у прокаріотів
У прокаріотичних клітинах, на відміну від еукаріотичних (див. нижче), єдиним ферментом, що синтезує всі три класи РНК (матричні, транспортні та рибосомальні) є ДНК-залежна РНК-полімераза(РНК-полімераза).
РНК-полімераза E. Coli (м.м. 465 кД) є олігомерним білком, що складається з декількох типів субодиниць: двох α-субодиниць, однієї β- та однієї β’-субодиниці. Ці чотири протомери складають так званий «кор-фермент» (core — серцевина, ядро; англ.) α2ββ’, що утворює цілий холофермент при взаємодії з додатковою — σ-(сигма)-субодиницею, яка зворотно зв’язується з комплексом α2ββ’ та дисоціює на певних стадіях транкрипції.
Система транскрипції у E. Coli потребує наявності РНК-полімерази (холоферменту), чотирьох нуклеозидтрифосфатів (АТФ, ГТФ, УТФ, ЦТФ) та ДНК-матриці. Загальна схема РНК-полімеразної реакції може бути подана таким рівнянням:
![]()
Напрямок синтезу полірибонуклеотидного ланцюга: 5'→3'. Подібно до ДНК-полімеразних реакцій, РНК-полімеразна реакція здійснюється шляхом нуклеофільної атаки 3'-ОН-групи кінцевої рибози полірибонуклеотидного ланцюга на α-фосфат нуклеозидтрифосфату, що вступає в реакцію подовження ланцюга. Каталітичний сайт, що утворює 3'-5'-фосфодіефірні зв’язки між рибонуклеозидмонофосфатами, локалізований на β-субодиниці РНК-полімерази.
Етапи синтезу РНК у прокаріотів
а) зв’язування РНК-полімерази з ДНК-матрицею;
б) ініціація синтезу полірибонуклеотидного ланцюга;
в) елонгація (подовження) синтезу РНК;
г) термінація, тобто закінчення синтезу РНК (так званого «первинного РНК-транскрипту»).
Взаємодія РНК-полімерази з ДНК-матрицею та ініціація транскрипції
Промотори транскрипції
Зв’язування РНК-полімерази з ДНК-матрицею відбувається в специфічних ділянках геному — промоторах. Ця взаємодія реалізується за участю σ-субодиниці РНК-полімерази, яка в подальшому (після ініціації синтезу полірибонуклеотиду) дисоціює від кор-ферменту. Бактеріальні клітини продукують значну кількість σ-факторів, що необхідні для ініціації синтезу різних РНК.
Промоторні ділянки ДНК — послідовності, що складаються приблизно з 40 нуклеотидів. Важливими для ініціації транскрипції є такі короткі (6-нуклеотидні) послідовності, що містяться в складі різних промоторів (рис. 20.12):
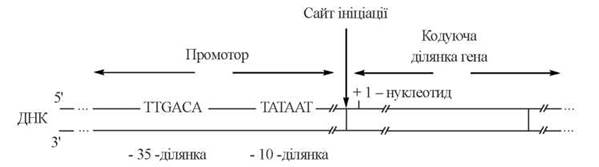
Рис. 20.12. Схема будови промоторної ділянки ДНК.
(1) «-35-послідовність’ — послідовність TTGACA, що локалізована на 35 нуклеотидів «вліво» (в напрямку 5'-кінця) від точки ініціації («0-точки») і є, як вважають, ділянкою, з якою взаємодіє σ-фактор холоферменту РНК-полімерази;
(2) «-10-послідовність», або «блок Прибнова» («Pribnow box») — послідовність TATAAT, що локалізована на 10 нуклеотидів «вліво» від точки ініціації. На ділянці Прибнов-боксу відбувається розплетення двох ланцюгів ДНК, і кодуючий ланцюг стає доступним для каталітичних сайтів РНК-полімерази.
Ініціація транскрипції
Безпосередньо ініціація синтезу РНК починається із включення в ланцюг першого (5'-кінцевого) нуклеотиду, яким у всіх мРНК (як в про-, так і еукаріотичних організмах) є пуриновий нуклеозидтрифосфат (Пур-5'-ФФФ):
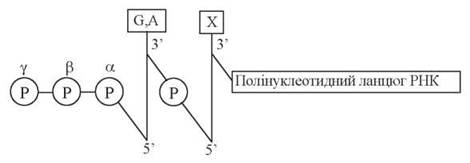
Швидкість процесу ініціації залежить від структури промоторних послідовностей, що передують точкам ініціації. Існують сильні та слабкі промотори транскрипції:
сильні промотори спричиняють ініціацію транскрипції відповідних РНК з частотою до одного акту ініціації на секунду;
слабкі промотори спричиняють ініціацію транскрипції з частотою близько одного акту початку синтезу РНК на 10 хвилин.
Ефективність дії промоторів залежить від нуклеотидних послідовностей, що розміщені між «-35» та «-10»-блоками; до того ж активність промоторів значно зменшується за умов мутацій у зазначених промоторах.
Взаємодія РНК-полімерази з ДНК-матрицею блокується протипухлинним антибіотиком актиноміцином D, який розміщується в щілинах між сусідніми парами азотистих основ, переважно між G-C-парами (процес інтеркаляції), протидіючи зв’язуванню ферменту з полідезоксирибонуклеотидним ланцюгом.
Інгібіторами ініціації є антибактеріальні антибіотики рифаміцин та рифампіцин, які блокують зв’язування перших НТФ з активними центрами β-субодиниці РНК-полімерази.
Елонгація та термінація транкрипції
Як уже зазначалося, елонгація синтезу РНК відбувається в напрямку 5'→3' антипаралельно кодуючому (матричному) ланцюгу ДНК:
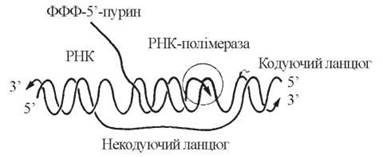
У ході елонгації відбувається розплітання ділянок двоспіральної ДНК, які передують РНК-полімеразі, і утворення 3'-5'-фосфодіефірних зв’язків у полірибонуклеотидному ланцюгу. Вибір чергового НМФ в ланцюгу РНК, що синтезується, визначається будовою комплементарного дНМФ в кодуючому ланцюгу ДНК таким чином, що азотисті основи A, G, T, C ланцюга ДНК кодують включення в ланцюг РНК, відповідно, основ U, С, А та G (рис. 20.13).
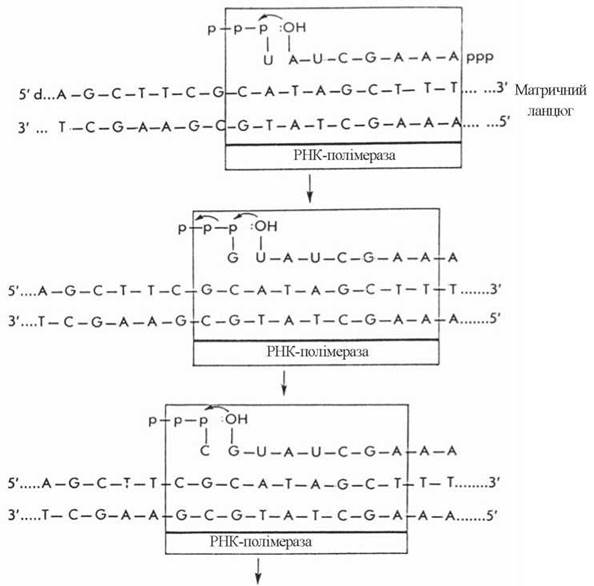
Рис. 20.13. Послідовне копіювання кодуючого ланцюга ДНК у процесі транскрипції (Ю.А. Овчинников, 1987).
У результаті елонгації утворюється ДНК-РНК-гібрид, що складається з кодуючого ланцюга ДНК та РНК-транскрипту.
Термінація транскрипції відбувається за умов:
(1) досягнення РНК-полімеразою в її просуванні впродовж ДНК-матриці певних термінуючих ділянок. Специфічними для термінуючих ділянок є наявність зворотних повторів («паліндромів»)*, тобто нуклеотидних послідовностей, що читаються однаково у прямому і зворотному напрямках, та наступних полі-АТ-пар. Ділянка РНК, що транскрибується з такої паліндромної послідовності, має будову типу «шпильки» з наступною (кінцевою) UUU...-послідовністю. Утворення РНК з такою структурою є передумовою дисоціації ДНК-РНК-гібриду (рис. 20.14).
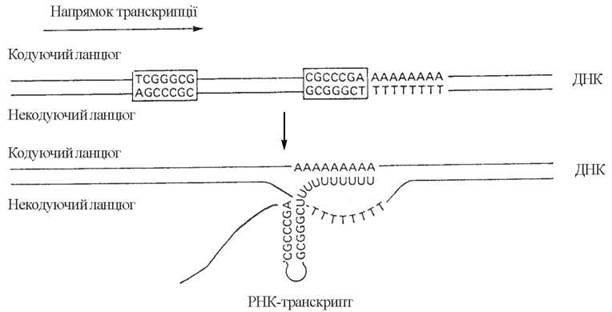
Рис. 20.14. Термінуюча ділянка гена, до складу якої входять зворотні повтори (TCGGGCG)-(GCGGGCT) та (CGCCCGA)-(AGCCCGC), відповідно.
Транскрипція кодуючого ланцюга термінуючої ділянки призводить до утворення РНК-транскрипту, в складі якого містяться комплементарні послідовності (AGCCCGC) та (UCGGGCG), що утворюють шпилькоподібні структури.
(2) допоміжної дії специфічного білка-термінатора, так званого ρ-(ро)-фактора. Взаємодія ρ-фактора з полімеразним комплексом призводить до дисоціації комплексу «ДНК — фермент — РНК» і вивільнення первинного транскрипту.
Послідовність процесів, що складають ДНК-залежну транскрипцію РНК у еукаріотів, подано на рис. 20.15.
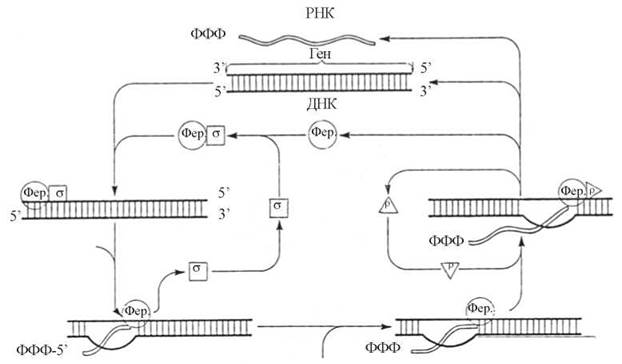
Рис. 20.15. Схема послідовних етапів транскрипції за участю РНК-полімерази (Фер).
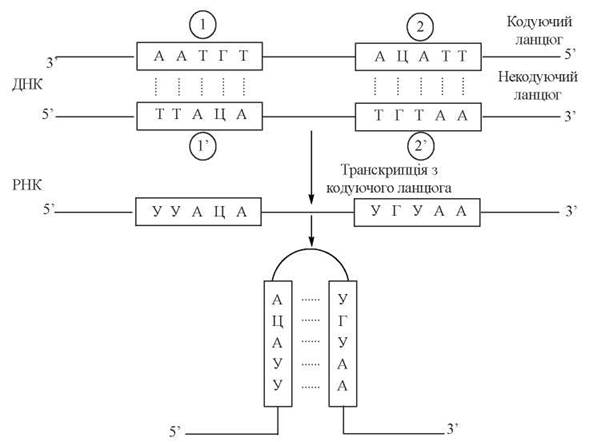
Рис. 20.16. Схема утворення «шпильок» в РНК-транскрипті. Послідовності (1) і (2’) та (2) і (1’) в ланцюгах ДНК є попарними паліндромами. Послідовності УУАЦА та УГУАА в РНК-транскрипті взаємокомлементарні.
Ферменти та механізми транкрипції в еукаріотів
РНК-полімерази вищих організмів
Еукаріотичні клітини містять три основних класи РНК-полімераз, кожен з яких відповідає за транкрипцію різних наборів генів і синтез певного типу РНК. Молекулярна маса РНК-полімераз з клітин ссавців складає 500-600 кД.
Таблиця 20.2. Ядерні РНК-полімерази клітин тваринних організмів
Клас РНК-полімераз |
Продукти транскрипції |
Локалізація |
I (A) |
Рибосомальна РНК (рРНК) |
Ядерце |
II (B) |
Гетерогенна ядерна РНК (гяРНК) |
Нуклеоплазма |
III(C) |
Транспортна РНК (тРНК), 5s РНК |
Нуклеоплазма |
Крім зазначених РНК-полімераз, що розташовані в ядрі еукаріотичної клітини, в мітохондріях функціонує власна РНК-полімераза, яка забезпечує транскрипцію генів більшості мітохондріальних білків, відповідно до інформації, що закладена в автономному мітохондріальному геномі.
Ядерним ферментом, що забезпечує транскрипцію генів, які програмують синтез більшості клітинних білків, є РНК-полімераза II, яка забезпечує утворення гетерогенних за розміром та нуклеотидною послідовністю попередників мРНК — гяРНК. РНК-полімераза II специфічно блокується α-аманітином — токсином, що продукується грибом Amantia phaloides.
При дії РНК-полімерази II в клітинах еукаріотів утворюється моноцистронна РНК, тобто така, що є матрицею для синтезу в рибосомах одного поліпептидного ланцюга — на відміну від поліцистронної РНК прокаріотів.
Сигнали транскрипції
Особливістю синтезу РНК у вищих організмів є більш складна, порівняно з прокаріотами, система сигналів транскрипції, яка складається з певних послідовностей ДНК у складі промотора та регуляторних білків, що контролюють активність транскрипції.
Сигналом ініціації транскрипції в генах ссавців є гомологічна блоку Прибнова (TATAAT) послідовність TATAAAAGA, яка розміщена на відстані -32 від точки початку синтезу полірибонуклеотиду. З цією послідовністю взаємодіє РНК-полімераза II.
Система транскрипційних сигналів у еукаріотів включає також сигнали, які не лише вказують на місце початку синтезу РНК, а й регулюють його активність. Більш детально ці питання будуть розглянуті в главі 23.
Посттранскрипційна модифікація РНК
У клітинах прокаріотів, зокрема, в найбільш вивченій бактеріальній клітині — E. Coli, молекули мРНК синтезуються одразу у «зрілому» вигляді, тобто готовими до виконання своїх біохімічних функцій. На відміну від цього, в результаті процесів біосинтезу полірибонуклеотиду, що відбуваються в еукаріотичних клітинах, утворюється первинний транскрипт (гетерогенна ядерна РНК, або пре-мРНК), який здатний до перетворення у функціональну повноцінну молекулу в результаті реакцій постранскрипційної модифікації — процесингу (дозрівання).
Процесинг первинного транскрипту включає в себе:
- приєднання до 5'-кінця молекули специфічної нуклеотидної структури — так званого «кепу»; як «кеп» виступає сполучений трифосфатним зв’язком з 5'-кінцевим нуклеотидом 7-метилгуанозин (глава 3, п. 3.4);
- приєднання до З'-кінця первинного транскрипту поліаденілатного «хвоста» — роіу(Л)-послідовності довжиною в 20-250 нуклеотидів; значення кепування та поліаденілування полягає у підсиленні трансляційної активності зрілої мРНК та протидії руйнуючому впливу клітинних РНК-аз;
- вирізання неінформативних послідовностей нуклеотидів з молекул пре-мРНК та зшивання внутрішніх кінців молекул — сплайсинг(splicing — англ.). Оскільки геноми (ДНК) вищих організмів мають, поряд з генами, що транслюються у відповідні білки — екзонами, значну кількість нуклеотидних послідовностей, які не несуть генетичної інформації — інтронів, процес сплайсингузабезпечує видалення з первинних транскриптів саме інтронів, тобто послідовностей, що не транслюються:
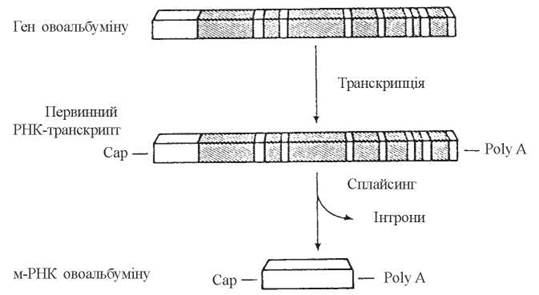
Рис. 20.17. Сплайсинг пре-мРНК гена яєчного альбуміну (Halkerston I.D.K., 1988).
Зріла мРНК, тобто така, що була піддана реакціям кепування на 5'-кінці, поліаденілування на 3'-кінці, сплайсингу та метилюванню окремих нуклеотидів, надходить з ядра в цитоплазму у вигляді рибонуклеопротеїдних комплексів, що здатні взаємодіяти з рибосомами в процесі трансляції.
* Термін «паліндром» («бігти назад» — грецьк.) означає слово або речення, яке читається однаково як справа наліво, так і зліва направо (наприклад: «Madam, I’m Adam» — англ.). В молекулярній генетиці під паліндромами розуміють ділянки полінуклеотидів (ДНК або РНК), які містять зворотні повтори нуклеотидних послідовностей з осьовою симетрією другого порядку.
У молекулах ДНК такі паліндроми можуть утворювати вторинні структури типу «хрестів» або «шпильок», які відіграють роль ділянок розпізнавання для певних ферментів (зокрема, рестриктаз — глава 23), сигналів термінації транскрипції. При транскрипції паліндромних ділянок утворюються РНК-транскрипти, що мають взаємокомплементарні послідовності, схильні до утворення «шпильок»(рис. 20.16).