Підручник - БІОЛОГІЧНА ХІМІЯ - Губський Ю.І. - 2000
Розділ I. БІОМОЛЕКУЛИ ТА КЛІТИННІ СТРУКТУРИ
ГЛАВА 2. БІЛКИ І ПЕПТИДИ
2.5. МЕТОДИ ВИДІЛЕННЯ ТА АНАЛІЗУ БІЛКІВ І ПЕПТИДІВ
2.5.2. Методи визначення амінокислотного складу та первинної структури білків і пептидів
Вивчення амінокислотного складу білків
Дослідження амінокислотного складу (ідентифікація окремих амінокислотних залишків та з’ясування їх кількісного складу) є першим етапом у визначенні первинної структури білка чи пептиду.
Етапи вивчення амінокислотного складу білків (пептидів):
а) гідроліз пептидного ланцюга білка чи пептиду, що досліджується.
Гідроліз пептидного ланцюга здійснюється шляхом кислотного розщеплення
пептидних зв’язків. Стандартною процедурою гідролізу є кип’ятіння білка в соляній кислоті (5,7 моль/л) при 105-110 °С протягом 24 год;
б) розділення амінокислот гідролізату.
Здійснюється шляхом іонообмінної хроматографії компонентів гідролізату на сульфополістиролових смолах, що несуть на своїй поверхні катіонні групування — SO3H-Na+. При пропусканні через хроматографічну колонку, що заповнена сульфополістиролом, суміші амінокислот останні сорбуються на певних рівнях колонки. Подальше промивання колонки буферними розчинами з різними значеннями рН призводить до вимивання (елюції) певних амінокислот;
в) ідентифікація та кількісне визначення окремих амінокислот.
Здійснюється за допомогою реакції з нінгідрином або флуорескаміном, які дають при взаємодії з амінокислотами відповідні кольорові або флуоресцуючі комплекси (див. розділ 2.2).
Метод кількісного аналізу амінокислотного складу білків та пептидів був уперше запропонований у 1958 р. У. Стейном (W. Stein) та С. Муром (S. Moore) і в наш час реалізується за допомогою автоматичних амінокислотних аналізаторів.
Розшифровка первинної структури білків і пептидів
Визначення послідовності амінокислотних залишків у молекулах білків та пептидів (розшифровка первинної структури) складається з таких етапів:
1. Аналіз N- та С-кінцевих амінокислотних залишків
Оскільки в поліпептидному ланцюзі, що формує первинну структуру будь-якого білка, на одному кінці розташована вільна α-NН2-група, а на другому — вільна α-карбоксильна група, визначення N- та С-кінцевих амінокислотних залишків дозволяє оцінити кількість поліпептидних ланцюгів, що складають дану білкову молекулу.
Ідентифікація N-кінцевих амінокислот здійснюється шляхом використання хімічних реагентів, що ковалентно зв’язуються з кінцевою α-амінною групою пептидного ланцюга. Після подальшого кислотного гідролізу «міченого» пептиду хімічно модифікований N-термінальний амінокислотний залишок ідентифікується хроматографічним методом.
Для модифікації N-кінцевих амінокислот у білках та пептидах застосовують такі реагенти:
- 2,4-динитрофторбензол (ДНФБ) — реагент, який, взаємодіючи з α-аміногрупою кінцевої амінокислоти, утворює ДНФ-похідний білка чи пептиду. Подальший кислотний гідроліз продукту арилювання поліпептиду утворює суміш ДНФ-похідного N-кінцевої амінокислоти, яке ідентифікують хроматографічно, та вільних амінокислот, що входять до складу досліджуваного білка (рис. 2.15):
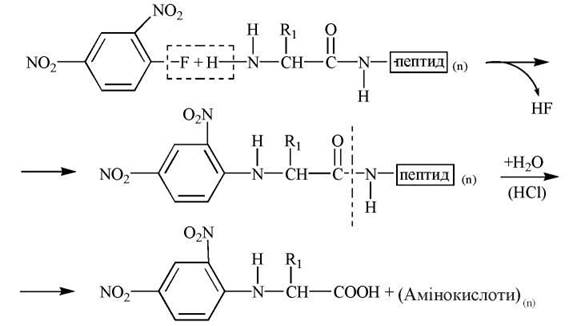
Рис. 2.15. Схема утворення ДНФ-похідних N-кінцевих амінокислот.
- дансил-хлорид (1-диметиламінонафталін-5-сульфохлорид, ДНС) — реагент, що в результаті взаємодії з N-кінцевою амінокислотою утворює ДНС-похідні білків та пептидів. Завдяки подальшому кислотному гідролізу ДНС-поліпептидів відбувається хроматографічна ідентифікація ДНС-амінокислот.
Ідентифікація С-кінцевих амінокислот здійснюється шляхом ферментативного гідролізу білків та пептидів карбоксипептидазами—протеолітичними ферментами, що специфічно відщеплюють від поліпептидного ланцюга С-кінцеву амінокислоту.
2. Фрагментація поліпептидного ланцюга та розділення пептидних фрагментів
Розщеплення досліджуваного білка чи пептиду на короткі фрагменти здійснюється, звичайно, методом ферментативного гідролізу із застосуванням протеолітичних
ферментів трипсину, хімотрипсину або інших протеаз (пепсину, еластази, палашу тощо). Пептидні фрагменти, що утворились внаслідок гідролізу, складаються з 10-20 амінокислотних залишків і можуть розділятися за допомогою одного з хроматографічних методів (зокрема, методу високоефективної рідинної хроматографії — ВЕРХ) або методом електрофорезу.
3. Визначення амінокислотних послідовностей у пептидах
Основним сучасним методом розшифровки амінокислотних послідовностей є метод ступінчастої деградації поліпептидних ланцюгів за допомогою фенілізотіоціанату (ФІТЦ).
Він був запропонований шведським біохіміком П. Едманом (P. Edman) у 1950-1956 рр. і складається з таких етапів:
- взаємодія ФІТЦ з α-аміногрупою N-кінцевої амінокислоти пептиду, що досліджується, з утворенням фенілтіокарбамоїл (ФТК)-пептиду;
- відщеплення в кислому середовищі від ФТК-пептиду фенілтіогідантоїнового (ФТГ)-похідного N-кінцевої амінокислоти та його ідентифікація (рис. 2.16):
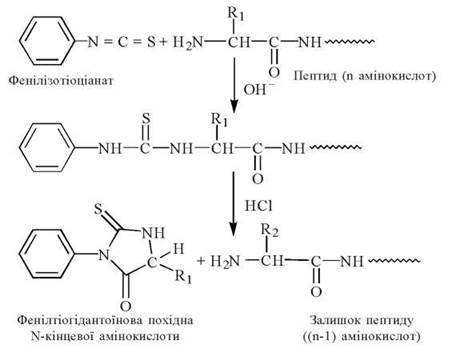
Рис. 2.16. Схема аналізу пептидів за методом П. Едмана.
Унікальною особливістю методу Едмана є послідовне вкорочення досліджуваного пептиду з N-кінця на один мономер без руйнування пептидних зв’язків між іншими амінокислотними залишками. Таким чином, стають можливими повторення зазначеної послідовності операцій та аналіз усього пептиду шляхом поступового відщеплення його N-кінцевих амінокислотних залишків. Автоматизація методу, що реалізована в спеціальному приладі — «сіквенаторі», від англ. — «sequence» — послідовність, дозволяє аналізувати з високою ефективністю продукти білкового гідролізу і природні пептиди.