СТРУКТУРА И СВОЙСТВА БИОМОЛЕКУЛ - А. Е. Земляков - 2017
13. НУКЛЕИНОВЫЕ КИСЛОТЫ
❖ Нуклеиновые кислоты - биополимеры, осуществляющие хранение и передачу генетической информации в живой клетке. С точки зрения высокомолекулярных соединений нуклеиновые кислоты представляют собой полимер, состоящий из нуклеотидов, соединенных фосфодиэфирной связью.
Различают рибонуклеиновые кислоты (РНК), имеющие широкий спектр биологического действия, в том числе, участвующие в процессе биосинтеза белка, и дезоксирибонуклеиновые кислоты (ДНК) - хранители генетической информации в живых организмах.
Нуклеиновые кислоты впервые были выделены в 1868 г. швейцарским биологом Ф. Мишером и названы «нуклеинами». Современный термин «нуклеиновые кислоты» ввел в научный оборот немецкий анатом и гистолог Р. Альтман в 1899 г.

ДНК эукариотных клеток представляют собой гигантские молекулы со сложной структурой, молекулярная масса которых может достигать 1010 - 1012 Да. Так ДНК человека содержит 2,9 • 109 пар оснований (п. о.), ДНК белой мыши - 2,3 • 109 п. о., а ДНК Plasmodium falciparum - 2,3 • 107 п. о.
ДНК прокариот обычно представлены кольцевыми хромосомами меньшего размера. Например, хромосома E. coli содержит 4,7 млн. п. о. Наряду с хромосомными ДНК эти бактерии имеют и другие ДНК - циклические плазмиды (4-50 тыс. п. о.), которые позволяют реализоваться ряду полезных и легко меняющихся свойств, например, устойчивости к определенным антибиотикам.
Для РНК различают матричные (мРНК), рибосомные (рРНК), транспортные (тРНК), вирусные и др. Так, в E. coli рибосомные РНК, содержащие от 100 до 3100 нуклеотидов, составляют около 82% от всей массы клеточной РНК, транспортные РНК (75-90 нуклеотидов) и матричные РНК (до 3000 нуклеотидов), соответственно, ~16% и ~2%. В последние десятилетия большой интерес вызывают рибозимы - РНК, обладающие ферментативным действием, а также регуляторные микро-РНК.
❖ Строение мононуклеотидов. В отличие от других мономеров природных полимеров (моносахаридов и аминокислот) нуклеотид имеет сложное строение и состоит из углевода, гетероциклического основания и остатка фосфорной кислоты.
✵ Гетероциклическое основание. В состав нуклеиновых кислот входят производные моноциклического азотсодержащего гетероцикла пиримидина: цитозин, урацил (только РНК) и тимин (только ДНК), а также бициклического азотсодержащего гетероциклического соединения пурина: аденин и гуанин. Для их обозначения широко используются соответствующие однобуквенные символы.
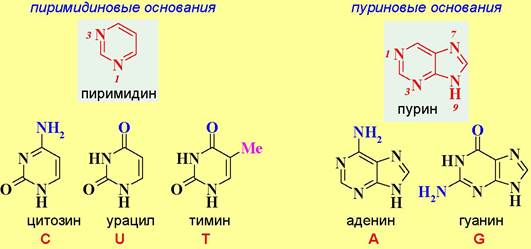
Структура основных гетероциклических оснований была установлена в период 1885-1901 г.г. немецким биохимиком А. Косселем - лауреатом Нобелевской премии 1910 г. по физиологии и медицине за цикл исследований, включающих работы по нуклеиновым кислотам.

В состав РНК также могут входить минорные нуклеозиды с другими гетероциклическими основаниями, в том числе метилированные и гидрированные производные.

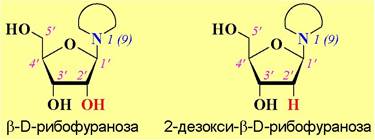
✵ Нуклеозид. Тип нуклеиновой кислоты определяется природой моносахарида: в состав РНК входит D-рибофураноза, а в ДНК - 2-дезокси-D- рибофураноза. Эти моносахариды были выявлены в составе нуклеиновых кислот, соответственно в 1909 г. и 1929 г., Фашелем (Федором) Левиным (в США - Фоэбус Левен) - американским биохимиком, родившимся и получившим врачебное образование в Российской империи.
Углевод соединен с гетероциклическим основанием β-N-гликозидной связью, соответственно с атомом N1 в пиримидиновых основаниях и N9 в пуриновых. Блок моносахарида и гетероциклического основания называют нуклеозидом. Для отличия от локантов гетероцикла для атомов углерода моносахарида используют цифры со штрихом.
Названия нуклеозидов образованы от названий соответствующих гетероциклических оснований. В случае дезоксирибозы используется приставка дезокси-. Исключение - тимидин и риботимидин.
Таблица 10. Названия и условные обозначения нуклеозидов
Основание |
Нуклеозиды на основе |
|
рибозы |
2-дезоксирибозы |
|
цитозин |
цитидин (С) |
дезоксицитидин (dС) |
урацил |
уридин(U) |
дезоксиуридин (dU) |
тимин |
риботимидин (Т) |
тимидин (dТ) |
аденин |
аденозин (А) |
дезоксиаденозин (dА) |
гуанин |
гуанозин (G) |
дезоксигуанозин (dG) |
Так как в рядах рибозидов и 2-дезоксирибозидов основные различия структуры связаны с азотсодержащим гетероциклом, то для их условного обозначения используются буквенные символы гетероциклических оснований с добавлением символа «d» в случае дезоксисахара.
✵ Нуклеотид. Фосфорная кислота может этерифицировать первичную гидроксильную группу моносахарида (нуклеозид-5'-фосфат), вторичную - нуклеозид-3'-фосфат, оба гидроксила одновременно - нуклеозид-3',5'- циклофосфат. Наряду с монофосфатами в природе широко распространены ди- и трифосфаты, например, нуклеозид-5'-трифосфаты. Примеры структур нуклеотидов и их сокращенные обозначения приведены ниже.

❖ Биологическая роль мононуклеотидов.
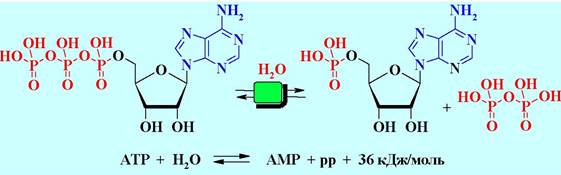
✵ Аденозинтрифосфат (АТР) - универсальный аккумулятор энергии. Перенос остатков фосфорной кислоты обеспечивает передачу энергии в биохимических системах. В качестве универсального аккумулятора энергии в клетке выступает АТР (рррА). При гидролизе связи Р-О между двумя фосфатными остатками выделяется большое количество энергии (~32 кДж/моль).

В биохимии ковалентные связи, гидролизующиеся с выделением энергии больше 30 кДж/моль, называют макроэргическими связями. За счет выделившейся энергии протекают реакции, нуждающиеся в ней. И наоборот, если в системе выделяется энергия, то она расходуется на синтез АТР.
Гидролиз АТР играет важнейшую роль при реализации огромного количества биохимических процессов: мышечного сокращения, фотосинтеза, биолюминесценции, биосинтеза белков, нуклеиновых кислот, сложных углеводов, липидов и т. д.
Большое количество энергии также выделяется и при гидролизе АТР до аденозинмонофосфата (АМР) и пирофосфата.
В ряде биохимических процессов, например, в трансляции, роль аккумулятора энергии выполняет гуанозинтрифосфат (GTP).
✵ Роль АТР в биохимическом фосфорилировании и аденилировани.
АТР играет огромную роль в биохимических процессах, связанные с переносом части молекулы АТР (фосфата, дифосфата или аденозифосфата) на акцепторную молекулу. Эти АТР-зависимые реакции могут протекать как процессы фосфорилирования (а), пирофосфорилирования (б) или аденилирования (в). Важную роль в этих процессах играет ион Mg2+. Считается, что он повышает реакционную способность фосфата и участвует в определении направления атаки.

Во всех АТР-зависимых биосинтетических процессах образование ковалентной связи между двумя субстратными молекулами сопряжено с расщеплением одной из пирофосфатных связей АТР. Первая группа этих реакции протекает с участием ферментов фосфотрансфераз (киназ) при этом на субстрат переносится монофосфатная группа и выделяется ADP. Например, при биосинтезе нуклеотидов на начальном этапе происходит образование рибозо- 5-фосфата из D-рибозы.
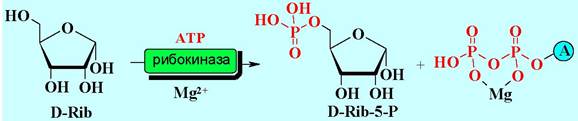
Во вторую группу входят ферменты, катализирующие реакции переноса пирофосфата, сопровождаемые расщеплением АТР до АМР, например, в биосинтезе кофермента кокарбоксилазы.
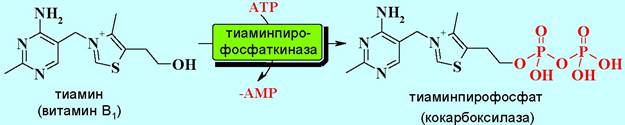
Ферменты третьей группы катализируют две последовательные реакции, включающие промежуточное образование ациладенилата, связанного с ферментом. В конечном результате АТР расщепляется на АМР и пирофосфат. Примером такой реакции может послужить образование аминоацил-тРНК.

✵ Нуклеотиды - коферменты биосинтеза сахаров и липидов. Уридиннуклеотидные коферменты играют решающую роль в обмене углеводов. Повсеместно в природе распространены уридиндифосфатсахара (UDР- сахара), у которых нуклеотидфосфатный остаток присоединен по гликозидному центру углевода, например, D-глюкозо-1-уридиндифосфат (UDР- глюкоза).
UDР-сахара получаются в результате реакции между UТР и 1-фосфатами сахаров, катализируемой ферментами уридилтрансферазами.
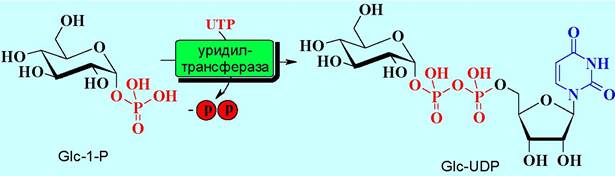
В ферментативном катализе уридиновые коферменты как соединения с активированным гликозидным гидроксилом могут участвовать в различных реакциях переноса гликозильного остатка (реакции гликозидирования) с образованием гликозидов, олиго- и полисахаридов.
В этих процессах UDР-сахара подобны ациладенилатам, участвующим в реакциях переноса ацильных групп. Например, с помощью UDР-глюкозы осуществляется перенос глюкозильных остатков на фруктозу, что дает дисахарид сахарозу, на салициловый альдегид с образованием о- формилфенилглюкозы (биохимического предшественника гликозида салицина) или на концевой остаток глюкозы в молекуле гликогена, что приводит к удлинению полисахаридной цепи.

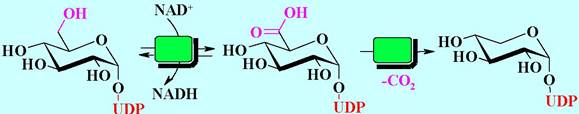
Для второго общего типа реакций UDР-сахаров характерны химические превращения в молекуле самого сахара. Например, UDP-глюкозо-4-эпимераза при участии никотинамидадениндинуклеотида (NAD+) катализирует взаимопревращение UDР-глюкозы и UDР-галактозы.

Другими примерами подобных процессов могут служить окисление UDР-глюкозы до UDР-глюкуроновой кислоты и декарбоксилирование UDР- глюкуроновой кислоты до UDР-ксилозы.
Аналогично уридиновым нуклеотидам цитидиновые нуклеотиды, например, СDР-холин, участвуют в переносе групп в биосинтезе фосфолипидов. Сам СDР-холин синтезируется в реакции СТР и соответствующего холинфосфата. Следует отметить, что реакции с участием цитидиновых нуклеотидов протекают с расщеплением пирофосфатной связи.
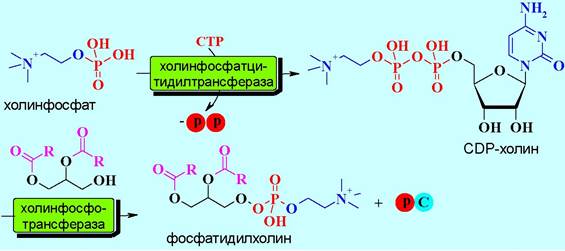
✵ Мононуклеотиды в структуре коферментов. В структуру ряда важнейших коферментов входит адениновый фрагмент, присоединенный к субстрату через пирофосфатный мостик. Примерами таких соединений могут послужить кофермент А, участвующий в процессах биологического ацилирования (например, в биосинтезе жирных кислот), а также никотинамидный кофермент NAD+ и флавинадениндифосфат (FAD), выполняющие функцию коферментов окислительно-восстановительных реакций.

✵ Нуклеотидциклофосфаты как вторичные мессенджеры. 3’,5’- Циклофосфаты аденозина и гуанозина (сАМР и сGМР) играют роль внутриклеточных медиаторов (мессенджеров) биохимических реакций. В частности, увеличение концентрации сАМР приводит к активации внутриклеточных протеинкиназ путем блокирования регуляторных (ингибиторных) субъединиц фермента.
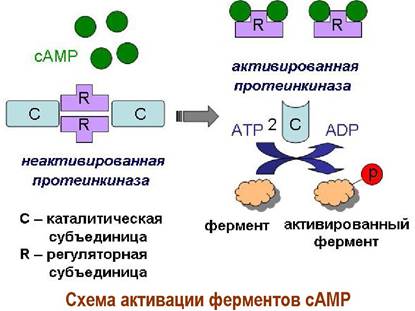
Протеинкиназы в свою очередь переводят специфические ферменты в активное состояние путем их фосфорилирования и тем самым запускают каскад биохимических реакций.
✵ Мононуклеотидтрифосфаты - субстраты ферментов полимеразных реакций. АТР, как и другие нуклеозидтрифосфаты служат субстратами различных ДНК- и РНК-полимераз. В следующей главе будут рассмотрены процессы репликации и транскрипции, протекающие с участием таких ферментов.
❖ Строение олигонуклеотидов. Остаток фосфорной кислоты у С3' одного нуклеотида соединяется с гидроксильной группой у С5’ другого нуклеотида и т. д. Таким образом, нуклеозиды соединены между собой 3' —> 5' фосфодиэфирной связью. Нуклеотид со свободной гидроксильной группой у С5' называется 5-концевым, а со свободным гидроксилом у С3' - 3'- концевым.
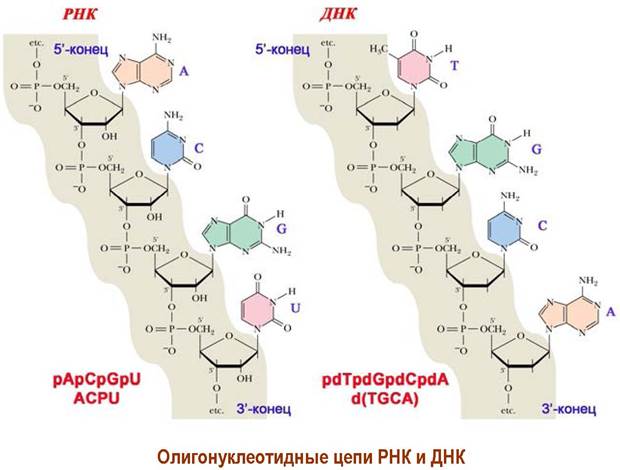
Именно природа гетероциклического компонента определяет нуклеотид и, следовательно, кодирует его свойства. Последовательность нуклеотидов является таким же химическим языком живой природы, как и аминокислотная последовательность белков. Для записи нуклеотидных последовательностей можно воспользоваться сокращенными обозначениями нуклеотидов, а учитывая общность углевод-фосфатного скелета в ДНК и РНК, то достаточно перечислить гетероциклические основания, начиная с 5'-конца. Для дезоксирибонуклеотидной последовательности перед записью помещают знак «d».
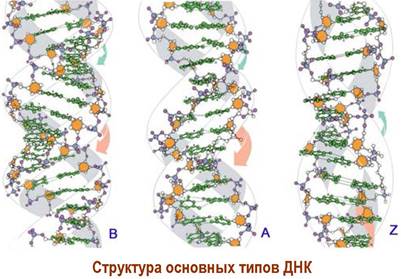
❖ Вторичная структура ДНК. К середине 20 века была установлена химическая структура ДНК, также было выявлено, что длина молекулы много больше ее диаметра, гетероциклические основания расположены перпендикулярно оси молекулы. Кроме того, было обнаружено, что во всех ДНК количество пуриновых оснований равно количеству пиримидиновых оснований (правило Чаргаффа). На основании этих данных, а также сравнения результатов рентгеноструктурных исследований ДНК с различными пространственными моделями в 1953 г. Дж. Уотсон и Ф. Крик открыли пространственную структуру ДНК. За это открытие они в 1962 г. совместно с английским рентгенографом М. Уилкинсом были удостоены Нобелевской премии по физиологии и медицине.

В пространстве две цепи ДНК образуют правовинтовую двойную спираль, в которой внешняя оболочка спирали образована гидрофильными остатками углевод-фосфатов, а во внутренней области находятся гидрофобные гетероциклы. Цепи в двойной спирали антипараллельны, т. е. 5'-конец одной цепи находится рядом с 3'-концом второй, и комплементарны - остатки С, G и А, Т соединены попарно водородными связями.

Плоскости гетероциклов параллельны друг другу и перпендикулярны оси спирали. Именно взаимодействие π-электронных систем гетероциклических оснований в «стопках» гетероциклов («стэкинг»-взаимодействия), наряду с водородными связями комплементарных пар и структурирующим действием воды (гидрофильная часть молекулы окружена водой, а гидрофобная убрана вовнутрь), является определяющим в самоорганизации ДНК в виде двойной спирали.
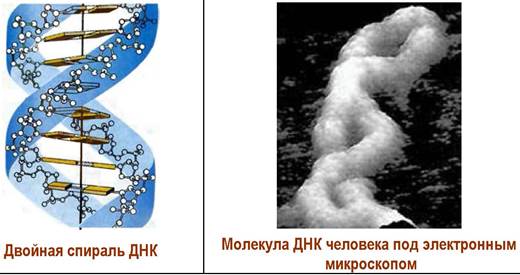
В водных растворах ДНК существует в В-форме, у которой один виток содержит 10 пар оснований и имеет длину 3,4 нм. Диаметр сечения молекулы ~2,0 нм. А-форма ДНК более плотно упакована - один виток образован 11 п. о., плоскости которых наклонены на 20° по сравнению с В-формой. Также выявлена 2-форма, которая в отличие от первых двух представляет собой левую спираль с 12 п. о. на один виток. Такая спираль имеет меньший диаметр сечения по сравнению с В-формой - 1,8 нм и 2,4 нм соответственно.
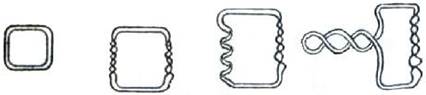
❖ Суперспирализация кольцевых ДНК. Во многих вирусах, бактериях, митохондриях двухцепочечная молекула ДНК находится в циклической (кольцевой) форме. В зависимости от внешних факторов (рН среды, ионная сила раствора, температура) цепь нуклеиновой кислоты может дополнительно закручиваться или накручиваться вокруг другого участка. Такая сверхспиральная ДНК была обнаружена электронной микроскопией.
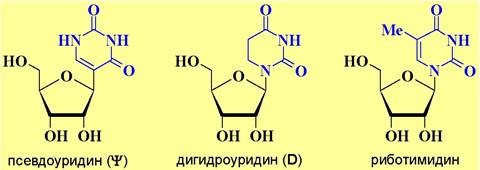
❖ Строение тРНК. тРНК участвуют в процессе трансляции, обеспечивая целенаправленную доставку аминокислот к рибосомальному комплексу. Молекулярная масса таких молекул составляет ~23-30 кДа. Ее структура включает 75-90 мононуклеотидов, из которых примерно 10% минорных нуклеотидов, в том числе, метилированные нуклеотиды, риботимидин, дигидроуридин, псевдоуридин. Наличие минорных нуклеотидов с одной стороны защищает тРНК от действия нуклеаз, а с другой стороны из-за невозможности образовывать комплементарные пары обеспечивают пространственную организацию молекулы, в которой одноцепочечные участки чередуются с двухцепочечными - «клеверный лист».
На 3’-конце нуклеиновой цепи содержится тринуклеотид С-С-А-ОН. Гидроксильная группа концевого остатка аденозина способна ацилироваться аминокислотой. На 5’-конце остаток гуанозина дополнительно фосфорилирован. В структуре тРНК выделяют два важных участка: аминоацильный (АА), к которому присоединяется аминокислота, и антикодоновый (АС), отвечающий за считывание информации с матричной РНК. В пространстве цепь нуклеиновой кислоты тРНК образует трехмерную структуру, напоминающую объемную букву Г.

❖ Рибозимы. Данный термин образован от сочетания понятий «рибонуклеиновая кислота» и «энзим» и обозначает способность РНК катализировать биохимические процессы. Каталитическая активность РНК была открыта в 1982 г. американским молекулярным биологом Т. Чеком в процессе изучения сплайсинга РНК, и в 1983 г. - канадским ученым С. Олтменом у бактериальной рибонуклеазы Р. До этого времени считалось, что биокатализ присущ только белковым молекулам. За открытие рибозимов Т. Чек и С. Олтмен в 1989 г. получили Нобелевскую премию по химии.

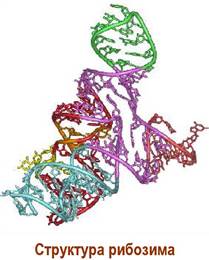
Впоследствии выяснилось, что и фрагменты рибосомы в процессе биосинтеза белка проявляют свойства рибозима, катализируя рост пептидной цепи.
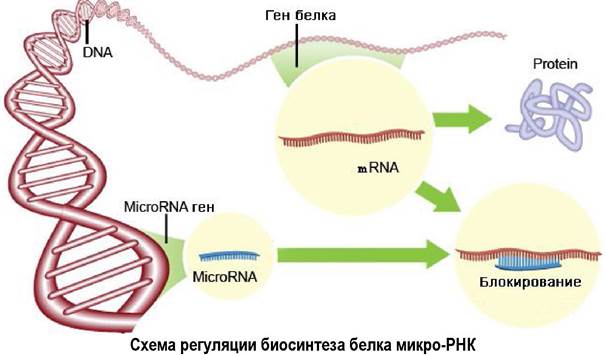
❖ Микро-РНК. В начале 1990-х годов было установлено, что рибонуклеиновые кислоты с малым числом нуклеотидов (до 22 остатков) кодируются специальными участками ДНК и могут выполнять регуляторную функцию в процессе трансляции. Считается, что такие микро-РНК могут служить маркерами в процессе выявления ряда опасных заболеваний.