Общая биотехнология: Курс лекций Часть II - Блинов В.А. 2004
Медицинская биотехнология
♦ Производство вакцин, ферментов и диагностических препаратов.
♦ Производство гормонов, интерферона и иммуномодуляторов.
♦ Микробиологическая трансформация органических соединений.
Производство вакцин, ферментов и диагностических препаратов. В настоящее время производится свыше 100 различных бактериальных и вирусных иммунопрофилактических и лечебных препаратов. Вакцинация позволила ликвидировать натуральную оспу, уменьшить распространение бешенства, полиомиелита, желтой лихорадки. Изготавливаются вакцины против гриппа, гепатитов, герпесов, свинки, кори, острых респираторных заболеваний. Разрабатываются вакцины против болезней сельскохозяйственных животных — ящура, африканской болезни лошадей, овечьей болезни «синего языка», трипаносомозов. Вакцины, изготавливают на основе ослабленных, инактивированных или дезинтегрированных возбудителей болезней.
Вакцины. Они могут быть корпускулярными - изготавливаются из убитых или ослабленных живых клеток патогенов и растворимыми - так называемые химические вакцины. В настоящее время известна следующая классификация вакцин:
♦ вакцины из клеток прокариот и эукариот: живые и убитые;
♦ вакцины из клеточных компонентов: полисахаридные и рибосомальные;
♦ вакцины из продуктов обмена клеток: анатоксины - различные экзотоксины микроорганизмов, обезвреженные формалином, но сохранившие антигенные свойства. Их используют для получения антитоксических сывороток;
♦ вакцины вирусные: а) из вирионов - живые и инактивированные; б) из компонентов вирионов - субъединичные;
♦ вакцины генноинженерные.
Вакцины могут производиться в виде микропрепаратов или в ассоциированной форме для создания иммунитета против нескольких инфекций. Основные требования к вакцинам - высокая иммуногенность и безвредность для людей и животных.
Долгое время для изготовления вакцин использовали органы больных животных: лимфатические железы, селезенка и др. В настоящее время многие вакцины производят микробиологическим путем, в частности, используя рекомбинантные микроорганизмы, которые продуцируют только один необходимый антиген. Уже получены вакцины против ящура, гепатита В, бешенства, гриппа и других болезней. Перспективными объектами в этом отношении служат дрожжи пли клетки животных. Как правило, используют монослойные культуры. При этом клетки развиваются на поверхности специальных носителей (ДЭАЭ-сефадексы, полистерены, полипропилены, стекло и др.). Или же клетки суспендируют в специальной среде. Этот метод похож на глубинное культивирование микроорганизмов. Таким методом получают, например, моноклональные антитела.
Приведем технологию получения живых вакцин:
♦ размножение вакцинного штамма в несколько пассажей от культуры на средах в пробирках и до ферментатора в оптимальных условиях. Режим культивирования, как правило, периодический;
♦ сепарирование клеток от культуральной жидкости, например, центрифугированием;
♦ ресуспендирование клеток; для вакцины БЦЖ, например, используется смесь сахарозы и желатина а для туляремийной вакцины - вода и т.д.
♦ розлив суспензии по ампулам или флаконам;
♦ лиофильное высушивание, запаивание ампул или укупоривание флаконов.
Живые вакцины не должны содержать консервантов или других ингибиторов роста и развития вакцинных штаммов. В России изготавливают следующие живые вакцины: М-44 против лихорадки Ку, бруцеллезную накожную, БЦЖ для внутрикожного применения, сибиреязвенную (для людей) - вакцина СТИ для накожного или подкожного применения, сыпнотифозную комбинированную, туляремийную накожную, чумную. Живые вакцины вводят обычно однократно.
Вакцины убитые из клеток патогенов - это взвесь клеток болезнетворных бактерий или грибов, обладающих выраженной иммуногенностью, но лишенные патогенности. Принципы технологии таких вакцин следующие: выращивание штамма на питательной среде, обезвреживание клеток (прогревание, обработка формалином, ацетоном, этанолом), сепарирование клеток, ресуспендирование клеток в изотоническом растворе натрия хлорида до определенной концентрации, контроль на отсутствие живых клеток патогена, на иммуногенность и др. Инактивированные разведенные взвеси микробов разливают в ампулы или флаконы и хранят при 2 10 °С. Основной способ применения убитых вакцин - подкожные инъекции. Таким способом подготавливают убитые вакцины против бруцеллеза, брюшного тифа, гонореи, дизентерии, коклюша, лептоспироза, паратифов, холеры.
Современные биотехнологические разработки предусматривают изготовление рекомбинантных вакцин и вакцин-антигенов. Вакцины обоих типов основаны на генноинженерном подходе. Для получения рекомбинантных вакцин обычно используют вирус коровьей оспы. В его ДНК встраивают чужеродные гены, кодирующие имммуногенные белки различных возбудителей: гемагглютинин вируса гриппа, гликопротеин D вируса герпеса, поверхностный антиген вируса гепатита В, антиген малярийного плазмодия. Это очень актуальная проблема. Например, носителей вируса гепатита В около 200 млн человек. От 5 до 15 % взрослых и до 95 % детей после перенесения острой инфекции на всю жизнь остаются хроническими носителями возбудителя. Вирус приводит к развитию острого гепатита, цирроза печени, гепатоцеллюлярной карциномы. Вирус распространяется только путем сывороточных инъекций, и для него нет чувствительных тканей. Из млекопитающих только шимпанзе поражаются этим вирусом и только в клетках культур этих тканей высших животных введенные гены гепатита В образуют полноценные иммуногенные частицы.
Достоинством рекомбинантных вакцин является возможность создания поливалентных препаратов на основе ДНК вируса оспы. Иными словами, оказывается возможной одномоментная комплексная иммунизация крупного рогатого скота и других видов животных против всех опасных инфекций данной местности.
Вакцины-антигены получают, клонируя гены возбудителя болезни в Е. coli, дрожжах, клетках насекомых и млекопитающих. В настоящее время клонирован ген поверхностного антигена HBS-вируса гепатита (сывороточного гепатита), ген оболочки VPI-вируса ящура. Такие вакцины высокостабильны при хранении и перевозке, сравнительно просты в использовании, содержат минимальное количество белка и поэтому малоопасны как аллергены, они гарантированы от остаточной вирулентности. Недостатком их является низкая иммуногенность. Для повышения иммуногенности добавляют адыованты, иммобилизуют вакцины на носителях или включают вакцины в липосомы.
Ферменты. В медицине они используются весьма широко: для растворения тромбов, лечения наследственных заболеваний, удаления денатурированных структур, клеточных и тканевых фрагментов, освобождения организма от токсических вирусов и др. Так, тромболитические ферменты (стрептокиназа, урокиназа), в т.ч. и в иммобилизованной форме (стрептодеказа) используются для лечения больных тромбозом конечностей, легких, коронарных сосудов сердца. Протеазы применяются для очистки гнойно-некротических очагов, для лечения ожогов. Иммобилизованная L-аспарагиназа применяется для лечения лейкоза. Супероксиддисмутаза (СОД), полученная генно-инженерным путем, используется для терапии болезней, причиной которых являются активные радикалы кислорода: ишемическая болезнь сердца, артриты, интоксикация кислородом, при пересадке почек и т.д.
Много внимания уделяется ингибиторам ферментов. Например, при септических процессах, инфаркте миокарда, эмфиземе легких, панкреатитах эффективными оказываются ингибиторы протеаз, полученные из актиномицетов (лейпептин, антипаин, химостатин), генноинженерных штаммов Е. coli (эглин) и дрожжей (а-1-антитрипсин). При диабете добиваются снижения уровня глюкозы в крови больных с помощью ингибиторов кишечных инвертаз и амилаз, которые превращают крахмал и сахарозу в глюкозу. В настоящее время описано более 100 наследственных заболеваний, обусловленных дефицитом какого-либо фермента. Эти заболевания (например, болезнь Гоше) пытаются лечить, применяя ферменты (генотерапия).
Диагностические препараты. Высокоспецифические моноклональные антитела (МКА) используются для диагностики лепры, холеры, заболеваний, вызванных патогенными простейшими: малярии, трипаносомоза, лейшманиоза, токсоплазмоза, вирусных опухолей человека.
Зонды нуклеиновых кислот весьма эффективны при выявлении генетических дефектов. Короткие зонды получают химическим синтезом, а длинные, выделяя ДНК из интересующего объекта. Затем ДНК расщепляют рестриктазой, отбирают нужные участки, включают отдельные фрагменты в плазмиды, размножают их и маркируют. Зонды эффективны для пренатальной диагностики, например для своевременного прерывания беремен мости, если у плода предполагается наличие генетических дефектов. Зонды используются также для выявления ряда РНК- и ДНК-содержащих вирусов.
Производство гормонов, интерферона и иммуномодуляторов. Долгое время гормоны получали из крови, органов и тканей животных и человека. Для получения продукта нужно было большое количество материала. Так, соматотропний гормон человека (СТГ) получали из гипофиза людей, где его содержится не более 4 мг. Для лечения одного ребенка, страдающего карликовостью, требуется около 7 мг СТГ в неделю, а курс лечения составляет несколько лет. Сейчас с помощью генноинженерного штамма Е. coli получают до 100 мг СТГ на 1 л среды культивирования. Это открывает новые возможности для лечения карликовости и борьбы с низкорослостью. Кроме того, СТГ способствует заживлению ран и ожогов, регулирует обмен белков, углеводов и жиров, а также Са2+ в костной ткани.
Как известно, основным средством лечения сахарного диабета является инсулин. Этот гормон получают из поджелудочной железы быка и свиньи. Такой инсулин отличается от человеческого 1-3 аминокислотными остатками, а это вызывает у людей, особенно детей, различные виды аллергии. Инсулин, получаемый из животных, стоит дорого, а его ресурсы ограничены. Химически синтезированный инсулин оказался еще дороже. С 1982 г. производится генноинженерный инсулин на основе раздельного синтеза Е. coli его А- и В-цепей. Полученный инсулин идентичен человеческому, стоимость его значительно снизилась. Кроме того, генноинженерный инсулин устраняет осложнения сахарного диабета (повреждение почек и сетчатки глаз), не вызывает иммунных реакций, способствует быстрому выделению токсичных кетонов из крови, его требуется меньше, чем при использовании инсулина быков и свиней.
В настоящее время генноинженерным путем производят и другие пептидные гормоны: фолликулостимулирующий, лютеинизирующий, а также олигопептидные гормоны нервной системы: энкефалины и эндорфины.
Интерфероны. Они продуцируются клетками человека и животных в ответ на инфицирование вирусами. Интерфероны обладают антивирусной активностью, препятствуя проникновению вирусных частиц в клетку. Они стимулирует деятельность иммунной системы и препятствуют размножению клетарный иммуноглобулин, анти-Rho(Д) - иммуноглобулин человека и лимфоцитарные кейлоны).
К другим факторам иммунитета относятся лимфоцитарные противораковые препараты, получаемые с помощью рекомбинантных микроорганизмов: интерлейкины, лимфотоксины, человеческий лимфорегулин. Последний препарат подавляет рост саркомных и лейкозных клеток и стимулирует активность натуральных киллеров.
Интерлейкины-полипептиды (-150 аминокислотных остатков) участвуют в организации иммунного ответа. Так. интерлейкин-1 образуется макрофагами и стимулирует размножение T-хелперов, которые в свою очередь, продуцируют интерлейкин-2. Он вызывает пролиферацию различных субпопуляций T-лимфоцнтов: T-киллеров, T-хелперов, T-супрессоров, а также В-лимфоцитов, продуцентов антител. Под влиянием интерлейкина-2 из T-лимфоцитов высвобождаются регуляторные белки - лимфокины, активирующие звенья иммунной системы.
Микробиологическая трансформация органических соединений. Область применения микрорганизмов для трансформации органических соединений предполагает два направления:
♦ полный биосинтез микроорганизмами БАБ и различных продуктов (антибиотиков, ферментов, витаминов, стеринов, аминокислот и др.);
♦ совместное использование отдельных химических и микробиологических стадий в многоэтапном синтезе лекарственных препаратов и других ценных продуктов.
Применение микроорганизмов основано на том, что они способны осуществлять в одну стадию важнейшие превращения. для которых требуется до 20 химических стадий. Кроме того, они позволяют проводить реакции, которые пока невозможно осуществить химическим путем. Основными процессами микробиологической трансформации являются; окисление, восстановление, декарбоксилирование, дезаминирование, образование гликозидов, гидролиз, метилирование, этерификация, дегидрирование, конденсация, аминирование, ацетилирование, амидирование, деметоксилирование, нуклеотидация, галогенирование, диметилирование, ассиметризация, рацемизация, изомеризация. Общей чертой всех этих процессов является изменение молекулярной структуры трансформируемого вещества, а не синтез молекулы de novo.
Микробиологические трансформации стероидов. В этой области достоинство микроорганизмов проявляется особенно ярко и известно давно. Так, микрофлора кишечника млекопитающих превращает холестерин в копростерин, а холевую кислоту - в дезоксихолевую. В 1948 г. впервые осуществлено введение гидроксильной группы в молекулу стероида микробиологическим путем.
Хорошо изученным стерином является холестерин. В организме животных и человека из холестерина образуются три важные группы гормонов: прогестины, половые гормоны и гормоны коры надпочечников. В качестве сырья для получения ряда этих лекарственных средств используются: диосгенин (из растения диоскореи), стигмастерин из соевых бобов и ß-сигостерин, источником которого служит тростник, хлопковое масло, зародыши пшеницы и др. Приведем технологическую схему производства гидрокортизона.
Получение гидрокортизона осуществляется с помощью Curvularia linata и включает следующие стадии:
1. Выращивание трансформирующей культуры проводится в строго стерильных условиях. Проводят три последовательные генерации этой культуры на среде, содержащей сахарозу, дрожжевой автолизат и сложный набор органических солей:
![]()
2. Трансформация вещества S (4-прегнен-17а,21-диол- 3,20-дион) - ключевого соединения в синтезе гидрокортизона, кортизона и преднизолона. Процесс проводится в стерильных условиях. Мицелий измельчается на микромельнице и получают суспензию с содержанием вещества S 1 г/л. Для борьбы с микробами-контаминантами используют антибиотики, необходимо перемешивание, аэрация и пеногашение.
3. Выделение продукта трансформации - гидрокортизона. Культуральная жидкость вместе с мицелием поступает на сепарацию. Отделенный мицелий промывается, промывные воды присоединяются к основной культуральной жидкости. Затем проводится экстракция-сепарация продукта трансформации из водной среды органическим растворителем. Экстракт, осветленный активированным углем, упаривается, осветляется, снова упаривается досуха и промывается.
Трансформация гидрокортизона в преднизолон осуществляется с помощью Mycobacterium globiforme. Культура выращивается так же, как и при получении гидрокортизона. Выделение преднизолона осуществляется путем экстракции-сепарации из культуральной жидкости, отличаясь лишь набором растворителей. Описан процесс, когда измельченный порошок кортизона культивируется с Arthrobacter simplex в течение 5 дней. При этом получается преднизолон с выходом 93 %. Дегидрирование микрокристаллического гидрокортизона происходит но схеме: гидрокортизон (кристаллы) → гидрокортизон (раствор) → преднизолон (раствор) → преднизолон (кристаллы). Преднизолон, накапливаясь, кристаллизуется в виде игл. В настоящее время все шире используется трансформация стероидных соединений с помощью иммобилизованных клеток.
Кортизол и его синтетические аналоги (преднизолон, дексаметазон) принадлежат к числу современных средств экстренной терапии, благодаря их уникальному противовоспалительному, десенсибилизующему и противошоковому действию.
Микробиологическая трансформация сорбита. Углеводы являются естественными субстратами для большинства микроорганизмов. Их превращение включает несколько этапов: окислительные трансформации углеводов (окисление полиолов, получение альдоновых кислот), восстановление и изомеризацию углеводов.
В промышленном масштабе применяются два процесса окисления полиолов: превращение глицерина в диоксиацетон и превращение D-сорбита в Z-сорбозу. Последняя реакция является одной из стадий синтеза аскорбиновой кислоты и протекает по следующей схеме:

В производстве применяется метод глубинного культивирования. Инокулят - суспензия клеток Acetobacter suboxydafis — выращивается на среде, включающей сорбит, глюкозу, дрожжевой экстракт и СаСО3. В 15-20 %-е растворы D-сорбита, содержащие трансформирующую культуру и необходимые для роста витамины, пропускают воздух через распылительные системы. При температуре 30 °С через 24 ч Z-сорбоза получается с 93 %-м выходом в растворе.
В конце процесса ферментации раствор, содержащий сорбозу (культуральная жидкость), обесцвечивается активированным углем, фильтруется, в том числе на фильтр-прессе.
Фильтрат концентрируют в вакууме до сиропообразной массы, которая кристаллизуется при 15 °С. Кристаллы отделяют центрифугированием, промывают ледяной водой и сушат. Вторая порция L-сорбозы получается из маточника и промывается.
Способность окислять сорбит в сорбозу установлена не только у A. suboxydans, но и других уксуснокислых бактерий: A. melanogenum, A. ketogenum, A. gluconicum, а также у Bacterium orleanense, Bacterium xylinoides и др.
Трансформация гетероциклических соединений. Промежуточные продукты гетероциклических соединений, особенно триптофана, представляют с медицинской точки зрения особый интерес: триптамин, серотонин, индолил-3-уксусная кислота и др.
В основном трансформация производных индола происходит путем гидроксилирования.
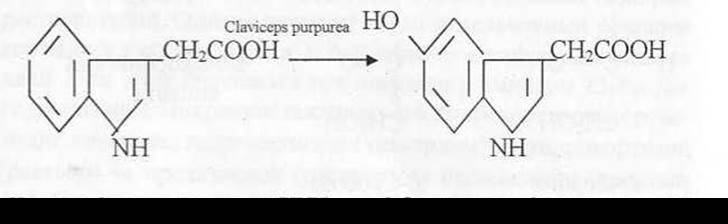
Под влиянием Aspergillus niger триптамин превращается в 5-окси-ИУК. Видимо, таким путем микроорганизмы проводят детоксикацию гетероауксина. Гидроксилазная активность многих грибов используется для синтеза труднодоступных 5- оксииндолов. A. niger осуществляет также окислительное дезаминирование N-зaмещенных аналогов триптамина.
Трансформация производных пиридина. Никотиновую кислоту и ее амид обычно получают химическим путем. Однако уже разработаны и микробиологические подходы к трансформации соответствующих субстратов.
