Биотехнология - Ю.О. Сазыкин 2006
Частная биотехнология
Проблемы поиска, создания и применения антибиотиков в медицинской практике
Биотехнология антибиотиков
Фактически ни один продуцент, выделенный из почвы или другого природного источника, непосредственно в производстве использован быть не может. Природный штамм образует лишь незначительные количества антибиотиков. Обработкой мутагенами и многоступенчатым отбором (селекцией) активных вариантов обычно удается повысить активность штамма, так как количество образуемого им антибиотика увеличивается в тысячи и даже десятки тысяч раз. Например, у продуцента пенициллина в результате десятков лет селекционной работы во многих лабораториях разных стран мира активность повысилась от десятков микрограммов до десятых долей грамма антибиотика в миллилитре среды.
У промышленных мутантных штаммов (рабочий термин «суперпродуценты») антибиотик, образуемый в огромном количестве, не должен влиять:
* на собственный биосинтез;
* жизнедеятельность своего продуцента.
Как известно, избыточное образование метаболита ведет к прекращению его биосинтеза по принципу обратной связи. В случае суперпродуцентов механизм обратной связи исключен.
Жизнедеятельность суперпродуцентов сохраняется в результате разных причин:
* максимум концентрации антибиотика достигается, когда рост культуры либо завершается, либо практически уже завершен;
* антибиотик синтезируется в местах клетки, отделенных от мест локализации жизненно важных метаболических процессов;
* после выхода антибиотика из мицелия в среду вновь в мицелий он не проникает, т.е. транспорт антибиотика через оболочку продуцента имеет одностороннее направление.
Однако свойство образовывать избыточные количества антибиотиков нестойко. Оно легко теряется полностью или частично, поэтому промышленные продуценты хранят в особых условиях, периодически проверяя их активность. При необходимости их рассевают на отдельные колонии, из которых затем отбираются наиболее активные.
При разработке биотехнологии антибиотиков учитываются общие свойства продуцентов, а также, что каждый антибиотик является конечным продуктом длинной цепи специфических ферментативных реакций.
Продуценты большинства антибиотиков, в том числе важнейших для медицинской практики, являются аэробами или (реже) факультативными анаэробами. В связи с этим в первые годы после получения пенициллина, грамицидина С и некоторых других веществ их продуценты выращивали на поверхности жидкой питательной среды в стационарных условиях в микробиологических матрацах или колбах, помещаемых в термостат или термостатные комнаты. Культура продуцента росла только на поверхности среды. Этот способ был трудоемок, не экономичен и не позволял нарабатывать антибиотик в больших количествах. Очень скоро поверхностная ферментация была заменена на глубинную. Через питательную среду пропускали воздух и среду непрерывно перемешивали. Это позволило использовать для роста продуцента весь объем среды.
Только глубинная ферментация создала возможность современного биотехнологического производства с выпуском конечного продукта в большом количестве.
Кривые накопления биомассы продуцента и антибиотика в культуральной жидкости, а также и в мицелии продуцента, не совпадают во времени. Вторая кривая значительно запаздывает (рис. 13).
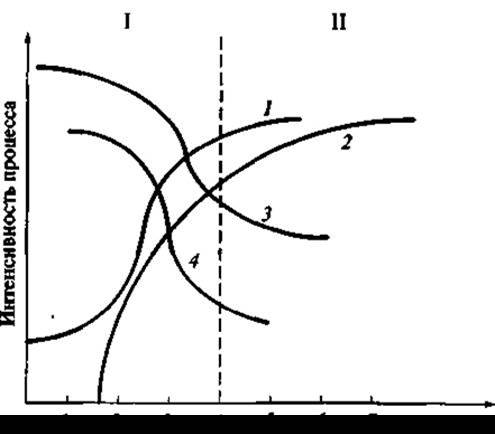
Рис. 13. Особенности ферментационного процесса при получении антибиотиков:
1 — трофофаза; II — идиофаза; 1 — биомасса; 2 — антибиотик; 3 — углеводы; 4 — источники азота
Это относится к продуцентам всех важнейших антибиотиков: грибам, актиномицетам, споровым бактериям. Первая фаза развития культуры продуцента во время ферментационного процесса была названа «трофофаза» — фаза сбалансированного роста. Вторая — «идиофаза» или фаза несбалансированного роста. В течение трофофазы антибиотик в культуральной жидкости не обнаруживается или обнаруживается в незначительных количествах. Во время идиофазы прирост биомассы замедляется. Наступает быстрое накопление антибиотика в культуральной жидкости. В трофофазе источники углерода и азота в среде быстро потребляются, и количество их в среде уменьшается. В идиофазе их потребление замедляется, а в конце идиофазы происходит частичный лизис густой культуры мицелия.
Одновременно в культуре можно обнаружить и некоторое количество новых нитей молодого мицелия, который находится уже в условиях среды, обедненной питательными веществами, и участвует в биосинтезе антибиотика.
Таким образом, интенсивному биосинтезу антибиотика способствует значительное уменьшение в среде источников углерода и азота, особенно легко усваиваемых. Происходит дерепрессия ферментов синтеза антибиотика. Однако выращивание продуцентов с самого начала ферментации на обедненных средах нецелесообразно, так как незначительное накопление биомассы в течение трофофазы ведет в конечном счете и к незначительному накоплению антибиотика малым количеством клеток продуцента.
Для высокопродуктивной ферментации необходимо соблюдать определенные условия. Продуценты антибиотиков выращивают на разных средах как относительно простого состава, так и сложного. Последние получили название комплексных сред. В них могут входить соевая или хлопковая мука, кукурузный экстракт и другие природные многокомпонентные источники питательных веществ. Также в среды вносят индивидуальные органические соединения и минеральные соли. Для каждого штамма-продуцента состав оптимальной для биосинтеза антибиотика среды подбирается отдельно. Это относится даже к штаммам одного вида, продуцирующим один и тот же антибиотик. Существуют и некоторые общие закономерности, учитываемые при работе с большинством продуцентов.
Углеродкатаболитная регуляция является одним из механизмов, воздействующих на биосинтез вторичных метаболитов. Известно, что глюкоза — лучший источник углерода и энергии для любых организмов. Однако быстрый катаболизм глюкозы резко снижает биосинтез антибиотиков. Показано, что глюкоза ослабляет биосинтез беталактамов, аминогликозидов и многих других антибиотиков, образуемых разными продуцентами. Относительно биосинтеза антибиотиков отметим, что глюкоза, фруктоза, сахароза и галактоза — сильные репрессоры этого процесса. Необходимо подчеркнуть, что продукты катаболизма глюкозы подавляют не активность ферментов биосинтеза антибиотиков, а сам синтез этих ферментов. Медленно утилизирующиеся полисахариды (крахмал и др.) более благоприятны для биосинтеза антибиотиков. Не является репрессором биосинтеза и лактоза, которая также медленно утилизируется: при ее гидролизе освобождающаяся глюкоза репрессирует бетагалактозидазу и, в результате, гидролиз лактозы (появление в среде глюкозы) замедляется.
Высокое содержание в среде фосфора (в виде неорганических фосфатных солей) неблагоприятно для биосинтеза большинства антибиотиков. Общая причина этого — обогащение клетки макроэргическими фосфорными соединениями (прежде всего АТФ), что повышает скорость роста мицелия. Накапливается много биомассы, но относительно мало антибиотика. Например, высокоактивные штаммы продуцентов тетрациклиновых антибиотиков содержат в мицелии меньше АТФ и растут медленнее, чем исходные низкоактивные продуценты тетрациклинов. Неблагоприятное действие фосфора на биосинтез беталактамных антибиотиков объясняется на биохимическом уровне следующим механизмом: образование LLD-трипептида — ключевого соединения, с которого начинается синтез пенициллинов и цефалоспоринов, ингибируется глкюкозо-6-фосфатом. Взаимодействие легкоокисляемого сахара и фосфата оказывает отрицательный эффект на биосинтез. Однако все вышеизложенное не означает, что фосфор может быть полностью исключен из среды. Биосинтез антибиотиков снижается при его избыточном количестве, поэтому для каждого штамма-продуцента подбирается оптимальное содержание фосфора в среде.
Аммоний и другие легкоутилизируемые источники азота подобно легкоокисляемым углеводам усиливают рост продуцентов беталактамных, полиеновых антибиотиков (эритромицина, рифамицинов и др.), но отрицательно влияют на их биосинтез. Соевая и хлопковая мука, БВК (белково-витаминный концентрат) медленно расщепляются в процессе ферментации, т. е. из них медленно высвобождаются аминокислоты и ионы аммония, поэтому их используют в качестве компонентов питательных сред, что позволяет получать высокий выход антибиотиков. Механизм отрицательного действия легкоусвояемых источников азота на биосинтез антибиотиков не ясен. Есть данные, что у продуцентов бета- лактамов он связан с уровнем глутаминсинтетазы в мицелии. Известно, что глутамин является донором аминогрупп для ряда аминокислот, а сами аминокислоты, в свою очередь, являются предшественниками беталактамных антибиотиков. Вероятно, что у разных продуцентов механизм этого действия на биосинтез различен. В любом случае неблагоприятное действие легкоусвояемых источников азота на биосинтез обязательно учитывается при подборе сред, а также осуществляется контроль количества таких соединений.
Некоторые первичные метаболиты являются прямыми предшественниками антибиотиков, например, валин включается в трипептид, из которого формируются беталактамные структуры. При избытке валина и высокой концентрации его в мицелии происходит подавление валином собственного биосинтеза по принципу обратной связи. Находясь в избытке, он подавляет активность ацетогидроксисинтетазы — первого фермента своего биосинтетического пути. Однако в результате снижается и образование трипептида, т.е. в конечном счете и беталактамного антибиотика.
Некоторые же первичные метаболиты являются конечными продуктами разветвленного метаболического пути. Одно «ответвление» или один конец этого пути заканчивается первичным метаболитом, другое «ответвление» — антибиотиком. Так, альфа-аминоадипиновая кислота является, с одной стороны, прямым предшественником лизина, с другой — беталактамного антибиотика, так как включается в исходный для его синтеза трипептид. При избытке лизина происходит подавление образования альфа- аминоадипиновой кислоты по принципу обратной связи и, таким образом, снижается синтез не только лизина, но и беталактамного антибиотика (см. рис. 8).
Эти примеры показывают, что у высокоактивных штаммов продуцентов антибиотиков, полученных генетическими методами, должны быть нарушены механизмы обратной регуляции биосинтеза тех первичных метаболитов, которые необходимы для образования антибиотической молекулы. Можно отметить, например, что лизин подавляет биосинтез пенициллина у низкоактивных продуцентов. Полученные из них же «изогенные» высокоактивные штаммы уже не отвечают на избыток лизина в среде снижением биосинтеза антибиотика.
Важность аэрации для обеспечения роста продуцентов на стадии ферментации обусловлена тем, что большинство из них — аэробы. Кислород необходим для биосинтеза ряда антибиотиков, так как последний расходуется при замыкании беталактамного и тиазолидинового колец во время биосинтеза беталактамной структуры. Например, для образования изопенициллина-N из LLD-трипептида молекулярный кислород необходим в стехиометрическом отношении 1:1 (предельное насыщение кислородом культуральной жидкости 30 %). Когда ферментация идет успешно, кислород потребляется со скоростью 1 ммоль/(л∙мин). В целом потребность в кислороде зависит от концентрации биомассы и ее метаболической активности. Оптимизация снабжения кислородом достигается увеличением скорости его переноса.
После стадии ферментации культуральная жидкость содержит растворенный антибиотик, мицелий продуцента, продукты его лизиса, ряд компонентов неиспользованной питательной среды, в том числе высоко- и низкомолекулярные органические вещества и неорганические соли.
Иногда антибиотик содержится не только в культуральной жидкости, но и в мицелии. Культуральная жидкость нередко отличается высокой вязкостью. Поэтому выделить антибиотик из столь сложной гетерогенной системы непросто.
В историческом аспекте можно отметить, что именно неудача химиков при выделении и очистке пенициллина отдалила на десятилетие его внедрение в медицинскую практику. Используемые в настоящее время методы и последовательность операций выделения и очистки разрабатываются применительно к конкретному антибиотику и определяются его физико-химическими свойствами: локализацией, составом культуральной жидкости, ее реологическими и другими характеристиками.
На стадии предварительной обработки культуральной жидкости отделяют растворенный антибиотик от суспензии мицелия и компонентов культуральной жидкости, находящихся в коллоидном состоянии. Если часть антибиотика находится в мицелии, его переводят в водную фазу, например, изменяя pH культуральной жидкости (в случае тетрациклинов). Иногда, наоборот, растворенный и связанный с мицелием антибиотик объединяют в общем осадке, из которого антибиотик затем экстрагируют. Отделяют нативный раствор от мицелия и коллоидных частиц методами фильтрации или центрифугирования, для чего используют барабанные вакуум-фильтры, фильтр-прессы, сепараторы разных конструкций и т.д.
На следующей стадии ставится задача получения антибиотика в виде индивидуального вещества. При этом необходимо учитывать довольно высокую лабильность многих антибиотиков, что ограничивает условия их выделения.
Принцип экстракции органическим растворителем используется при очистке таких важнейших антибиотиков, как пенициллин, эритромицин и некоторых других. При переходе в органический растворитель соответствующие антибиотики освобождаются сразу от многих примесей. Варьируя pH и меняя таким образом растворимость антибиотика в воде (точнее, в буферном растворе), можно многократно переводить антибиотик из одной фазы в другую, освобождаясь каждый раз от определенного количества примесей.
Один из примеров окончания процесса при экстракционном методе выделения и очистки — извлечение пенициллина из органического растворителя бутилацетата, где он находится в виде свободной кислоты: к бутилацетату добавляют насыщенный водный раствор ацетата калия. Выпадает калиевая соль пенициллина. Кристаллы промывают бутанолом и высушивают.
Также при очистке антибиотиков широко используются ионообменные смолы (катиониты и аниониты). Особое значение эти сорбционные методы сыграли в свое время в решении проблемы получения в высокоочищенном виде аминогликозидных антибиотиков — стрептомицина и других, имеющих свойства оснований. Аминогликозиды слаборастворимы в органических растворителях, и вследствие этого экстракционный метод применительно к ним не может быть использован. В производстве стрептомицина могут быть, например, успешно использованы карбоксильные катиониты в натриевой форме. Десорбция осуществляется раствором серной кислоты. После дополнительной процедуры, связанной с пропусканием стрептомицина через сульфокатионит (для удаления ионов натрия), получают сульфат стрептомицина.
Помимо традиционных экстракционных и сорбционных методов при выделении и очистке антибиотиков все большее значение приобретает комплекс приемов, объединяемых под названием мембранной технологии.
При обезвоживании препаратов антибиотиков в зависимости от свойств антибиотика используют лиофильную или распылительную сушку. В последнем случае раствор антибиотика распыляется из форсунок до частиц диаметром 5—25 мкм в токе нагретого до 160 °С воздуха. Сушка происходит в течение долей секунды. Затем препарат фасуют в стерильные флаконы с соблюдением условий, гарантирующих стерильность.
Так как биосинтез антибиотиков ведется в асептических условиях, то при выделении, очистке и получении лекарственных форм также соблюдаются максимально возможные предосторожности против контаминации. Тем не менее проблема стерильности инъекционных препаратов и обсемененности препаратов для наружного применения остается одной из самых сложных для производства как антибиотиков, так и лекарственных средств в целом. Поэтому при обнаружении расфасованных, нестерильных серий препаратов иногда применяют метод радиационной стерилизации, учитывая нестандартность сложившейся ситуации. Определенные виды ионизирующей радиации допустимы для стерилизации лекарственных средств. Соответствующие указания имеются в официальных фармакопейных документах.
Хорошо известно, что ионизирующей радиацией стерилизуются хирургические инструменты, резиновые перчатки, шприцы одноразового пользования и т.п. Следует подчеркнуть, что при такой стерилизации (в минимальных дозах) загрязняющие препарат микроорганизмы теряют способность к размножению и гибнут вследствие повреждения ДНК (происходят сшивки между нуклеотидами, а также разрывы ДНК). При термической стерилизации в отличие от радиационной происходит денатурация многих белков клетки, в результате чего ее повреждения становятся более многочисленными; при стерилизации путем мембранной фильтрации микробные клетки не погибают, а удаляются из лекарственного препарата.
Как уже отмечалось, радиационная или лучевая (жаргонный термин) стерилизация используется на отдельных производствах ввиду объективных трудностей при внедрении технологии получения нового препарата, а иногда и по экономическим причинам. Установлено, что стерилизующая доза ионизирующего облучения составляет 2,5 Мрад (1 рад = 100 эрг/г).
Специалист с высшим фармацевтическим образованием должен занимать четкую и грамотную позицию в отношении бытующей радиофобии, выражающейся в том, что радиационная стерилизация может якобы привести к наведенной радиоактивности облученных препаратов. Разрешенные для стерилизации лекарств гамма-лучи изотопа кобальта (60Со) и быстрые электроны с энергией не выше 5 МэВ, получаемые на ускорителях, не могут вызвать наведенной радиации у обработанных ими препаратов независимо от поглощенной дозы облучения, так как неспособны расщепить атомное ядро.
Гамма-лучи (60Со) в воздухе распространяются на несколько десятков метров, в воде — на несколько десятков сантиметров, в свинце — на несколько сантиметров. На промышленной установке защитный слой воды, окружающий герметичную стерилизационную камеру, где находятся стандартные стержни с 60Со длиной до 1 м и упаковки со стерилизуемым лекарственным препаратом, должен составлять несколько метров. Стерилизационная камера снабжена автоматизированным дистанционным управлением, позволяющим вдвигать в нее и удалять из нее стержни с кобальтом, разъединяя таким образом источник облучения и упаковки со стерилизуемым препаратом. Режим стерилизации обычно подбирается с таким расчетом, чтобы стерилизующая доза (2,5 Мрад) набиралась облучаемым препаратом примерно за сутки. При этом следует иметь в виду, что период полураспада 60Со составляет около пяти лет. Естественно, что работа на установках с радиоактивным кобальтом постоянно требует особых мер предосторожности.
Установка, где для стерилизации используются быстрые электроны, во многом принципиально отличается от рассмотренной. Проникающая способность электронов, разогнанных до разрешаемого для стерилизации лекарств показателя, невелика. Электроны не могут «пронизать» несколько рядов флаконов или ампул. Чтобы набрать стерилизующую дозу в 2,5 Мрад, требуются секунды или доли секунд. Поэтому флаконы подают по одному с помощью транспортера к соответствующему «окошку», через которое
в них набирается стерилизующая доза. После выключения такая стерилизационная установка становится абсолютно безопасной в радиационном отношении.
Значительный опыт по использованию радиационной стерилизации биотехнологических препаратов накоплен при обработке антибиотиков: стерилизации подвергались расфасованные по флаконам лиофильно высушенные субстанции, соли антибиотиков и их препараты с разными наполнителями.
В ряде случаев препараты искусственно заражали микроорганизмами разных видов и их спорами. Стерилизующая доза в 2,5 Мрад обусловливала гарантированную стерильность. При этом облученные препараты — большинство антибиотиков (природные и полусинтетические пенициллины, аминогликозиды, тетрациклины и ряд других) сохраняли активность и удовлетворяли фармакопейным тестам. Исключение составляли полнены, т.е. структуры с сопряженными двойными связями (например, нистатин, который при облучении заметно терял активность).
При сравнении их с необлученными препаратами можно было выявить некоторые отличия: белые (бесцветные) порошки теряли «блестящий» оттенок, приобретая матовый, а порошки красного (актиномицины) и желтого (тетрациклины) цвета тускнели.
Под влиянием облучения изменяется и кристаллическая решетка стекла. Оно темнеет, мутнеет и приобретает, таким образом, непривлекательный с коммерческой точки зрения вид, хотя полностью сохраняет свои функциональные качества. Потемнение обратимо, но при комнатной температуре исчезает медленно (в течение нескольких месяцев). Не выпускать облученные препараты в течение такого срока в аптечную сеть — значит сократить для потребителя срок годности облученных серий. Теоретически для изготовления флаконов и ампул можно использовать стекло с некоторыми редкоземельными элементами, однако это стекло слишком дорого для изготовления из него сотен миллионов единиц стандартных изделий.