Биотехнология - Ю.О. Сазыкин 2006
Частная биотехнология
Проблемы поиска, создания и применения антибиотиков в медицинской практике
Антибиотикорезистентность - Молекулярные механизмы
Выделяют четыре основных механизма резистентности антибиотиков:
✵ изменение конформации внутриклеточной мишени для данного антибиотика. Антимикробный агент проникает в клетку, но его мишень (транспептидаза лептидогликана, рибосома, ДНК-гираза и т.д.) его не «связывает» и подавления метаболизма не происходит;
✵ уменьшение проницаемости оболочки микробной клетки для антибиотика. Антибиотик хотя и проникает в клетку, но в незначительных количествах;
✵ появление в оболочке клетки системы активного «выброса», проникающего в клетку антибиотика, вследствие чего его внутриклеточная концентрация не может оказываться высокой;
✵ ферментативная инактивация антибиотика защитными ферментами. Этот последний тип защиты микробной клетки для нее наиболее эффективен и является очень частой причиной неудач антибиотикотерапии. Ферментативной инактивации подвергаются все важнейшие группы антибиотиков: пенициллины и цефалоспорины, аминогликозиды, эритромицин, а также некоторые другие антибиотики.
Формирование в бактериальной клетке указанных защитных механизмов обусловлено появлением «генов резистентности» не только в хромосоме. Большое внимание привлекают и внехромосомные (плазмидные) генетические элементы микробной клетки — кольцевые молекулы ДНК, имеющие размер в сотни раз меньший, чем хромосомы. Плазмиды, несущие гены резистентности к антибиотикам, получили название R-плазмид (более старый термин — R-факторы).
Основная опасность плазмидной резистентности в генетическом плане состоит в том, что плазмиды передаются из клетки в клетку конъюгацией (аналог полового процесса) — без деления клетки, однако плазмида при этом реплицируется. Таким образом, одна клетка может быстро передать резистентность большому количеству клеток. Этому способствует и многокопийность плазмид некоторых типов. Возник даже термин «инфекционная резистентность», т.е. «заражение резистентностью» одних клеток от других.
Плазмидная резистентность редко встречается лишь в случае первого из перечисленных выше механизмов резистентности. Причиной антибиотикорезистентности, вызванной изменением конформации внутриклеточной мишени, являются спонтанные мутации в структурном гене, определяющем структуру той мишени-макромолекулы, с которой «связывается» антибиотик. В результате таких мутаций меняется аминокислотная последовательность в ферменте или в рибосомном белке, что ведет и к изменению конформации молекулы, перестающей связывать антибиотик.
Мутировавшие хромосомные гены могут быть согласно принятому термину «мобилизованы», т.е. оказаться в плазмидах и быть переданы в другие клетки за счет механизмов распространения плазмид. Однако переноса резистентности при этом в большинстве случаев не происходит. В новой клетке-хозяине будут работать (экспрессироваться) как свои (хромосомные), так и чужие (плазмидные) структурные гены, и в результате часть мишеней для антибиотика будет «чувствительной» к нему — будет его связывать, а часть — резистентной. В таких случаях антибиотикочувствительность доминирует над антибиотикорезистентностью.
Именно поэтому при выявлении резистентности за счет изменения конформации мишеней гены резистентности оказываются локализованными в хромосомах. Исключения здесь связаны с теми случаями, когда изменения конформации мишени происходят не вследствие мутации в ее структурном гене, а в результате ферментативной модификации уже синтезированной мишени. Ген фермента, модифицирующего мишень, может иметь не только хромосомную, но и плазмидную локализацию.
Особенно часто плазмидная локализация генов резистентности встречается при ферментативной инактивации антибиотиков. Иногда в одной плазмиде оказываются локализованными несколько генов, кодирующих ферменты, воздействующие на антибиотики разных групп. Отсюда возникло понятие полирезистентности микроорганизмов. Полирезистентные штаммы возбудителей инфекций представляют серьезную проблему в инфекционной клинике.
Мишени, на которые направлены антибиотики, располагаются или в цитоплазматической мембране (ферменты биосинтеза пептидогликана), или в самой цитоплазме (рибосомы, ферменты биосинтеза белка, биосинтеза нуклеиновых кислот и т.д.). Чтобы достигнуть мишени, антибиотик должен проникнуть через внешнюю мембрану и клеточную стенку, а иногда через цитоплазматическую мембрану (если мишени находятся в цитоплазме). Резистентность к антибиотикам нередко обусловлена особыми изменениями в оболочке бактериальной клетки. Под оболочкой подразумевается совокупность, состоящая из внешней мембраны (только у грамотрицательных бактерий), клеточной стенки и цитоплазматической мембраны.
Клеточная стенка, хотя и является жесткой «решетчатой» структурой, построенной из пептидогликана, не может препятствовать проникновению небольших молекул антибиотиков.
За последние десятилетия неоднократно отмечалось возрастание роли грам отри нательной микрофлоры в инфекционной патологии. Это относится к инфекционным осложнениям при хирургическом вмешательстве, к урологическим инфекциям и т.д. Большую роль в инфекционном процессе играют грамотрицательные, неферментирующие бактерии.
Возрос интерес к присущей всем этим микроорганизмам внешней мембране. Основные компоненты последней: липополисахариды, липопротеиды, фосфолипиды и специфические белки — порины (от слова пора); тримеры этих белков формируют поры или водные каналы, через которые из внешней среды в клетку диффундируют низкомолекулярные питательные вещества (аминокислоты, небольшие пептиды, моно-, ди-, трисахара, неорганические ионы и т.п.).
Пориновые каналы «осциллируют», т.е. находятся то в открытом, то в закрытом состоянии. В бедной среде канал в открытом состоянии находится дольше, чем в богатой среде. Этими же пориновыми каналами «пользуются» и антибиотики при проникновении в клетку.
Антибиотики, быстро проникающие через водные каналы поринов, относятся к препаратам широкого спектра действия — подавляют рост и грамотринательных, и грамположительных бактерий. Антибиотики, молекула которых имеет большие размеры, например, эритромицин, через пориновые каналы не проникают и поэтому не эффективны против грам отрицательных бактерий, хотя высокоактивны против грамположительных. Отметим, что на проникновение молекулы влияют не только ее размеры, но и стерические особенности, включая те, которые обусловливают ее «гибкость». Учитывается не только диаметр водных каналов, но и свойства формирующих их белков-поринов. Существуют катионоселективные и анионоселективные каналы. Применительно к антибиотикам это означает, что в случае бактерии, у которой во внешней мембране преобладают катионоселективные каналы, в клетку лучше будут проникать антибиотики основной природы.
Примером является бензилпенициллии. Его относительно небольшая молекула очень слабо проникает через пориновые каналы кишечной палочки, так как у этого организма, как и у многих других грамотрицательных бактерий, пориновые каналы катионоселективны.
В то же время у относительно небольшой группы грамотрицательных кокков пориновые каналы анионоселективны, что способствует проникновению в их клетку бензилпенициллина. Отсюда следуют общеизвестные врачам факты: бензилпенициллии непригоден для лечения кишечных инфекций, но высокоактивен при лечении гонореи. Катионо- и анионоселективность пориновых каналов определяется средой обитания вида бактерии. Так, катионо-селективность пориновых каналов у кишечной палочки позволяет этой, обитающей в кишечнике, бактерии избежать неблагоприятного действия поступающих в кишечник желчных кислот.
Не только размеры молекулы антибиотика, стерические особенности и заряд определяют возможность и скорость ее проникновения через пориновые каналы. Так как каналы заполнены водой, большое значение имеет степень гидрофобности молекулы при высокой гидрофобности проникновение антибиотика заметно снижается.
Кроме пориновых каналов — главного пути проникновения антибиотиков через барьер внешней мембраны в клетку — существуют и другие возможности транспорта:
✵ за счет специфической системы первичного метаболита, если молекула антибиотика сходна по структуре или является аналогом метаболита;
✵ за счет липидных участков внешней мембраны бактерий, если это липофильные вещества (в том числе и антибиотики).
Некоторые антибиотики нуклеозидной природы используют специфические системы транспорта нуклеозидов через внешнюю мембрану. Например, был получен полусинтетический цефалоспорин с катехолоподобной группировкой, который в соответствии с размерами своей молекулы не должен был проникать через пориновые каналы. Однако благодаря наличию вышеуказанной группировки, он образовывал комплексы с ионами железа и проникал в грамотрицательную клетку, используя специфическую систему транспорта железа. Иными словами, данный цефалоспорин, имитируя переносчик железа, преодолевал барьер мембраны тем же путем, что и переносчик. Вместе с тем антибактериальная активность определенных полусинтетических липофильных пенициллинов и тетрациклинов обусловлена их проникновением через липидные участки внешней мембраны.
Изучение механизмов антибиотикорезистентности штаммов грамотрицательных бактерий, выделенных из клинического материала, показало, что нередко резистентность обусловлена уменьшением количества пориновых белков в мембране, и, соответственно, количества пориновых каналов. В результате проникновение антибиотиков в клетку замедляется.
Еще один механизм резистентности связан с изменением уже самих пориновых белков и сужением диаметра пориновых каналов.
В обоих случаях резистентность является неспецифической и ослабляется, хотя и в разной степени, при проникновении в клетку антибиотиков, диффундирующих через пориновые каналы. Но полного прекращения проникновения антибиотиков в клетку при указанных механизмах резистентности произойти не может, поскольку пориновые каналы жизненно необходимы для транспорта в нее питательных веществ, а их полное исчезновение в мембране привело бы к гибели клетки. Показано, что уровень резистентности бактерий за счет изменений в их внешней мембране ниже, чем, например, при наличии защитных, инактивирующих антибиотики ферментов.
Однако среди штаммов, выделяемых в клинике, часто обнаруживаются такие, у которых выявляются сразу два механизма резистентности: ослабление проникновения антибиотика через внешнюю мембрану и ферментативная инактивация антибиотика. В этом случае уровень антибиотикорезистентности особенно высок.
Одна из основных причин, вызывающих потребность в создании и внедрении в медицинскую практику новых беталактамных антибиотиков, — распространение среди патогенных микроорганизмов способности продуцировать ферменты, катализирующие расщепление беталактамного кольца у пенициллинов и цефалоспоринов, внедренных в медицинскую практику. Они получили название пенициллиназ и цефалоспориназ в соответствии с их субстратной специфичностью и избирательностью действия на пенициллины или цефалоспорины.
Ферментативное расщепление (гидролиз) беталактамного кольца ведет к полной инактивации беталактамного антибиотика. Это было показано на примере бензилпенициллинов еще в 1940-х гг. Э. Чейном, впервые очистившим пенициллин. Продукт ферментативного расщепления бензил пенициллина — пенициллоиновая кислота:
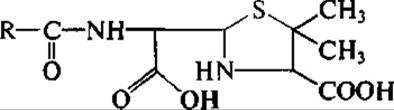
полностью не активна. Это легко объяснимо, так как механизм действия беталактамных антибиотиков связан именно с расщеплением беталактамного кольца и ацилированием гидроксильной группы серина в активном центре ферментов-мишеней. В случае же пенициллиназ и цефалоспориназ беталактамное кольцо также расщепляется, и антибиотик быстро освобождается из активного центра этих ферментов с присоединением атома водорода и гидроксила.
В настоящие время пенициллиназы и цефалоспориназы составляют обширную группу одинаковых по механизму действия, но разнящихся по субстратной специфичности ферментов, объединенных под общим названием «беталактамазы». Известно, что беталактамазы произошли от транспептидаз и D,D-карбоксипептидаз пептидогликана, т.е. из ферментов-мишеней в бактериальной клетке, необратимо инактивируемых беталактамами.
Гены беталактамаз, особенно цефалоспориназ, локализуются как в бактериальной хромосоме, так и в плазмидах, которые не находятся под столь строгим регуляторным контролем в клетке, как хромосомный генетический материал, и могут существовать во многих копиях, что повышает количество генов беталактамаз и уровень самих ферментов в клетке. Между хромосомами и плазмидами нередко происходит обмен генами, в частности беталактамаз.
Очень важно, что гены беталактамаз, локализованные в плазмиде, могут передаваться при конъюгации вместе с плазмидой в другую клетку. Это означает, что плазмидные гены быстро распространяются по клеточной популяции, для чего не нужно даже деления клеток. Возможен и межвидовой перенос плазмидных генов беталактамаз. например, из клетки кишечной палочки в клетку сальмонеллы и т. п.
Беталактамазы могут быть как конституитивными (у одних штаммов бактерий), так и индуцибельными (у других штаммов). Иногда в одной клетке могут оказаться две разных беталактамазы, причем одна из них образуется постоянно, т.е. конституитивно, тогда как другая обнаруживается, когда клетка попадает в среду с беталактамным антибиотиком.
Способность к индукции беталактамаз является отрицательным свойством беталактамных антибиотиков с позиций медицинской практики, поэтому новые беталактамные структуры оцениваются при изучении их свойств не только на устойчивость к ферментативной инактивации, но и на способность индуцировать беталактамазы. Последняя зависит от того, с какой мишенью, т.е. с каким из PBPs связывается беталактамный антибиотик, так как именно PBPs являются «сенсорами», запускающими сложный механизм индукции беталактамаз.
Схематически этот механизм выглядит следующим образом: беталактамный антибиотик, находящийся в среде, реагирует с одним из белков, принадлежащих к PBPs. Его взаимодействие с белком ведет к изменению конформации этого белка. Меняются биофизические параметры белка, сигнал об этом передается на специальный трансмембранный белок, молекула которого пересекает цитоплазматическую мембрану и выходит на ее внешнюю поверхность. Далее сигнал последовательно передается на первый и второй цитоплазматические белки, включенные в систему индукции ферментов и, наконец, на белок-репрессор, уже непосредственно регулирующий экспрессию именно гена беталактамазы. В результате репрессор перестает подавлять экспрессию этого гена. Соответственно, начинаются его экспрессия и синтез молекул информационной РНК, которая далее поступает в рибосомную систему, где на ней как на матрице синтезируются молекулы беталактамазы.
Система индукции беталактамаз специфична: на своем начальном участке PBPs являются первичными сенсорами в отличие от других белков мембраны, а на конечном участке — белок репрессор специфичен только для гена беталактамазы. Среди беталактамных антибиотиков обнаружены как очень активные индукторы беталактамаз, так и малоактивные, которые более предпочтительны для использования в клинике.
Ввиду несомненного сходства многих беталактамаз с их ферментами-мишенями был предпринят поиск специфических ингибиторов беталактамаз. Среди природных беталактамов и продуктов их химической трансформации были отобраны ингибиторы беталактамаз, воздействующие и на беталактамазы, и на транспептидазы пептидогликана, т.е. обладающие антибактериальной активностью.
Практическая ценность ингибиторов беталактамаз обусловлена тем, что их используют вместе с беталактамными антибиотиками, которые чувствительны к беталактамазам. Ингибиторы беталактамаз защищают эти антибиотики от ферментативной инактивации. Широкую известность получили такие ингибиторы, как клавулановая кислота (слева) и сульбактам (справа):
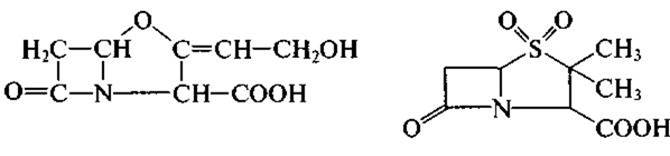
и некоторые другие. Однако необходимо учитывать, что любой конкретный ингибитор не может воздействовать на все многочисленные типы беталактамаз. Спектр действия каждого ингибитора ограничен беталактамазами лишь нескольких типов, распространенных среди бактерий.
За рубежом выпускаются смесь полусинтетического пенициллина (ампициллина) с сульбактамом (2:1) под фирменным названием «уназин», а также препарат сультамициллин — химическое соединение ампициллина с сульбактамом. Получил практическое применение и препарат аугментин, являющийся смесью амоксициллина (полусинтетического пенициллина) с клавулановой кислотой. При подборе комбинаций ингибиторов беталактамаз с беталактамными антибиотиками важно иметь в виду и соблюдать следующее условие: фармакокинетика ингибитора и антибиотика должна быть сходной. Иными словами, их распределениє по органам и тканям организма, пути выведения (например, преимущественно с мочой или с желчью), время циркуляции в организме должны быть близкими. Ингибитор не сможет выполнять свою защитную роль, когда его концентрация в местах локализаций антибиотика окажется низкой или если он будет выводиться из организма гораздо быстрее, чем антибиотик.
Ферментативная инактивация аминогликозидов — наиболее часто встречающийся механизм резистентности к этим антибиотикам. Ферменты, инактивирующие аминогликозиды, существенно отличаются от беталактамаз. Во-первых, они не являются гидролазами, т.е. их активность выявляется не просто в водной среде, а требует для своего проявления более сложной реакционной смеси. Во-вторых, если часть беталактамаз — грамположительных микроорганизмов относится к внеклеточным ферментам, что облегчает их обнаружение, то ферменты, катализирующие инактивацию аминогликозидов, практически всегда имеют только внутриклеточную локализацию.
Ферменты, инактивирующие аминогликозидные антибиотики, относятся по современной номенклатуре и классификации ферментов к классу трансфераз. Это означает, что они не расщепляют молекулу аминогликозидных антибиотиков, а переносят (англ, transfer) на нее определенные фрагменты, катализируя замещение гидроксильных групп у аминогликозидов остатками фосфорной или адениловой кислоты, а аминогруппы аминогликозидов замещают остатками уксусной кислоты. Таким образом, инактивирующие аминогликозиды ферменты включают фосфотрансферазы, аденилтрансферазы, ацетилтрансферазы. Важнейшее свойство данных ферментов заключается в том, что каждый фермент катализирует замещение только одной функциональной группы в молекуле аминогликозидного антибиотика. Однако обычно этого бывает достаточно для потери антибиотиком своей активности.
Донором переносимых на аминогликозидные антибиотики остатков фосфорной и адениловой кислоты является широко известное макроэргическое соединение аденозин-3-фосфорная кислота (АТФ). В реакционной смеси АТФ должна присутствовать; вне клетки (в среде) ферменты не могут играть защитную роль, так как для проявления их активности необходима АТФ в высокой концентрации. Для проявления активности аминогликозид-ацетилтрансфераз необходимо присутствие в реакционной смеси уксусной кислоты, кофермент А и АТФ (или, вместо двух первых компонентов, одного ацетилкофермента А).
Воздействующие на аминоглинозиды ферменты обычно локализованы в цитоплазматической мембране бактерий, а в случае грамотрицательных бактерий — в псриплазматическом пространстве — между клеточной стенкой и внешней мембраной. Такая локализация ведет к инактивации аминогликозидов во время их проникновения в клетку и защищает от них мишени (рибосомы).
Гены ферментов, катализирующих фосфорилирование, ацетилирование или аде титрование аминогликозидов, как правило, локализованы у бактерий в R-плазмидах. Локализация таких генов в бактериальных хромосомах встречается крайне редко. Таким образом, и здесь наблюдается отличие от беталактамаз, гены которых встречаются как в плазмидах, так и в бактериальных хромосомах.
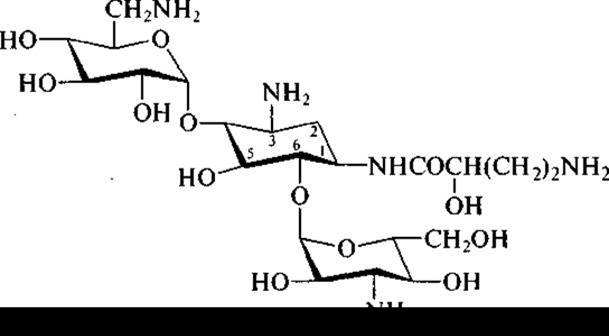
После установления механизмов ферментативной инактивации аминогликозидных антибиотиков резистентными к ним бактериями начались попытки целенаправленной трансформации молекул аминогликозидов с целью сделать их «нечувствительньми» к инактивирующим ферментам. Так, в молекуле канамицина группа NH2 В первом положении в аминоциклитольном фрагменте молекулы была замешена остатком L-y-амино-а-оксимасляной кислоты. Это привело к общему изменению конформации природной молекулы, при сохранении у нее почти всех функциональных групп. Сохранилась антибактериальная активность, но была в то же время потеряна «чувствительность» ко всем ферментам, распространенным среди резистентных микроорганизмов, инактивирующим аминогликозиды. Полученное производное, названное «амикацин», оказалось высокоэффективным против штаммов бактерий, имеющих фосфотрансферазы, ацетилтрансферазы и аденилтрансферазы, инактивирующие исходный канамицин.
В настоящее время амикацин — наиболее эффективный полусинтетический аминогликозидный антибиотик, поскольку он подавляет рост микроорганизмов, резистентных к природным аминогликозидам, за счет ферментативной инактивации последних как наиболее распространенного механизма резистентности:
Резистентность микроорганизмов к антибиотикам тетрациклиновой группы: тетрациклину, окситетраииклину, хлортетрациклину получила широкое распространение в связи с их многолетним использованием в медицине, а также в животноводстве в качестве ростстимулирующих добавок к кормам сельскохозяйственных животных.
В настоящее время в медицинской практике используется в основном тетрациклин, а в животноводстве — все три указанных выше антибиотика.
Изучение механизмов резистентности бактерий к тетрациклинам привело к результатам, резко отличающимся от тех, что были выявлены в случае беталактамов и аминогликозидов. Так, ферментативной инактивации тетрациклинов резистентными к ним микроорганизмами обнаружено не было.
В редких случаях резистентность была связана с защитой или «экранированием» от тетрациклинов (ингибиторов белкового синтеза) рибосом. У резистентных штаммов был найден белок, предотвращающий доступ тетрациклинов к местам их связывания на рибосоме.
Наиболее часто встречающийся механизм тетрациклинорезистентности обусловлен изменениями, происходящими в оболочке, точнее в цитоплазматической мембране бактериальной клетки. Известно, что в клетках резистентных штаммов тетрациклины не накапливаются. При этом в цитоплазматической мембране присутствуют несколько новых белков, которые отсутствуют в мембране тетрациклиночувствительных штаммов. Эти новые белки, появляющиеся в цитоплазматической мембране при тетрациклинорезистентности, являются белками, составляющими систему активного «выброса» тетрациклинов, проникающих в клетку. Иными словами, тетрациклины проходят через оболочку бактериальной клетки, в том числе и через цитоплазматическую мембрану, однако они не успевают прореагировать с рибосомами, так как быстро удаляются или «выбрасываются» в среду.
В настоящее время в медицинскую практику внедрено несколько продуктов химической трансформации природных тетрациклинов. Наиболее важным из них является доксициклин (6-дезокси-5-окситетрациклин), который гораздо дольше циркулирует в организме, чем природные тетрациклины.
Существует несколько механизмов резистентности к эритромицину.
1. Рибосомы резистентных клеток не «связывают» эритромицин. В результате антибиотик теряет способность тормозить белковый синтез. Причиной этого является метилирование рибосомной РНК в большой субъединице бактериальной рибосомы. В резистентных клетках специфическая метилаза катализирует введение метальных групп в строго определенный остаток аденина в молекуле рибосомной РНК. В результате изменяется конформация всей большой рибосомной субъединицы, и эритромицин теряет способность «связываться» с ней и вообще с рибосомой.
2. Ферментативное расщепление макроциклического лактонного кольца, что ведет к потере активности эритромицина.
3. Фосфорилирование или гидроксилирование по ОН-группе одного из присутствующих в молекуле антибиотика сахаров.