Биотехнология - Ю.О. Сазыкин 2006
Общая биотехнология
Биобъекты: способы их создания и совершенствования
Совершенствование биообъектов методами клеточной инженерии
В течение многих лет мутагенез и селекция успешно применялись и будут широко применяться при совершенствовании биообъектов в дальнейшем.
Однако постепенно были выявлены существенные ограничения в достижении ставящихся биотехнологами целей. И, хотя главный путь снятия таких ограничений связан с применением методов генетической инженерии, определенные перспективы имеет и клеточная инженерия — «насильственный» обмен участками хромосом у прокариот или участками и даже целыми хромосомами у эукариот. В результате создаются неприродные биообъекты, среди которых могут быть отобраны продуценты новых веществ или организмы с ценными в практическом отношении свойствами.
Перспективы клеточной инженерии заключаются прежде всего в том, что с ее помощью возможно получение межвидовых и межродовых гибридных культур микроорганизмов, а также гибридных клеток между отдаленными в эволюционном отношении многоклеточными организмами. Далее необходимо сделать оговорку, что материал, относящийся к получению гибридов между лимфоцитами и опухолевыми клетками излагается в гл. 10. В данной главе техника клеточной инженерии рассматривается применительно к микроорганизмам и в соответствии с теми целями, которые ставятся перед ними как биообъектами. В качестве наиболее простою примера можно взять микроорганизмы прокариот (с одной хромосомой в клетке).
Для обмена фрагментами хромосомы у прокариот необходимо предварительно получить из их клеток лишенные клеточной стенки протопласты; затем осуществить слияние (фузию) протопластов с образованием диплоидов; полученные диплоиды инкубировать в течение нескольких часов для «ломки» и воссоединения кольцевых хромосомных нитей в разных вариантах. Затем суспензию протопластов высевают на твердую питательную среду, при этом часть диплоидов превращается в гаплоиды — способные к размножению клетки, которые образуют соответственно колонии. Их изучают и отбирают культуры, приобретающие новые качества, представляющие интерес для биотехнолога (рис. 2).
Таким образом, первый этап работы связан с удалением у микроорганизмов клеточной стенки. У прокариот — эубактерий и актиномицетов — многоклеточных бактерий клеточная стенка состоит из жесткого полимера пептидогликана, поддерживающего форму клетки и обеспечивающего защиту цитоплазматической мембраны от перепада осмотического давления между внешней средой и цитоплазмой.
Пептидогликан может быть расщеплен с помощью ферментов (гидролаз пептидогликана), из которых самым известным является лизоцим, расщепляющий полисахаридные нити пептидогликана. Источником лизоцима как лабораторного реагента является белок куриного яйца.
Ферментативная деградация клеточной стенки в обычных условиях культивирования бактерий сразу же ведет к их лизису из-за разницы в осмотическом давлении. При этом ни цитоплазматическая, ни внешняя (у грамотрицательных бактерий) мембраны не выдерживают целостности. Этим давно известным явлением объясняется, например, литический эффект пенициллина, который, подавляя синтез пептидогликана, нарушает баланс между действием его синтетаз и гидролаз. Из изложенного следует, что удалить клеточную стенку и в то же время сохранить целостность мембраны протопласта можно, лишь выровняв осмотическое давление внутри клетки и в среде. Этот простой путь тем не менее долгое время оставался неизвестным, пока Дж. Ледерберг не показал его реальность. С тех пор работы по клеточной инженерии микроорганизмов базируются на протопластировании: для получения протопластов клеточную стенку удаляют ферментативной обработкой в «гипертонической» среде с 20 % раствором сахарозы или маннита, иногда с 10 % раствором натрия хлорида в зависимости от определенных особенностей биообъекта и преследуемых целей. Превращение суспензии клеток в суспензию протопластов обычно контролируют методом фазовоконтрастной микроскопии.
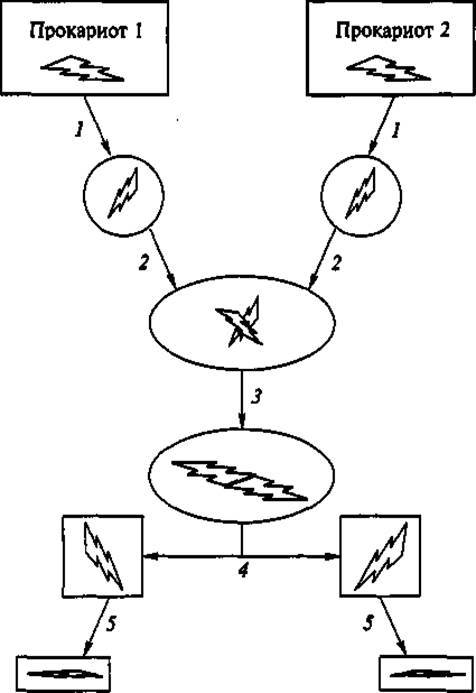
Рис. 2. Формирование протопластов у прокариот:
1 — ферментативная деградация клеточной стенки; 2 — слияние протопластов; 3 — ломка и рекомбинация хромосом, образование диплоидов; 4 — образование гаплоидов с рекомбинантной хромосомой; 5 — регенерация протопластов
Если биообъект принадлежит к микроскопическим (плесневым и дрожжевым) грибам, то для получения протопластов используют, как правило, не лизоцим, а комплексный ферментный препарат, выделенный из пищеварительного тракта виноградной улитки Helix pomatia. Связано это с тем, что состав клеточной стенки у грибов более сложен, чем у бактерий. Она состоит из таких полимеров, как хитин, глюканы, маннопротеин, для каждого из которых необходим свой, деградирующий его фермент. Известно, что по набору ферментов и их каталитической активности наиболее эффективен желудочный сок виноградной улитки в ранний весенний сезон, когда улитки появляются на виноградных плантациях, но их желудок еще не заполнен перевариваемыми виноградными листьями. Неочищенный экстракт из пищеварительного тракта виноградной улитки лиофильно высушивают и используют как комплексный ферментный препарат для получения протопластов из клеток грибов.
Следующий этап работы состоит в объединении суспензий двух образцов протопластов, принадлежащих разным штаммам или разным видам, в более редких случаях — даже разным родам. Добиться слияния двух протопластов разного происхождения — довольно сложная задача. Частота слияния резко повышается при добавлении к протопластам полиэтиленгликоля, обладающего свойствами детергента. В случае прокариот образующиеся протопласты имеют двойной набор хромосомного материала, т. е. это протопласты с двумя хромосомами. В гипертонической среде такие протопласты сохраняют свою целостность.
После промывания гипертонической средой, но уже не содержащей гидролизующего клеточную стенку ферментного препарата, протопласты высеиваются на твердую питательную среду. При этом у определенной части протопластов диплоидные формы переходят в гаплоидные; в результате образуются способные к размножению нормальные клетки с клеточной стенкой. Эти клетки формируют на твердой среде колонии. Однако во время нахождения протопластов в диплоидной форме в некоторых из них происходит «ломка» и воссоединение хромосомных нитей, при котором в одну хромосому может включиться фрагмент другой. Таким образом, при регенерации протопластов формируются нормальные клетки, часть которых имеет гибридные хромосомы. Культуры таких клеток обладают новыми свойствами. В качестве примера можно привести получение «гибридных» антибиотиков.
Известно, что среди актиномицетов есть принадлежащие к разным видам продуценты антибиотиков гликозидной структуры с варьирующими агликонами и сахарами. Так, антибиотик эритромицин имеет 14-членный макроциклический агликон и два сахара (дезозамин и кладинозу), присоединенных к нему гликозидной связью (см. с. 110); а у антибиотиков — антрациклинов агликон состоит из четырех сконденсированных углеродных шестичленных колец, соединенных с аминосахаром (см. с. 112).
С помощью клеточной инженерии были получены продуценты таких антибиотиков, у которых макролидный агликон эритромицина был связан с углеводной частью, соответствующей антрациклинам, и наоборот, антрациклиновый агликон с сахарами, свойственными эритромицину. Аналогичные работы ведутся по получению гибридных беталактамных антибиотиков.
Оценивая перспективы использования процедуры протопластирования в биотехнологии, следует отметить, что слияние даже принадлежащих к одной популяции протопластов и последующая их регенерация могут привести к тому, что гены биосинтеза целевого продукта окажутся в одном гаплоиде в удвоенном состоянии (его хромосома будет обогащена двумя кластерами генов биосинтеза). Иными словами, в одной хромосоме сосредоточится биосинтетический потенциал (применительно к целевому продукту) двух хромосом. Разумеется, такой особенностью может обладать лишь небольшая часть полученных после регенерации культур. Поэтому после протопластирования выявляются «плюс»- и «минус»-варианты продуцента по сравнению с производительностью исходной культуры.
Отбор «плюс»-вариантов затруднений не вызывает, однако добиться их длительного использования в производстве далеко не просто. После нескольких пересевов их производительность, постепенно снижаясь, приближается к производительности исходной культуры. Причины этого явления недостаточно ясны. По- видимому, репарационные системы культуры приближают ее биосинтетические показатели к естественным. Для замедления возвращения «плюс»-вариантов к исходным показателям предлагаются два пути.
Первый — обработка «плюс»-вариантов мутагенами и отбор мутантов с пониженной способностью к возвращению измененных участков ДНК к норме. Второй связан с возможностью использования инженерной энзимологии, точнее, иммобилизованных биообъектов. Можно иммобилизовывать клетки «плюс»-варианта, т. е. связывать их с нерастворимым носителем и использовать в производстве, не прибегая к пересевам в течение определенного времени (от нескольких недель до нескольких месяцев). Технически это довольно непросто, однако такой путь представляет интерес как новое направление в биотехнологии — сочетание клеточной инженерии с инженерной энзимологией непосредственно в производстве.
В заключение отметим, что протопласты — основной объект, которым оперирует клеточная инженерия, довольно широко используются и в генетической инженерии. При этом обмен молекулами и фрагментами молекул ДНК у протопластов достигается легче, чем при трансформации клеток с их более сложной оболочкой.